名校
1 . 铬铁矿的主要成分的化学式为 FeO ·Cr2O3,还含有 SiO2、Al2O3等杂质。工业上常采用固体碱熔氧法用铬铁矿粉制备重铬酸钾,流程为

(1)铬铁矿经粉碎处理的目的是__ (填“加快”或“减慢”)反应速率。
(2)灼烧是中学化学中常用的操作方法,如在实验室中将铬铁矿和碳酸钠固体混合物灼烧,该过程不需要的仪器是___ (填序号)。
A.陶瓷坩埚 B.铁坩埚 C.三脚架 D.泥三角 E.酒精灯 F.蒸发皿
(3)铬铁矿中的 SiO2和 Al2O3 在反应器中与纯碱共热反应转变为可溶性盐,故 Al2O3与碳酸钠反应生成的可溶性盐的名称 为:________________ 。
(4)化合物 NaFeO2中 Fe 的化合价为______ (填序号)。
A.+2 B.+3 C.+6
该价态对应的简单离子与该元素常见的另一种简单离子相比 ,更稳定的是______ (填序号)。
A.Fe3+ B .Fe2+
(5)通过途径 1 从 Na2CrO4溶液获得 K2Cr2O7晶体,操作步骤有:酸化→加 KCl 固体→操作 a→过滤→洗涤 →干燥
①操作 a 的名称____________________ (填序号)。
A.蒸发结晶 B.蒸发浓缩,冷却结晶 C.蒸馏 D. 萃取
②“酸化”调节溶液 pH<5 其主要目的是_____ (填序号)。
A.增大H+浓度,加快反应速率
B.使2CrO +2H+
+2H+ Cr2O
Cr2O +H2O的平衡向正向移动,尽量将CrO
+H2O的平衡向正向移动,尽量将CrO 转化为Cr2O
转化为Cr2O
(6)将最后制得的晶体溶解、酸化就制成了化学实验中常用的氧化剂——酸性重铬酸钾。酸化过程中常用的酸是_________ (选填“盐酸”、“硫酸”或“硝酸”)。

(1)铬铁矿经粉碎处理的目的是
(2)灼烧是中学化学中常用的操作方法,如在实验室中将铬铁矿和碳酸钠固体混合物灼烧,该过程不需要的仪器是
A.陶瓷坩埚 B.铁坩埚 C.三脚架 D.泥三角 E.酒精灯 F.蒸发皿
(3)铬铁矿中的 SiO2和 Al2O3 在反应器中与纯碱共热反应转变为可溶性盐,故 Al2O3与碳酸钠反应生成的可溶性盐的
(4)化合物 NaFeO2中 Fe 的化合价为
A.+2 B.+3 C.+6
该价态对应的简单离子与该元素常见的另一种简单离子相比 ,更稳定的是
A.Fe3+ B .Fe2+
(5)通过途径 1 从 Na2CrO4溶液获得 K2Cr2O7晶体,操作步骤有:酸化→加 KCl 固体→操作 a→过滤→洗涤 →干燥
①操作 a 的名称
A.蒸发结晶 B.蒸发浓缩,冷却结晶 C.蒸馏 D. 萃取
②“酸化”调节溶液 pH<5 其主要目的是
A.增大H+浓度,加快反应速率
B.使2CrO
 +2H+
+2H+ Cr2O
Cr2O +H2O的平衡向正向移动,尽量将CrO
+H2O的平衡向正向移动,尽量将CrO 转化为Cr2O
转化为Cr2O
(6)将最后制得的晶体溶解、酸化就制成了化学实验中常用的氧化剂——酸性重铬酸钾。酸化过程中常用的酸是
您最近一年使用:0次
2 . 在一定条件下aA+bB cC+dD达到平衡时,请填写:
cC+dD达到平衡时,请填写:
(1)若A、B、C、D都是气体,在加压后平衡向正反应方向移动,则a、b、c、d关系是_______ 。
(2)已知B、C、D是气体,现增加A的物质的量,平衡不移动,说明A是_______ (填状态)。
(3)若保持容器容积不变,加入气体B,气体A的转化率_______ (填“增大”“减小”或“不变”)。
(4)若加热后,C的百分含量增大,则正反应是_______ 反应(填“放热”或“吸热”)。
(5)若保持容器压强不变,且A、B、C、D都是气体,向容器中充入稀有气体,则化学平衡逆向移动,则a、b、c、d关系是_______ 。
 cC+dD达到平衡时,请填写:
cC+dD达到平衡时,请填写:(1)若A、B、C、D都是气体,在加压后平衡向正反应方向移动,则a、b、c、d关系是
(2)已知B、C、D是气体,现增加A的物质的量,平衡不移动,说明A是
(3)若保持容器容积不变,加入气体B,气体A的转化率
(4)若加热后,C的百分含量增大,则正反应是
(5)若保持容器压强不变,且A、B、C、D都是气体,向容器中充入稀有气体,则化学平衡逆向移动,则a、b、c、d关系是
您最近一年使用:0次
名校
3 . 下列说法正确的是
A.恒温恒压容器中,反应A(s)+2B(g) 2C(g)达平衡后,再通入气体C,平衡不移动,气体B的浓度保持不变 2C(g)达平衡后,再通入气体C,平衡不移动,气体B的浓度保持不变 |
| B.1molN2和3molH2反应达到平衡时H2转化率为10%,放出的热量为Q1;在相同温度和压强下,当2molNH3分解为N2和H2的转化率为10%时,吸收的热量为Q2,Q2≠Q1 |
C.恒温下,向密闭容器中加入NH2COONH4固体,反应NH2COONH4(s) 2NH3(g)+CO2(g)达平衡后,缩小容器的容积,再达平衡时,CO2的浓度不变 2NH3(g)+CO2(g)达平衡后,缩小容器的容积,再达平衡时,CO2的浓度不变 |
D.恒温恒容容器中,N2(g)+3H2(g) 2NH3(g)达平衡后,改变条件使平衡正向移动,再达平衡时NH3的体积分数一定增大 2NH3(g)达平衡后,改变条件使平衡正向移动,再达平衡时NH3的体积分数一定增大 |
您最近一年使用:0次
名校
4 . 下列措施或事实不能用勒夏特列原理解释的是
| A.实验室常用排饱和食盐水的方法收集Cl2 |
| B.将一氧化碳中毒者放入高压氧舱,增大氧气浓度缓解病情 |
| C.啤酒瓶开启后,马上泛起大量泡沫 |
| D.工业合成氨在高温条件下进行 |
您最近一年使用:0次
2023-02-23更新
|
200次组卷
|
3卷引用:四川省雅安市2022-2023学年高二上学期期末考试化学试题
四川省雅安市2022-2023学年高二上学期期末考试化学试题广西博白县中学2022-2023学年高二下学期3月月考化学试题(已下线)第05讲 影响化学平衡的因素-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)
名校
5 . 可逆反应SO2(g)+O2(g) SO3(g)达到平衡状态后,保持温度、容器容积不变,向容器中充入一定量的O2,下列说法正确的是(K为平衡常数,Q为浓度商)
SO3(g)达到平衡状态后,保持温度、容器容积不变,向容器中充入一定量的O2,下列说法正确的是(K为平衡常数,Q为浓度商)
 SO3(g)达到平衡状态后,保持温度、容器容积不变,向容器中充入一定量的O2,下列说法正确的是(K为平衡常数,Q为浓度商)
SO3(g)达到平衡状态后,保持温度、容器容积不变,向容器中充入一定量的O2,下列说法正确的是(K为平衡常数,Q为浓度商)| A.Q不变,K变大,O2的转化率增大 |
| B.Q减小,K不变,SO2的转化率增大 |
| C.平衡常数越大表示该反应速率越快 |
| D.化学计量数变为四倍,则ΔH值和K值也变为原来的四倍 |
您最近一年使用:0次
2023-02-02更新
|
278次组卷
|
3卷引用:四川省成都石室中学2022—2023学年高二上学期期中考试化学试题
名校
6 . 下列叙述与图对应的是
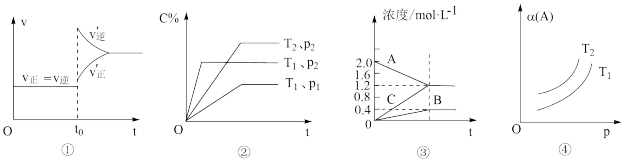

A.已达平衡状态的反应:N2(g)+3H2(g)  2NH3(g),图①表示在t0时刻充入了一定量的NH3,平衡逆向移动 2NH3(g),图①表示在t0时刻充入了一定量的NH3,平衡逆向移动 |
B.由图②可知,P2>P1、T1>T2满足反应:2A(g)+B(g)  2C(g) ΔH<0 2C(g) ΔH<0 |
| C.图③表示的反应方程式为:2A(g)=B(g)+3C(g) |
D.由图④可知,对于反应aA(g) bB(g)+cC(g),该反应用于工业生产时,采用的压强越大越好 bB(g)+cC(g),该反应用于工业生产时,采用的压强越大越好 |
您最近一年使用:0次
2023-02-02更新
|
403次组卷
|
2卷引用:四川省成都石室中学2022—2023学年高二上学期期中考试化学试题
名校
7 . 下列事实不能用勒夏特列原理来解释的是
| A.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 |
| B.唾液可以使淀粉水解速率加快 |
| C.开启啤酒瓶后,瓶中马上泛起大量泡沫 |
| D.向新制氯水中加入适量硝酸银固体,溶液颜色变浅 |
您最近一年使用:0次
2023-02-02更新
|
180次组卷
|
2卷引用:四川省成都石室中学2022—2023学年高二上学期期中考试化学试题
8 . 下列实验操作与实验目的均正确的是
| 选项 | 实验操作 | 实验目的 |
| A | 将5mL0.1mol•L-1Na2S2O3溶液和5mL0.1mol•L-1H2SO4溶液混合后,均分至两支试管,一支放入冷水中,另一支放入热水中,观察现象 | 探究温度对反应速率的影响 |
| B | 向两支分别盛有等浓度的醋酸和硼酸溶液的试管中滴加等浓度的NaHCO3溶液,观察是否产生气泡 | 探究醋酸、碳酸、硼酸的酸性强弱 |
| C | 向盛有5mL0.1mol•L-1AgNO3溶液的试管中先滴加10滴0.1mol•L-1NaCl溶液,再滴加10滴0.1mol•L-1KI溶液,观察是否产生黄色沉淀 | 证明溶解度:AgCl>AgI |
| D | 向盛有FeCl3和KSCN混合溶液的试管中加入KCl固体,观察现象 | 探究浓度对化学平衡的影响 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
9 . 下列有关实验的操作、现象和结论都正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向浓度均为0.10mol/L的KCl和KI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| B | 向FeCl3+3KSCN Fe(SCN)3+3KCl的溶液平衡体系中加入少量KCl固体 Fe(SCN)3+3KCl的溶液平衡体系中加入少量KCl固体 | 溶液血红色变浅 | 增大生成物浓度,平衡逆向移动 |
| C | 分别向4mL 0.1mol/L、4mL 0.2mol/L的KMnO4酸性溶液中加入2mL 0.1mol/L H2C2O4溶液,记录溶液褪色所需时间 | 0.2mol/L的KMnO4酸性溶液褪色更快 | 反应物的浓度越大,反应速率越快 |
| D | 测定等物质的量浓度的Na2CO3和NaClO的pH | Na2CO3>NaClO | 酸性:H2CO3<HClO |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-12-11更新
|
341次组卷
|
2卷引用:四川省凉山州西昌市第二中学2021-2022学年高二上学期期末检测化学试题
名校
解题方法
10 . 下列事实不能用勒夏特列原理解释的是
| A.用排饱和食盐水法收集Cl2 |
| B.饱和FeCl3溶液滴入沸水中可制得氢氧化铁胶体 |
| C.500 ℃比室温更有利于合成氨的反应 |
D.工业制取金属钾Na(l)+KCl(l)  NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来 NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来 |
您最近一年使用:0次
2022-12-11更新
|
357次组卷
|
2卷引用:四川省凉山州西昌市第二中学2021-2022学年高二上学期期末检测化学试题



