1 . CH3COOH+CH3CH2OH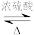 CH3COOC2H5+H2O △H<0是实验室合成乙酸乙酯的原理,下列有关合成乙酸乙酯的说法,错误的是
CH3COOC2H5+H2O △H<0是实验室合成乙酸乙酯的原理,下列有关合成乙酸乙酯的说法,错误的是
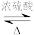 CH3COOC2H5+H2O △H<0是实验室合成乙酸乙酯的原理,下列有关合成乙酸乙酯的说法,错误的是
CH3COOC2H5+H2O △H<0是实验室合成乙酸乙酯的原理,下列有关合成乙酸乙酯的说法,错误的是| A.让乙醇过量,能提高乙酸的转化率 |
| B.合理调节乙醇、乙酸、浓硫酸的比例,能有效节约成本 |
| C.反应过程中适当提高加热温度,既能提高反应速率,又能提高酯的平衡产率 |
| D.加入的浓硫酸能吸收反应过程中产生的水,使平衡正向移动 |
您最近一年使用:0次
2023-11-03更新
|
154次组卷
|
3卷引用:3.4.1羧酸(提高)
23-24高二上·全国·课时练习
2 . 二氧化碳加氢制甲烷过程中的主要反应为
CO2(g)+4H2(g)=CH4(g)+2H2O(g) △H=-164.7kJ•mol-1
CO2(g)+H2(g)=CO(g)+H2O(g) △H=41.2kJ•mol-1
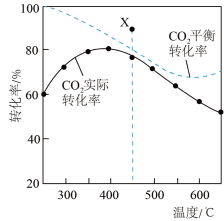
在密闭容器中,1.01×105Pa、n起始(CO2):n起始(H2)=1:4时,CO2平衡转化率、在催化剂作用下反应相同时间所测得的CO2实际转化率随温度的变化如题图所示。CH4的选择性可表示为 ×100%。下列说法正确的是
×100%。下列说法正确的是
CO2(g)+4H2(g)=CH4(g)+2H2O(g) △H=-164.7kJ•mol-1
CO2(g)+H2(g)=CO(g)+H2O(g) △H=41.2kJ•mol-1
在密闭容器中,1.01×105Pa、n起始(CO2):n起始(H2)=1:4时,CO2平衡转化率、在催化剂作用下反应相同时间所测得的CO2实际转化率随温度的变化如题图所示。CH4的选择性可表示为
 ×100%。下列说法正确的是
×100%。下列说法正确的是
| A.反应2CO(g)+2H2(g)=CO2(g)+CH4(g)的焓变△H=-205.9kJ•mol-1 |
| B.CH4的平衡选择性随着温度的升高而增加 |
| C.用该催化剂催化二氧化碳反应的最佳温度范围约为480~530℃ |
D.450℃时,提高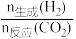 的值或增大压强,均能使CO2平衡转化率达到X点的值 的值或增大压强,均能使CO2平衡转化率达到X点的值 |
您最近一年使用:0次
解题方法
3 . 对于反应N2(g)+3H2(g) 2NH3(g) ΔH<0,如何根据下列图像比较T1、T2的大小?
2NH3(g) ΔH<0,如何根据下列图像比较T1、T2的大小?_____
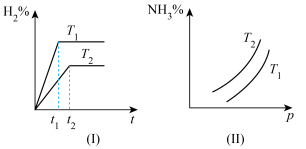
 2NH3(g) ΔH<0,如何根据下列图像比较T1、T2的大小?
2NH3(g) ΔH<0,如何根据下列图像比较T1、T2的大小?
您最近一年使用:0次
4 . 在一定条件下,可逆反应A+B mC变化如下图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后增大容器内压强的变化情况,问:
mC变化如下图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后增大容器内压强的变化情况,问:
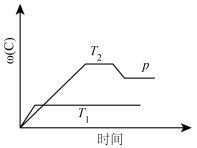
(1)温度T1_____ T2(填“大于”“等于”或“小于”),正反应是_____ (填“吸热”或“放热”)反应。
(2)如果A、B、C均为气体,则m_____ 2(填“大于”“等于”或“小于”)。
(3)当温度和容积不变时,如向平衡体系中加入一定量的某稀有气体,则体系的压强_____ ,平衡_____ 移动。
(4)当温度和压强不变时,如向平衡体系中加入一定量的某稀有气体,平衡_____ 移动。
 mC变化如下图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后增大容器内压强的变化情况,问:
mC变化如下图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后增大容器内压强的变化情况,问:
(1)温度T1
(2)如果A、B、C均为气体,则m
(3)当温度和容积不变时,如向平衡体系中加入一定量的某稀有气体,则体系的压强
(4)当温度和压强不变时,如向平衡体系中加入一定量的某稀有气体,平衡
您最近一年使用:0次
解题方法
5 . 下表的实验数据是在不同温度和压强下,平衡混合物中NH3含量的变化情况。
达到平衡时平衡混合物中NH3的含量(体积分数)[投料V(N2)∶V(H2)=1∶3]。
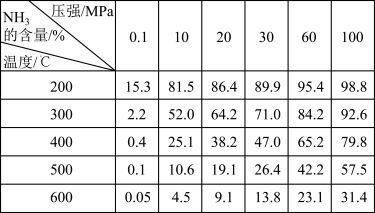
(1)比较200 ℃和300 ℃时的数据,可判断升高温度,平衡向___________ (填“正反应”或“逆反应”)方向移动,正反应方向为___________ (填“吸热”或“放热”)反应。
(2)根据平衡移动原理,合成氨适宜的条件是___________(填字母)。
(3)计算500 ℃,30 MPa时N2的转化率为___________ 。
(4)实际工业生产氨时,考虑浓度对化学平衡的影响,及500 ℃对反应速率的影响,还采取了一些措施。请分别写出其中的一个措施:___________ 。
达到平衡时平衡混合物中NH3的含量(体积分数)[投料V(N2)∶V(H2)=1∶3]。

(1)比较200 ℃和300 ℃时的数据,可判断升高温度,平衡向
(2)根据平衡移动原理,合成氨适宜的条件是___________(填字母)。
| A.高温、高压 | B.高温、低压 | C.低温、高压 | D.低温、低压 |
(4)实际工业生产氨时,考虑浓度对化学平衡的影响,及500 ℃对反应速率的影响,还采取了一些措施。请分别写出其中的一个措施:
您最近一年使用:0次
6 . 甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇。发生的主要反应如下:
①CO(g)+2H2(g) CH3OH(g) ΔH1=-99 kJ·mol-1
CH3OH(g) ΔH1=-99 kJ·mol-1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
③CO2(g)+H2(g) CO(g)+H2O(g) ΔH3=+41 kJ·mol-1
CO(g)+H2O(g) ΔH3=+41 kJ·mol-1
回答下列问题:
(1)反应①的化学平衡常数K的表达式为___________ ;图1中能正确反映平衡常数K随温度变化关系的曲线为___________ (填曲线标记字母),其判断理由是___________ 。

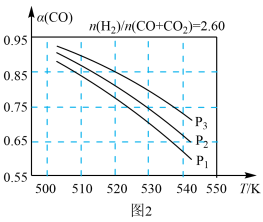
(2)合成气组成 =2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而
=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而___________ (填“增大”或“减小”),其原因是___________ ;图2中的压强由大到小为___________ ,其判断理由是___________ 。
①CO(g)+2H2(g)
 CH3OH(g) ΔH1=-99 kJ·mol-1
CH3OH(g) ΔH1=-99 kJ·mol-1②CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1③CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH3=+41 kJ·mol-1
CO(g)+H2O(g) ΔH3=+41 kJ·mol-1回答下列问题:
(1)反应①的化学平衡常数K的表达式为

(2)合成气组成
 =2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而
=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而
您最近一年使用:0次
名校
7 . 反应N2O4(g)=2NO2(g) ΔH=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是

| A.A、C两点的反应速率:A>C |
| B.A、B两点气体的颜色:A深,B浅 |
| C.T1>T2 |
| D.A、C两点气体的平均相对分子质量:A>C |
您最近一年使用:0次
2024-02-08更新
|
124次组卷
|
21卷引用:2.2.3 化学反应速率与平衡图像专题 -2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)
(已下线)2.2.3 化学反应速率与平衡图像专题 -2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)广西河池市2021-2022学年高二下学期期末考试化学试题(已下线)2.2.2 浓度商、温度对化学平衡的影响-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)湖北省问津联合体2022-2023学年高二上学期10月质量检测化学试题广东省广州市第二中学2022-2023学年高二上学期期中考试化学试题湖北省沙市中学2022-2023学年高二上学期第二次月考化学试题浙江省金华市横店高中2022-2023学年高二上学期10月份检测化学试题吉林省长春市农安县教师进修学校2022-2023学年高二上学期期末考试化学试题重庆市2022-2023学年高二下学期6月月考化学试题浙江省台州市台州八校联盟2022-2023学年高二上学期11月期中联考化学试题江西省永修县第一中学2023-2024学年高二上学期开学考试化学试题河北省石家庄市第四十二中学2023-2024学年高二上学期第一次月考化学试题宁夏银川市贺兰县第一中学2023-2024学年高二上学期第一阶段考试化学试题安徽省马鞍山市第二中学2022-2023学年高二上学期11月期中考试化学试题河南省焦作市博爱县第一中学2023-2024学年高三上学期10月月考化学试题四川省成都市第八中学校2022-2023学年高二上学期11月期中考试化学试题陕西省西安中学2023-2024学年高二上学期11月期中考试化学试题四川省内江市威远中学2023-2024学年高二上学期第一次月考化学试题山东省济宁市嘉祥县第一中学2023-2024学年高二上学期10月月考化学试题湖北省武汉市育才高级中学等2校2023-2024学年高二上学期化学模拟试卷福建省莆田五中2023-2024学年高二上学期第三次月考化学试卷
8 . 反应mA+nB pC在某温度下达到平衡状态。
pC在某温度下达到平衡状态。
(1)若升高温度,A物质的转化率增大,该反应为___________ 热反应。
(2)若C为气体,且m+n=p,在加压时化学平衡发生移动,则平衡必定向___________ (填“正反应”或“逆反应”)方向移动。
(3)如果在体系中增加或减少B的量,平衡均不发生移动,则B肯定不能为___________ 态。
 pC在某温度下达到平衡状态。
pC在某温度下达到平衡状态。(1)若升高温度,A物质的转化率增大,该反应为
(2)若C为气体,且m+n=p,在加压时化学平衡发生移动,则平衡必定向
(3)如果在体系中增加或减少B的量,平衡均不发生移动,则B肯定不能为
您最近一年使用:0次
解题方法
9 . 完成下列问题
(1)已知反应CO(g)+2H2(g) CH3OH(g),在恒容密闭容器中按
CH3OH(g),在恒容密闭容器中按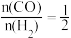 加入CO和H2合成甲醇,测得起始压强p0=102 kPa。CO的平衡转化率[α(CO)]随温度的变化曲线如图所示,R点时反应的平衡常数Kp=
加入CO和H2合成甲醇,测得起始压强p0=102 kPa。CO的平衡转化率[α(CO)]随温度的变化曲线如图所示,R点时反应的平衡常数Kp=___________ (kPa)-2(用平衡分压代替平衡浓度计算,p分=p总×物质的量分数),R、S两点平衡常数大小:Kp(R)___________ (填“>”“=”或“<”)Kp(S)。

(2)CO可用于合成甲醇,反应的化学方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应的ΔH
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应的ΔH___________ 0(填“>”或“<”)。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是___________ 。

(1)已知反应CO(g)+2H2(g)
 CH3OH(g),在恒容密闭容器中按
CH3OH(g),在恒容密闭容器中按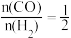 加入CO和H2合成甲醇,测得起始压强p0=102 kPa。CO的平衡转化率[α(CO)]随温度的变化曲线如图所示,R点时反应的平衡常数Kp=
加入CO和H2合成甲醇,测得起始压强p0=102 kPa。CO的平衡转化率[α(CO)]随温度的变化曲线如图所示,R点时反应的平衡常数Kp=
(2)CO可用于合成甲醇,反应的化学方程式为CO(g)+2H2(g)
 CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应的ΔH
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应的ΔH
您最近一年使用:0次
10 . 合成氨工业的原料气中含有少量CO,CO会使催化剂失去催化能力(催化剂中毒),因此,在进入合成塔前必须将其除去。一般用醋酸二氨合铜溶液来吸收原料气中的CO,其反应为Cu(NH3)2Ac(aq)+CO(g)+NH3(g) [Cu(NH3)3CO]Ac(aq)(正反应为放热反应)。
[Cu(NH3)3CO]Ac(aq)(正反应为放热反应)。
(1)醋酸二氨合铜吸收CO的生产适宜条件是___________ 。
(2)吸收CO后的醋酸铜氨溶液经过处理后可再生,恢复其吸收CO的能力以供循环使用,醋酸铜氨液再生的生产适宜条件是___________ 。
 [Cu(NH3)3CO]Ac(aq)(正反应为放热反应)。
[Cu(NH3)3CO]Ac(aq)(正反应为放热反应)。(1)醋酸二氨合铜吸收CO的生产适宜条件是
(2)吸收CO后的醋酸铜氨溶液经过处理后可再生,恢复其吸收CO的能力以供循环使用,醋酸铜氨液再生的生产适宜条件是
您最近一年使用:0次



