名校
1 . 下列事实不能用平衡移动原理解释的是
| A.实验室使用排饱和食盐水的方法收集氯气 |
| B.高压比常压条件更有利于合成氨的反应 |
| C.注射器中的NO2气体,加压后颜色先变深后变浅,但比原来要深 |
| D.700K左右比室温更有利于合成氨的反应 |
您最近一年使用:0次
2022-03-09更新
|
164次组卷
|
2卷引用:江苏省灌云高级中学2021-2022学年高二上学期12月阶段考试化学试题
名校
解题方法
2 . 现有一定条件下某反应mA(g) +nB(g)  pC(g) ,其不同温度下的化学平衡常数(K)如下表所示(K1<K2<K3),图象表示反应达平衡后,t2时刻增大压强时速率(v)随时间(t)的变化情况。
pC(g) ,其不同温度下的化学平衡常数(K)如下表所示(K1<K2<K3),图象表示反应达平衡后,t2时刻增大压强时速率(v)随时间(t)的变化情况。

回答下列问题:
(1)该反应是___________ 热反应,且m+n___________ (填“>” “<”或“=”)p。
(2)降温时,混合体系中C的质量分数___________ (填“增大”“减小”或“不变”,下同)。
(3)若增加A的用量(A、B的总体积不变),则B的转化率___________ 。
(4)若升高温度,则平衡时,B、C的浓度之比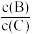 将
将___________ 。
 pC(g) ,其不同温度下的化学平衡常数(K)如下表所示(K1<K2<K3),图象表示反应达平衡后,t2时刻增大压强时速率(v)随时间(t)的变化情况。
pC(g) ,其不同温度下的化学平衡常数(K)如下表所示(K1<K2<K3),图象表示反应达平衡后,t2时刻增大压强时速率(v)随时间(t)的变化情况。| 温度/℃ | 250 | 300 | 350 |
| K | K1 | K2 | K3 |

回答下列问题:
(1)该反应是
(2)降温时,混合体系中C的质量分数
(3)若增加A的用量(A、B的总体积不变),则B的转化率
(4)若升高温度,则平衡时,B、C的浓度之比
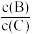 将
将
您最近一年使用:0次
2021-11-18更新
|
543次组卷
|
3卷引用:河南省商开大联考2021-2022学年高二上学期期中考试化学试题
2021高三·全国·专题练习
3 . 生产过程中,在600℃时向乙苯中掺入高温水蒸气,保持体系总压为105.6kPa催化反应。若投料比n(乙苯)/n(H2O)=1:8,达平衡时乙苯的转化率为60%,若其他条件不变,将上述起始反应物置于某恒容密闭容器中,则乙苯的平衡转化率___________ (填“>”“<”或“=”)60%。
您最近一年使用:0次
名校
解题方法
4 . 下列事实中,不能用勒夏特列原理解释的是
| A.工业制取金属钾Na(1)+KCl(1)⇌NaCl(l)+K(g),选取适宜的温度使K变成蒸气从反应混合物中分离出来,有利于反应向右进行 |
| B.反应CO(g)+NO2(g)⇌CO2(g)+NO(g) △H<0,达到平衡后,增大压强可使平衡体系颜色变深 |
| C.工业上SO2催化氧化生成SO3,常通入过量的空气来提高SO2的平衡转化率 |
| D.向含酚酞的Na2CO3溶液中滴加BaCl2溶液,红色变浅 |
您最近一年使用:0次
2021-11-14更新
|
721次组卷
|
12卷引用:山东省滨州市2020-2021学年高二上学期期末考试化学试题
山东省滨州市2020-2021学年高二上学期期末考试化学试题安徽省滁州市明光中学2020-2021学年高二下学期开学考试化学试题河北省衡水市第十四中学2020-2021学年高二下学期摸底考试化学试题山西省吕梁市柳林县2021-2022学年高二上学期期中考试化学试题河北省唐山市第一中学2021-2022学年高二上学期12月月考化学试题湖南省长沙市明德中学 2021-2022学年高二上学期12月月考化学试题黑龙江省牡丹江市第三高级中学2021-2022学年高二上学期期末考试化学试题福建省莆田华侨中学2021-2022学年高二上学期期末考试化学试题江苏省徐州市睢宁县第一中学2021-2022学年高二下学期第一次月考化学试题江苏省徐州市沛县树恩高级中学2021-2022学年高二下学期期中测试化学试题湖南省长沙市南雅中学2022-2023学年高二上学期第三次月考化学试题四川省南充市仪陇中学校2023-2024学年高二下学期4月月考化学试题
名校
5 . 对平衡2SO2(g)+O2 (g)  2 SO3 (g); △H= -198kJ/mol,为提高SO2的转化率,应采取的合理措施是
2 SO3 (g); △H= -198kJ/mol,为提高SO2的转化率,应采取的合理措施是
 2 SO3 (g); △H= -198kJ/mol,为提高SO2的转化率,应采取的合理措施是
2 SO3 (g); △H= -198kJ/mol,为提高SO2的转化率,应采取的合理措施是| A.升温、增压 | B.降温、增压 |
| C.升温、减压 | D.降温、减压 |
您最近一年使用:0次
2021-11-03更新
|
599次组卷
|
3卷引用:吉林省通化县综合高级中学2021-2022学年高二上学期期中考试化学试题
6 . 在一定条件下,反应X(g)+3Y(g) 2Z(g) ∆H=-92.4kJ/mol,X的平衡转化率(α)与体系总压强(P)的关系如图所示。下列说法正确的是
2Z(g) ∆H=-92.4kJ/mol,X的平衡转化率(α)与体系总压强(P)的关系如图所示。下列说法正确的是
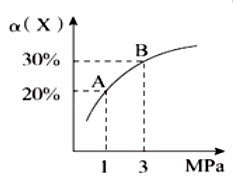
 2Z(g) ∆H=-92.4kJ/mol,X的平衡转化率(α)与体系总压强(P)的关系如图所示。下列说法正确的是
2Z(g) ∆H=-92.4kJ/mol,X的平衡转化率(α)与体系总压强(P)的关系如图所示。下列说法正确的是
| A.图中A,B两点,达到相同的平衡体系 |
| B.上述反应在达到平衡后,增大压强,Y的转化率提高 |
| C.升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小 |
| D.将1.0molX、3.0molY,置于1L密闭容器中发生反应,放出的热量为92.4kJ |
您最近一年使用:0次
2021-11-02更新
|
568次组卷
|
3卷引用:重庆市永川景圣中学校2021-2022学年高二上学期第一次月考化学试题
7 . 其他条件不变时,下列化学方程式中反应速率与压强变化无关的是
A.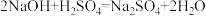 | B.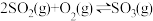 |
C.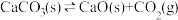 | D. |
您最近一年使用:0次
名校
8 . 对于反应2SO2(g)+O2(g) 2SO3(g),下列说法正确的是
2SO3(g),下列说法正确的是
 2SO3(g),下列说法正确的是
2SO3(g),下列说法正确的是| A.反应的ΔS>0 |
B.反应的平衡常数可表示为K= |
| C.增大体系的压强能提高SO2的反应速率和转化率 |
| D.使用催化剂能改变反应路径,提高反应的活化能 |
您最近一年使用:0次
2021-10-18更新
|
599次组卷
|
7卷引用:江苏省徐州市第三中学2021-2022学年高二上学期10月月考化学试题
江苏省徐州市第三中学2021-2022学年高二上学期10月月考化学试题湖南省衡阳市田家炳实验中学2021-2022学年高二上学期期中考试化学试题江苏省南通市通州区金沙中学2021-2022学年高二上学期第二次调研考试化学试题湖北省新高考联考协作体2021-2022学年高二3月考试化学试题黑龙江省佳木斯市实验中学2021-2022学年高二上学期期末考试化学试题(已下线)专题06 化学反应的方向及调控【考点清单】(讲+练)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)广西百色市德保高中2023-2024学年高二上学期11月期中考试化学试题
9 . 在密闭容器中发生如下反应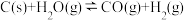
 ;达到平衡后,改变下列条件,判断平衡移动的方向(向正反应方向、向逆反应方向、不移动)
;达到平衡后,改变下列条件,判断平衡移动的方向(向正反应方向、向逆反应方向、不移动)
(1)升高温度,平衡_______ 移动;
(2)增大压强,平衡_______ 移动:
(3)增大H2(g)浓度,平衡_______ 移动:加入C,平衡_______ 移动;
(4)加入催化剂,平衡_______ 移动。
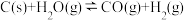
 ;达到平衡后,改变下列条件,判断平衡移动的方向(向正反应方向、向逆反应方向、不移动)
;达到平衡后,改变下列条件,判断平衡移动的方向(向正反应方向、向逆反应方向、不移动)(1)升高温度,平衡
(2)增大压强,平衡
(3)增大H2(g)浓度,平衡
(4)加入催化剂,平衡
您最近一年使用:0次
2021-05-04更新
|
862次组卷
|
4卷引用:新疆喀什巴楚县第一中学2020-2021学年高二下学期期中考试化学试题
新疆喀什巴楚县第一中学2020-2021学年高二下学期期中考试化学试题课前-2.4 化学反应的调控-课前、课中、课后(人教版2019选择性必修1)(已下线)2.2.3 浓度、压强对化学平衡的影响-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)(已下线)第10讲 影响化学平衡的因素(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)
10 . 压强变化不会使下列化学反应的平衡发生移动的是
| A.H2(g)+I2(g) ⇌ 2HI(g) (在高温条件下) |
| B.3H2(g)+N2(g) ⇌2NH3(g)(在高温高压催化剂条件下) |
| C.2SO2(g)+O2(g) ⇌2SO3(g)(在催化剂加热条件下) |
| D.C(s)+CO2(g) ⇌2CO(g)(在高温条件下) |
您最近一年使用:0次



