解题方法
1 . 烯烃催化裂解是制备短链烯烃的重要途径。研究表明,1-丁烯[CH3CH2CH=CH2(g)]催化裂解时,发生两个平行竞争反应生成丙烯和乙烯,两反应的热化学方程式为:
①3CH3CH2CH=CH2(g)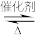 4CH3CH=CH2(g) △H=+579 kJ·mol-1
4CH3CH=CH2(g) △H=+579 kJ·mol-1
②CH3CH2CH=CH2(g)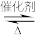 2CH2=CH2(g) △H=+283 kJ·mol-1
2CH2=CH2(g) △H=+283 kJ·mol-1
回答下列问题:
(1)若1-丁烯的燃烧热为2539 kJ·mol-1,则表示乙烯燃烧热的热化学方程式为____ ;1-丁烯转化为丙烯反应的化学平衡常数表达式为_____ 。
(2)有利于提高1-丁烯平衡转化率的措施有_______ 。
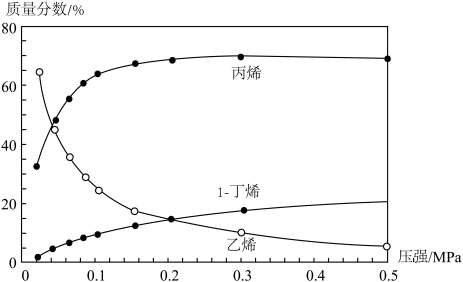
(3)550℃和0.02~0.5 MPa下,①②两个反应均建立平衡,测得平衡混合物里各组分的质量分数随压强变化的曲线如下图所示。由图可知,1-丁烯的质量分数随压强的增大而增大,主要原因是______ 。
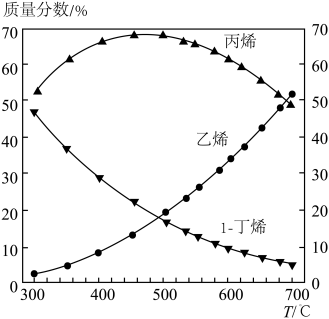
(4)在1-丁烯裂解的实际生产中,为了提高产物中丙烯的含量,除了选择合适的温度和压强之外,还有一条关键措施是_____ 。0.1 MPa和300~700℃下,1-丁烯裂解产物中各组分比例变化的曲线如下图所示。由图可知,生产过程中提高丙烯质量分数的最佳温度为___ ℃,在该温度之前各温度对应的组成______ (填“一定是”、“可能是”或“一定不是”)平衡态,理由是____________ 。
①3CH3CH2CH=CH2(g)
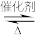 4CH3CH=CH2(g) △H=+579 kJ·mol-1
4CH3CH=CH2(g) △H=+579 kJ·mol-1②CH3CH2CH=CH2(g)
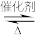 2CH2=CH2(g) △H=+283 kJ·mol-1
2CH2=CH2(g) △H=+283 kJ·mol-1回答下列问题:
(1)若1-丁烯的燃烧热为2539 kJ·mol-1,则表示乙烯燃烧热的热化学方程式为
(2)有利于提高1-丁烯平衡转化率的措施有
(3)550℃和0.02~0.5 MPa下,①②两个反应均建立平衡,测得平衡混合物里各组分的质量分数随压强变化的曲线如下图所示。由图可知,1-丁烯的质量分数随压强的增大而增大,主要原因是

(4)在1-丁烯裂解的实际生产中,为了提高产物中丙烯的含量,除了选择合适的温度和压强之外,还有一条关键措施是

您最近一年使用:0次
2 . CO2是目前大气中含量最高的一种温室气体,中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40-50% CO2的综合利用是解决温室问题的有效途径。
(1)研究表明CO2和H2在催化剂存在下可发生反应生成CH3OH已知部分反应的热化学方程式如下:
CH3OH(g)+ O2(g)=CO2(g)+2H2O(g) ΔH1 =a kJ·mol-1
O2(g)=CO2(g)+2H2O(g) ΔH1 =a kJ·mol-1
H2(g)+ O2(g)=H2O(g) ΔH2 =b kJ·mol-1
O2(g)=H2O(g) ΔH2 =b kJ·mol-1
H2O(g) = H2O(l) ΔH3=c kJ·mol-1
则CO2(g)+3H2(g)⇌H2O(g)+CH3OH(g) ΔH=_______
(2)为研究CO2与CO之间的转化,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)⇌2CO(g) ΔH, 反应达平衡后,测得压强、温度对CO的体积分数的影响如图1所示。

回答下列问题:
①压强P1、P2、P3的大小关系是_______ ;Ka、K b、Kc为a、b、c三点对应的平衡常数,则其大小关系是_______ 。
②900℃、1.0MPa时,足量碳与amol CO2反应达平衡后,CO2的转化率为_______ (保留三位有效数字 ),该反应的平衡常数Kp=
),该反应的平衡常数Kp=_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸,CO2(g)+CH4(g)⇌CH3COOH(g)。在不同温度下催化剂的催化效率与乙酸的生成速率如图2所示。250~300℃时,乙酸的生成速率降低的主要原因是_______ 。
(3)以铅蓄电池为电源可将CO2转化为乙烯,其原理如图3所示,电解所用电极材料均为惰性电极。阴极上的电极反应式为_______ ;每生成0.5mol乙烯,理论上需消耗铅蓄电池中_______ mol硫酸。
(1)研究表明CO2和H2在催化剂存在下可发生反应生成CH3OH已知部分反应的热化学方程式如下:
CH3OH(g)+
 O2(g)=CO2(g)+2H2O(g) ΔH1 =a kJ·mol-1
O2(g)=CO2(g)+2H2O(g) ΔH1 =a kJ·mol-1H2(g)+
 O2(g)=H2O(g) ΔH2 =b kJ·mol-1
O2(g)=H2O(g) ΔH2 =b kJ·mol-1H2O(g) = H2O(l) ΔH3=c kJ·mol-1
则CO2(g)+3H2(g)⇌H2O(g)+CH3OH(g) ΔH=
(2)为研究CO2与CO之间的转化,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)⇌2CO(g) ΔH, 反应达平衡后,测得压强、温度对CO的体积分数的影响如图1所示。

回答下列问题:
①压强P1、P2、P3的大小关系是
②900℃、1.0MPa时,足量碳与amol CO2反应达平衡后,CO2的转化率为
 ),该反应的平衡常数Kp=
),该反应的平衡常数Kp=③以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸,CO2(g)+CH4(g)⇌CH3COOH(g)。在不同温度下催化剂的催化效率与乙酸的生成速率如图2所示。250~300℃时,乙酸的生成速率降低的主要原因是
(3)以铅蓄电池为电源可将CO2转化为乙烯,其原理如图3所示,电解所用电极材料均为惰性电极。阴极上的电极反应式为
您最近一年使用:0次
2021-04-09更新
|
225次组卷
|
4卷引用:陕西省西安中学2020届高三仿真考试(一)化学试题
3 . 可逆反应aA(s) + bB(g) cC(g) + dD(g) ; △H="=Q" KJ/mol.当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(p)的关系如图所示,以下判断正确的是
cC(g) + dD(g) ; △H="=Q" KJ/mol.当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(p)的关系如图所示,以下判断正确的是
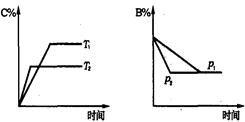
 cC(g) + dD(g) ; △H="=Q" KJ/mol.当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(p)的关系如图所示,以下判断正确的是
cC(g) + dD(g) ; △H="=Q" KJ/mol.当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(p)的关系如图所示,以下判断正确的是
| A.T1<T2,Q>0 |
| B.Pl<P2,b==c+d |
| C.Tl>T2,Q<0 |
| D.P1<P2,a+b==c+d |
您最近一年使用:0次



