解题方法
1 . 综合利用CH4和CO2对构建低碳社会、促进工业可持续发展有重要意义。
(1)CH4与Cl2光照下反应有多种产物。其中有机产物(图1)的电子式是_______ 。有人认为CH4是四棱锥型,碳原子位于四棱锥的顶点(图2),判断CH4不是四棱锥型分子的依据是_______ 。(选填编号)
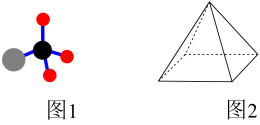
a.CH4是非极性分子
b.一氯甲烷只有一种结构
c.二氯甲烷只有一种沸点
d.CH4中碳的质量分数75%
实验室对(CH4-CO2)催化重整,反应原理为:CH4(g)+CO2(g) 2CO(g)+2H2(g)。在1L固定容积的密闭容器中,充入0.1mol CO2、0.1mol CH4,分别在p1、p2、p3三种压强和不同温度下进行(CH4-CO2)催化重整,测得平衡时甲烷的转化率、温度和压强的关系如图。
2CO(g)+2H2(g)。在1L固定容积的密闭容器中,充入0.1mol CO2、0.1mol CH4,分别在p1、p2、p3三种压强和不同温度下进行(CH4-CO2)催化重整,测得平衡时甲烷的转化率、温度和压强的关系如图。
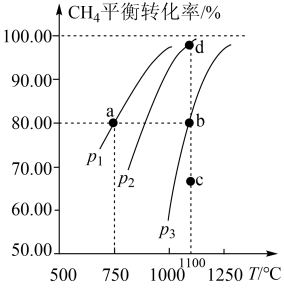
(2)750℃、p1时,反应经20min达到平衡。则平衡后CO的物质的量为_______ 。图中c点时,v正_______ v逆(选填:<、>、=)。
(3)该反应正反应为_______ 热反应(选填:吸、放);在p1、p2、p3中,压强最大的是_______ 。
(4)已知a点时的平衡常数Ka=1.64,则d点时的平衡常数Kd_______ 1.64(选填:<、>、=),理由是_______ 。
(1)CH4与Cl2光照下反应有多种产物。其中有机产物(图1)的电子式是

a.CH4是非极性分子
b.一氯甲烷只有一种结构
c.二氯甲烷只有一种沸点
d.CH4中碳的质量分数75%
实验室对(CH4-CO2)催化重整,反应原理为:CH4(g)+CO2(g)
 2CO(g)+2H2(g)。在1L固定容积的密闭容器中,充入0.1mol CO2、0.1mol CH4,分别在p1、p2、p3三种压强和不同温度下进行(CH4-CO2)催化重整,测得平衡时甲烷的转化率、温度和压强的关系如图。
2CO(g)+2H2(g)。在1L固定容积的密闭容器中,充入0.1mol CO2、0.1mol CH4,分别在p1、p2、p3三种压强和不同温度下进行(CH4-CO2)催化重整,测得平衡时甲烷的转化率、温度和压强的关系如图。
(2)750℃、p1时,反应经20min达到平衡。则平衡后CO的物质的量为
(3)该反应正反应为
(4)已知a点时的平衡常数Ka=1.64,则d点时的平衡常数Kd
您最近一年使用:0次
解题方法
2 . 环氧乙烷(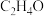 )被广泛地应用于洗涤、制药、印染等行业。工业上通常采用乙烯(
)被广泛地应用于洗涤、制药、印染等行业。工业上通常采用乙烯( )直接氧化法制取环氧乙烷,体系中发生的反应如下:
)直接氧化法制取环氧乙烷,体系中发生的反应如下:
主反应:


副反应: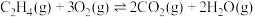

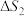
回答下列问题:
(1)已知几种化学键的键能如表所示:
试计算
___________ 。
(2)主反应与副反应的吉布斯自由能变( )与温度T的关系如图所示,则副反应的
)与温度T的关系如图所示,则副反应的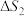
___________ (填“>”“<”或“=”)0,
___________ (填“>”“<”或“=”)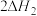 。
。

(3)在250℃、101kPa下,向某密闭容器中充入一定量的 和
和 ,同时发生上述两个反应,充分反应后,体系中含碳组分含量最高的是
,同时发生上述两个反应,充分反应后,体系中含碳组分含量最高的是 ,增大压强,
,增大压强, 的含量将
的含量将___________ (填“增大”“减小”或“不变”)。工业生产中常采用的反应条件为250℃、2.0MPa,并选择Ag作催化剂,充分反应后体系中含碳组分含量最高的是 ,则Ag所起的作用可能为
,则Ag所起的作用可能为___________ 。
(4)一定条件下,用富氧空气(只含 和
和 ,且
,且 的体积分数为55%)代替
的体积分数为55%)代替 ,将
,将 、
、 、
、 按物质的量之比为11:11:1通入某恒容密闭容器中,发生上述两个反应,平衡时测得容器内总压为2.0MPa,
按物质的量之比为11:11:1通入某恒容密闭容器中,发生上述两个反应,平衡时测得容器内总压为2.0MPa, 的体积分数为31.25%,
的体积分数为31.25%,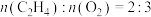 ,则
,则 和
和 的平衡转化率之比为
的平衡转化率之比为___________ ,该条件下主反应的压强平衡常数
___________  (
( 为用分压代替浓度的平衡常数,各组分分压=各组分物质的量分数×总压)。
为用分压代替浓度的平衡常数,各组分分压=各组分物质的量分数×总压)。
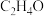 )被广泛地应用于洗涤、制药、印染等行业。工业上通常采用乙烯(
)被广泛地应用于洗涤、制药、印染等行业。工业上通常采用乙烯( )直接氧化法制取环氧乙烷,体系中发生的反应如下:
)直接氧化法制取环氧乙烷,体系中发生的反应如下:主反应:



副反应:
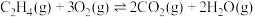

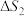
回答下列问题:
(1)已知几种化学键的键能如表所示:
| 化学键 | C-H | C=C | C-C | C-O | O=O |
键能 | 423 | 682 | 368 | 335 | 498 |

(2)主反应与副反应的吉布斯自由能变(
 )与温度T的关系如图所示,则副反应的
)与温度T的关系如图所示,则副反应的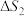

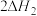 。
。
(3)在250℃、101kPa下,向某密闭容器中充入一定量的
 和
和 ,同时发生上述两个反应,充分反应后,体系中含碳组分含量最高的是
,同时发生上述两个反应,充分反应后,体系中含碳组分含量最高的是 ,增大压强,
,增大压强, 的含量将
的含量将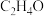 ,则Ag所起的作用可能为
,则Ag所起的作用可能为(4)一定条件下,用富氧空气(只含
 和
和 ,且
,且 的体积分数为55%)代替
的体积分数为55%)代替 ,将
,将 、
、 、
、 按物质的量之比为11:11:1通入某恒容密闭容器中,发生上述两个反应,平衡时测得容器内总压为2.0MPa,
按物质的量之比为11:11:1通入某恒容密闭容器中,发生上述两个反应,平衡时测得容器内总压为2.0MPa, 的体积分数为31.25%,
的体积分数为31.25%,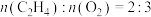 ,则
,则 和
和 的平衡转化率之比为
的平衡转化率之比为
 (
( 为用分压代替浓度的平衡常数,各组分分压=各组分物质的量分数×总压)。
为用分压代替浓度的平衡常数,各组分分压=各组分物质的量分数×总压)。
您最近一年使用:0次
名校
解题方法
3 . 我国已探明或开发的天然气中含有一定含量的 ,而且随着原油中硫含量的上升,炼油厂中干气及液化气等含硫气体的排放量逐年增加。与此同时,我国汽油、柴油标准不断升级、环保排放要求不断升高,新增的加氢装置也越来越多,气体中
,而且随着原油中硫含量的上升,炼油厂中干气及液化气等含硫气体的排放量逐年增加。与此同时,我国汽油、柴油标准不断升级、环保排放要求不断升高,新增的加氢装置也越来越多,气体中 含量也不断增加。
含量也不断增加。 会引起设备腐蚀,还会威胁生命安全。因此,炼油厂中的干气、液化气、加氨后气体以及气田中的天然气都必须首先进行脱硫净化处理。
会引起设备腐蚀,还会威胁生命安全。因此,炼油厂中的干气、液化气、加氨后气体以及气田中的天然气都必须首先进行脱硫净化处理。
I.胺液脱硫
胺液脱硫系统已成为石油、天然气加工的重要组成部分。含氨基的有机化合物称为胺,现用 表示(R代烃基)。
表示(R代烃基)。
(1)用化学方程式解释胺的水溶液呈碱性原因:_____ 。
(2)用胺液吸收足量 的离子方程式是
的离子方程式是_____ 。
(3)某胺(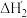 )的
)的 ,
, 的两级电离平衡常数分别为
的两级电离平衡常数分别为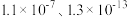 ,则(
,则(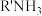 )HS的水溶液呈
)HS的水溶液呈_____ (填标号)。
A.碱性 B.中性 C.酸性
Ⅱ.热分解法脱硫
在密闭容器中模拟工业热分解法脱硫,发生反应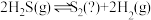 。其他条件不变时,
。其他条件不变时, 的平衡转化率随温度和压强的变化如图。
的平衡转化率随温度和压强的变化如图。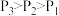 ,反应中
,反应中
_____ (填“是”或“不是")气态,理由是_____ 。
(5)实际反应在高温下进行的原因可能是_____ (答出2条即可)。
 ,而且随着原油中硫含量的上升,炼油厂中干气及液化气等含硫气体的排放量逐年增加。与此同时,我国汽油、柴油标准不断升级、环保排放要求不断升高,新增的加氢装置也越来越多,气体中
,而且随着原油中硫含量的上升,炼油厂中干气及液化气等含硫气体的排放量逐年增加。与此同时,我国汽油、柴油标准不断升级、环保排放要求不断升高,新增的加氢装置也越来越多,气体中 含量也不断增加。
含量也不断增加。 会引起设备腐蚀,还会威胁生命安全。因此,炼油厂中的干气、液化气、加氨后气体以及气田中的天然气都必须首先进行脱硫净化处理。
会引起设备腐蚀,还会威胁生命安全。因此,炼油厂中的干气、液化气、加氨后气体以及气田中的天然气都必须首先进行脱硫净化处理。I.胺液脱硫
胺液脱硫系统已成为石油、天然气加工的重要组成部分。含氨基的有机化合物称为胺,现用
 表示(R代烃基)。
表示(R代烃基)。(1)用化学方程式解释胺的水溶液呈碱性原因:
(2)用胺液吸收足量
 的离子方程式是
的离子方程式是(3)某胺(
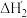 )的
)的 ,
, 的两级电离平衡常数分别为
的两级电离平衡常数分别为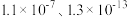 ,则(
,则(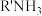 )HS的水溶液呈
)HS的水溶液呈A.碱性 B.中性 C.酸性
Ⅱ.热分解法脱硫
在密闭容器中模拟工业热分解法脱硫,发生反应
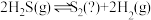 。其他条件不变时,
。其他条件不变时, 的平衡转化率随温度和压强的变化如图。
的平衡转化率随温度和压强的变化如图。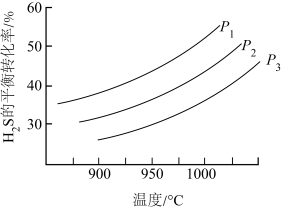
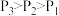 ,反应中
,反应中
(5)实际反应在高温下进行的原因可能是
您最近一年使用:0次
名校
4 . 碳热还原氧化锌反应可用于循环制氢。碳热还原氧化锌的主要反应如下:
反应I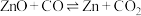 ;
;
反应Ⅱ
在不同容器中分别发生反应I、反应Ⅱ,不同压强(P1或P2)下分别达平衡时,两个反应中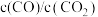 随温度变化的关系如图所示。下列说法正确的是
随温度变化的关系如图所示。下列说法正确的是
反应I
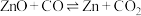 ;
;反应Ⅱ

在不同容器中分别发生反应I、反应Ⅱ,不同压强(P1或P2)下分别达平衡时,两个反应中
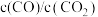 随温度变化的关系如图所示。下列说法正确的是
随温度变化的关系如图所示。下列说法正确的是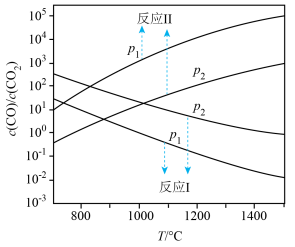
A.压强大小: |
B.在如图所示条件下,反应I可表示为  |
C.选择反应Ⅱ的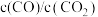 小于反应I的条件,将C与ZnO置于同一密闭容器中,碳热还原氧化锌反应能顺利进行 小于反应I的条件,将C与ZnO置于同一密闭容器中,碳热还原氧化锌反应能顺利进行 |
D.一定条件下将C与ZnO置于同一密闭容器中反应,当 时,增大 时,增大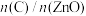 的值,可减少平衡时气体中 的值,可减少平衡时气体中 的含量 的含量 |
您最近一年使用:0次
2023-06-02更新
|
666次组卷
|
3卷引用:江苏省扬州市2023届高三下学期三模化学试题
5 . 下列有关说法正确的是
| A.为降低高炉尾气中CO的含量,可采用增加高炉高度的方法 |
| B.合成氨的生产中,压强越大,氨的产率越高,因此在选择条件时,压强越大越好 |
| C.合成氨的生产中,温度越低,氨的产率越高,因此在选择条件时,温度越低越好 |
| D.在给定的条件下,达到平衡时可逆反应完成程度最大 |
您最近一年使用:0次
22-23高一下·上海·期末
6 . 工业合成氨
(1)合成氨的适宜条件探究:N2(g)+3H2(g) 2NH3(g) + Q(Q>0)
2NH3(g) + Q(Q>0)
∴合成氨的合理生产条件:① 使用___________ 为催化剂 ②一定程度的加压 ③温度控制在催化剂的活性温度(500℃) ④及时分离___________
(1)合成氨的适宜条件探究:N2(g)+3H2(g)
 2NH3(g) + Q(Q>0)
2NH3(g) + Q(Q>0)| 反应条件 | 对化学反应速率的影响 | 对平衡混合物中NH3含量的影响 | 化学反应速率与化学平衡综合考虑 |
| 增大压强 | 影响一致,应 | ||
| 升高温度 | 影响 | ||
| 使用催化剂 | 用合适催化剂有利于加快反应速率 | ||
| 增加反应物浓度 | 平衡向 | 影响一致应 |
您最近一年使用:0次
名校
7 . 国家主席习近平提出了中国应对气候变化的两个目标:二氧化碳排放力争于2030年前达到峰值,于2060年前实现碳中和。因此,科学家研发 利用技术、降低空气中
利用技术、降低空气中 含量成为了热点。回答下列问题:
含量成为了热点。回答下列问题:
(1) 还原
还原 制
制 的部分反应如下:
的部分反应如下:
①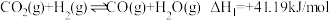
②
反应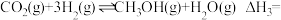
______ 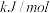
(2)在一定条件下,向 恒容密闭容器中充入
恒容密闭容器中充入 和
和 发生反应
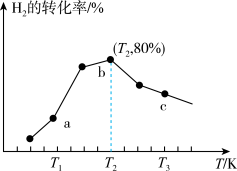
发生反应 ,测得在相同时间内,不同温度下
,测得在相同时间内,不同温度下 的转化率如图所示。a、b、c点
的转化率如图所示。a、b、c点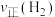 的大小顺序为
的大小顺序为_______________ ; 时,若达到平衡时所用时间为
时,若达到平衡时所用时间为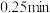 ,则
,则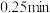 内
内 的平均反应速率为
的平均反应速率为___________  (保留三位有效数字),若平衡时压强为
(保留三位有效数字),若平衡时压强为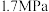 ,
,
_______ 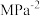 (保留三位有效数字,
(保留三位有效数字, 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。
(3)一定条件下,反应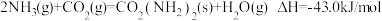 ,达到平衡.欲使反应速率增大且平衡向正反应方向移动,需要改变的条件为
,达到平衡.欲使反应速率增大且平衡向正反应方向移动,需要改变的条件为_______________ (任写一种)。
(4)温度为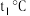 时,将等物质的量的
时,将等物质的量的 和
和 充入体积为
充入体积为 的密闭容器中发生反应:
的密闭容器中发生反应: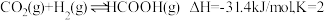 。实验测得:
。实验测得: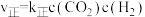 、
、 ,
, 、
、 为速率常数。
为速率常数。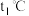 时,
时,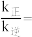
_____ ;温度为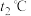 时,
时,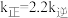 ,则
,则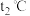
_____ (填“>”“<”或“=”)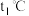 。
。
 利用技术、降低空气中
利用技术、降低空气中 含量成为了热点。回答下列问题:
含量成为了热点。回答下列问题:(1)
 还原
还原 制
制 的部分反应如下:
的部分反应如下:①
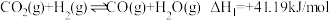
②

反应
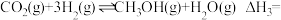
(2)在一定条件下,向
 恒容密闭容器中充入
恒容密闭容器中充入 和
和 发生反应
发生反应 ,测得在相同时间内,不同温度下
,测得在相同时间内,不同温度下 的转化率如图所示。a、b、c点
的转化率如图所示。a、b、c点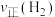 的大小顺序为
的大小顺序为 时,若达到平衡时所用时间为
时,若达到平衡时所用时间为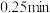 ,则
,则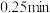 内
内 的平均反应速率为
的平均反应速率为 (保留三位有效数字),若平衡时压强为
(保留三位有效数字),若平衡时压强为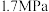 ,
,
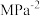 (保留三位有效数字,
(保留三位有效数字, 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。
(3)一定条件下,反应
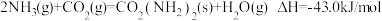 ,达到平衡.欲使反应速率增大且平衡向正反应方向移动,需要改变的条件为
,达到平衡.欲使反应速率增大且平衡向正反应方向移动,需要改变的条件为(4)温度为
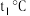 时,将等物质的量的
时,将等物质的量的 和
和 充入体积为
充入体积为 的密闭容器中发生反应:
的密闭容器中发生反应: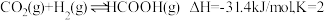 。实验测得:
。实验测得: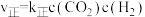 、
、 ,
, 、
、 为速率常数。
为速率常数。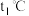 时,
时,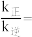
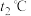 时,
时,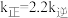 ,则
,则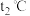
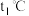 。
。
您最近一年使用:0次
名校
8 . 气态含氮化合物及相关反应是新型科研热点。
I.工业上主要采用氨催化氧化法生产NO:
主反应: 4NH3(g)+5O2(g) 4NO(g)+6H2O(g ) △H1
4NO(g)+6H2O(g ) △H1
副反应: 4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H2=- 1265kJ·mol-1
2N2(g)+6H2O(g) △H2=- 1265kJ·mol-1
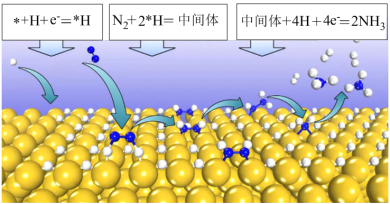
(1)王金兰课题组提出合成氨的“表面氢化机理”如图,在较低的电压下实现氮气还原合成氨。“N2+ 2*H=中间体”是氮气还原合成氨的决速步,“中间体”为___________ (写化学式)。
(2)已知N2(g)+O2(g)= 2NO(g) △H =+180kJ·mol-1,则△H1=___________ kJ·mol -1。
(3)制备NO时,在某种氨的初始含量下,温度升高一段时间后,体系中 减小,可能的原因是
减小,可能的原因是___________ 。
II.已知工业上常利用NO和Cl2反应来制备有机合成中的重要试剂亚硝酰氯(NOC1),化学方程式为2NO(g)+Cl2(g) 2NOCl(g) △H <0。
2NOCl(g) △H <0。
(4)保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比 进行反应,平衡时某反应物的转化率和氮氯比及不同温度的关系如图所示:
进行反应,平衡时某反应物的转化率和氮氯比及不同温度的关系如图所示:
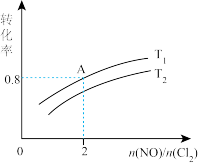
①图中T1、T2的关系为T1___________ T2(填“<”或“=”)
②体系的初始压强为P0,则A点的平衡常数Kp=___________ ; (以分压表示,分压=总压×物质的量分数)
III. NOx是空气污染物之一,用焦炭还原NO2的反应为: 2NO2(g)+2C(s) N2(g)+2CO2(g) △H >0. T°C时,向容积不等的恒容密闭容器中分别加入足量活性炭和1mol NO2,经t min,测得各容器中NO2的转化率与容器容积的关系如图所示。
N2(g)+2CO2(g) △H >0. T°C时,向容积不等的恒容密闭容器中分别加入足量活性炭和1mol NO2,经t min,测得各容器中NO2的转化率与容器容积的关系如图所示。
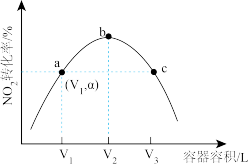
(5)①提高NO2平衡转化率可采取的措施是_____ (答出两种即可)。
②a点对应的容器,t min内v(NO2)=___________ (用含字母的代数式表示)。
③a、b、c三点中,已达平衡状态的有___________ 。
I.工业上主要采用氨催化氧化法生产NO:
主反应: 4NH3(g)+5O2(g)
 4NO(g)+6H2O(g ) △H1
4NO(g)+6H2O(g ) △H1副反应: 4NH3(g)+3O2(g)
 2N2(g)+6H2O(g) △H2=- 1265kJ·mol-1
2N2(g)+6H2O(g) △H2=- 1265kJ·mol-1(1)王金兰课题组提出合成氨的“表面氢化机理”如图,在较低的电压下实现氮气还原合成氨。“N2+ 2*H=中间体”是氮气还原合成氨的决速步,“中间体”为

(2)已知N2(g)+O2(g)= 2NO(g) △H =+180kJ·mol-1,则△H1=
(3)制备NO时,在某种氨的初始含量下,温度升高一段时间后,体系中
 减小,可能的原因是
减小,可能的原因是II.已知工业上常利用NO和Cl2反应来制备有机合成中的重要试剂亚硝酰氯(NOC1),化学方程式为2NO(g)+Cl2(g)
 2NOCl(g) △H <0。
2NOCl(g) △H <0。(4)保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比
 进行反应,平衡时某反应物的转化率和氮氯比及不同温度的关系如图所示:
进行反应,平衡时某反应物的转化率和氮氯比及不同温度的关系如图所示:
①图中T1、T2的关系为T1
②体系的初始压强为P0,则A点的平衡常数Kp=
III. NOx是空气污染物之一,用焦炭还原NO2的反应为: 2NO2(g)+2C(s)
 N2(g)+2CO2(g) △H >0. T°C时,向容积不等的恒容密闭容器中分别加入足量活性炭和1mol NO2,经t min,测得各容器中NO2的转化率与容器容积的关系如图所示。
N2(g)+2CO2(g) △H >0. T°C时,向容积不等的恒容密闭容器中分别加入足量活性炭和1mol NO2,经t min,测得各容器中NO2的转化率与容器容积的关系如图所示。
(5)①提高NO2平衡转化率可采取的措施是
②a点对应的容器,t min内v(NO2)=
③a、b、c三点中,已达平衡状态的有
您最近一年使用:0次
2022-06-27更新
|
617次组卷
|
3卷引用:四川省雅安市2022届高三下学期第三次诊断性考试理综化学试题
名校
9 . 
 。下列分析
。下列分析不正确 的是

 。下列分析
。下列分析A.氮分子的 键能大,断开该键需要较多能量 键能大,断开该键需要较多能量 |
| B.增大合成氨的反应速率与提高平衡混合物中氨的含量所采取的措施均一致 |
C.平衡混合物中 的沸点最高,液化、分离出 的沸点最高,液化、分离出 能提高其产率 能提高其产率 |
D.断裂1  和3 和3  的共价键所需能量小于断裂2 的共价键所需能量小于断裂2  的共价键所需能量 的共价键所需能量 |
您最近一年使用:0次
名校
解题方法
10 . 下列叙述与图像相符的是
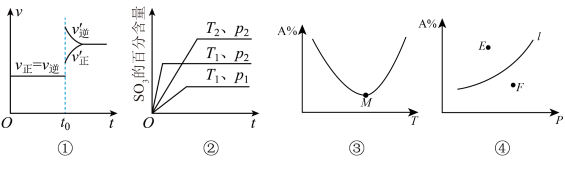

A.图①表示反应2SO2(g)+O2(g) 2SO3(g)达到平衡后在t0时刻充入了一定量的SO3 2SO3(g)达到平衡后在t0时刻充入了一定量的SO3 |
B.图②可满足反应2SO2(g)+O2(g) 2SO3(g) ΔH<0 2SO3(g) ΔH<0 |
C.图③表示反应aA(g)+bB(g) cC(g),在容器中充入1molA和1molB,经过相同时间容器中A的百分含量随温度的变化,可知反应ΔH>0 cC(g),在容器中充入1molA和1molB,经过相同时间容器中A的百分含量随温度的变化,可知反应ΔH>0 |
D.图④表示反应aA(g)+bB(g) cC(g)平衡时A的百分含量随压强的变化,可知E点v(逆)>v(正) cC(g)平衡时A的百分含量随压强的变化,可知E点v(逆)>v(正) |
您最近一年使用:0次
2021-11-23更新
|
837次组卷
|
9卷引用:浙江省杭州地区(含周边)重点中学2021-2022学年高二上学期期中联考化学试题
浙江省杭州地区(含周边)重点中学2021-2022学年高二上学期期中联考化学试题浙江省金华第一中学2021-2022学年高一上学期领军班期末联考化学试题(已下线)专题24 化学平衡图像题的突破-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)浙江省金华一中(领军班)2021-2022学年高一上学期期末化学试题北京市第五十五中学2021-2022学年高二上学期期中考试化学试题北京市第五十五中学2022-2023学年高二上学期期中考试化学试题河南省兰考县第二高级中学2021-2022学年高二上学期第三次考试化学试题甘肃省张掖市2022-2023学年高二下学期第一次全市联考化学试题北京市第一○一中学2023-2024学年高二上学期期中练习化学试题



