名校
解题方法
1 . 氮的循环在自然界中具有重要的意义。
(1)已知:①
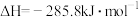
②

③ )
) 
则合成氨反应的热化学方程式为_______ 。
(2)下列有关合成氨反应的说法正确的是_______ (填字母)。
A.反应温度控制在500℃左右而不是室温能用勒夏特列原理解释
B. 和
和 的物质的量之比保持不变时,说明反应达到平衡状态
的物质的量之比保持不变时,说明反应达到平衡状态
C.该反应的 和
和 都小于零
都小于零
D. 易液化,不断将液氨移去,利于反应正向进行
易液化,不断将液氨移去,利于反应正向进行
E.催化剂能增大反应的平衡常数
(3)合成氨反应途径可简单地表示为:①
 ;②
;②
 。已知反应①和②的活化能分别为126
。已知反应①和②的活化能分别为126 和13
和13 ,则合成氨反应的
,则合成氨反应的 在有催化剂(a)和无催化剂(b)时反应过程能量变化图是_______(填字母)。
在有催化剂(a)和无催化剂(b)时反应过程能量变化图是_______(填字母)。
(4)将一定比例的 和
和 的混合气体匀速通入装有催化剂的反应器中反应,反应相同时间时,
的混合气体匀速通入装有催化剂的反应器中反应,反应相同时间时, 的转化率随反应温度的变化曲线如图所示。
的转化率随反应温度的变化曲线如图所示。

①在50℃~150℃范围内,随温度升高, 的转化率迅速上升的主要原因是
的转化率迅速上升的主要原因是_______ 。
②当反应温度高于380℃时, 的转化率迅速下降的主要原因可能是
的转化率迅速下降的主要原因可能是_______ 。
(1)已知:①

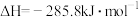
②


③
 )
) 
则合成氨反应的热化学方程式为
(2)下列有关合成氨反应的说法正确的是
A.反应温度控制在500℃左右而不是室温能用勒夏特列原理解释
B.
 和
和 的物质的量之比保持不变时,说明反应达到平衡状态
的物质的量之比保持不变时,说明反应达到平衡状态C.该反应的
 和
和 都小于零
都小于零D.
 易液化,不断将液氨移去,利于反应正向进行
易液化,不断将液氨移去,利于反应正向进行E.催化剂能增大反应的平衡常数
(3)合成氨反应途径可简单地表示为:①

 ;②
;②
 。已知反应①和②的活化能分别为126
。已知反应①和②的活化能分别为126 和13
和13 ,则合成氨反应的
,则合成氨反应的 在有催化剂(a)和无催化剂(b)时反应过程能量变化图是_______(填字母)。
在有催化剂(a)和无催化剂(b)时反应过程能量变化图是_______(填字母)。A. | B. |
C.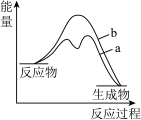 | D. |
 和
和 的混合气体匀速通入装有催化剂的反应器中反应,反应相同时间时,
的混合气体匀速通入装有催化剂的反应器中反应,反应相同时间时, 的转化率随反应温度的变化曲线如图所示。
的转化率随反应温度的变化曲线如图所示。
①在50℃~150℃范围内,随温度升高,
 的转化率迅速上升的主要原因是
的转化率迅速上升的主要原因是②当反应温度高于380℃时,
 的转化率迅速下降的主要原因可能是
的转化率迅速下降的主要原因可能是
您最近一年使用:0次
2 . 二氧化碳、甲烷等是主要的温室气体。研发二氧化碳和甲烷的利用技术对治理生态环境具有重要意义。
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1=akJ/molK1
CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=bkJ/molK2
2CO(g)+O2(g)=2CO2(g) ΔH3=ckJ/mol K3
则催化重整反应CO2(g)+CH4(g)⇌2CO(g)+2H2(g)的ΔH4=_______ ,平衡常数K4=_______ (用含K1、K2、K3的代数式表示)。
(2)催化重整反应CO2(g)+CH4(g)⇌2CO(g)+2H2(g)中,测得CH4的平衡转化率与温度及压强的关系如下图所示:

①该反应ΔH_______ 0(填“>”“<”“=”)
②由图可知,P1、P2、P3、P4由大到小的顺序为_______ 。
③在压强为P4、投料比n(CH4)/n(CO2)=1、950℃的条件下,X点平衡常数Kp=_______ 。
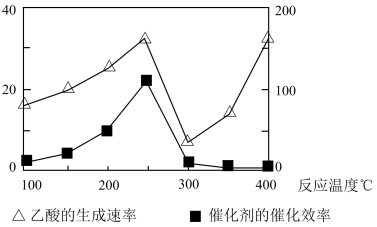
(3)以二氧化钛表面覆盖Cu2Al2O4为催化剂,还可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率却在降低的原因是_______ 。
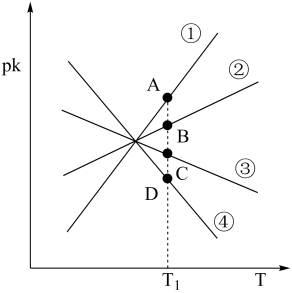
(4)反应CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=+41.17kJ/mol的正、逆反应速率可分别表示为v正=k正c(CO2)•c(H2)、v逆=k逆c(CO)•c(H2O),则如图所示的四条斜线中,能表示pk正(pk=-lgk)随T变化关系的是_______ (填序号)。
(5)一种以甲醇为原料,利用SnO2(mSnO2/CC)和CuO纳米片(CuONS/CF)作催化电极,制备甲酸(甲酸盐)的电化学装置的工作原理如图所示。
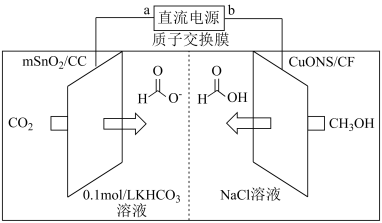
①电解过程中阳极电极反应式为_______ 。
②当有4molH+通过质子交换膜时,装置中生成HCOO-和HCOOH共计_______ mol。
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1=akJ/molK1
CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=bkJ/molK2
2CO(g)+O2(g)=2CO2(g) ΔH3=ckJ/mol K3
则催化重整反应CO2(g)+CH4(g)⇌2CO(g)+2H2(g)的ΔH4=
(2)催化重整反应CO2(g)+CH4(g)⇌2CO(g)+2H2(g)中,测得CH4的平衡转化率与温度及压强的关系如下图所示:

①该反应ΔH
②由图可知,P1、P2、P3、P4由大到小的顺序为
③在压强为P4、投料比n(CH4)/n(CO2)=1、950℃的条件下,X点平衡常数Kp=
(3)以二氧化钛表面覆盖Cu2Al2O4为催化剂,还可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率却在降低的原因是

(4)反应CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=+41.17kJ/mol的正、逆反应速率可分别表示为v正=k正c(CO2)•c(H2)、v逆=k逆c(CO)•c(H2O),则如图所示的四条斜线中,能表示pk正(pk=-lgk)随T变化关系的是

(5)一种以甲醇为原料,利用SnO2(mSnO2/CC)和CuO纳米片(CuONS/CF)作催化电极,制备甲酸(甲酸盐)的电化学装置的工作原理如图所示。

①电解过程中阳极电极反应式为
②当有4molH+通过质子交换膜时,装置中生成HCOO-和HCOOH共计
您最近一年使用:0次
3 . 下列事实不能用勒夏特列原理解释的是
| A.在氯化氢气流中将氯化铝溶液蒸干获得氯化铝固体 |
| B.某实验中用食盐水洗涤氯化银沉淀 |
C.一定温度下反应2NO2(g)  N2O4(g)达到平衡后,压缩容器体积观察到气体颜色先变深后变浅,但比原来的颜色深 N2O4(g)达到平衡后,压缩容器体积观察到气体颜色先变深后变浅,但比原来的颜色深 |
| D.H2O2溶液与酸性FeCl2溶液混合时观察到颜色由浅绿色变成黄色,产生的气泡越来越多 |
您最近一年使用:0次
解题方法
4 . 气态烯烃广泛用于塑料、纤维、洗涤剂等的合成。中科院某研究所在丙烷脱氢反应制备丙烯的条件控制方面进行了深入地研究。
(1)已知:H2(g)、C3H6(g)、C3H8(g)的燃烧热(∆H)分别为-285.8kJ·mol-1、-2058kJ·mol-1、-2219.9kJ·mol-1。计算:C3H8(g)⇌C3H6(g)+H2(g) ∆H=____ kJ·mol-1,常温下该反应的∆S=+0.1kJ·mol-1·K-1,则常温下该反应____ (填“能”或“不能”)自发进行。
(2)某种氧化硼催化剂(BOS)催化丙烷脱氢制丙烯的反应路径如图一,反应结果测定如图二。
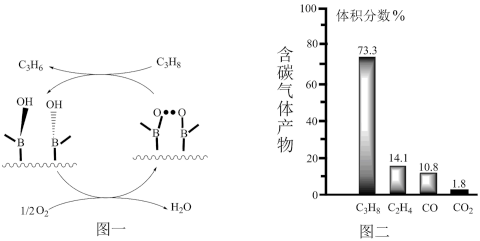
写出该路径主反应的化学方程式:__ ;结合图二,该反应路径可以提高丙烯产率的原因是___ 。
(3)在体积可变的密闭容器中充入由3mol丙烷分别在3.0×104Pa、1.2×105Pa时发生脱氢反应。测得不同温度下的平衡态中,丙烷、丙烯的物质的量分数变化关系如图所示:
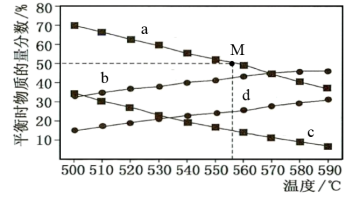
①1.2×105Pa时丙烯的物质的量分数随温度变化的关系曲线是____ 。
②下列叙述能说明此反应已达平衡状态的是____ 。
a.混合气体密度保持不变
b.C3H6和H2的浓度相等
c.相同时间断开和形成的碳氢键数目相同
d.混合气体的摩尔质量不再改变
③计算M点的平衡常数Kp=__ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(1)已知:H2(g)、C3H6(g)、C3H8(g)的燃烧热(∆H)分别为-285.8kJ·mol-1、-2058kJ·mol-1、-2219.9kJ·mol-1。计算:C3H8(g)⇌C3H6(g)+H2(g) ∆H=
(2)某种氧化硼催化剂(BOS)催化丙烷脱氢制丙烯的反应路径如图一,反应结果测定如图二。

写出该路径主反应的化学方程式:
(3)在体积可变的密闭容器中充入由3mol丙烷分别在3.0×104Pa、1.2×105Pa时发生脱氢反应。测得不同温度下的平衡态中,丙烷、丙烯的物质的量分数变化关系如图所示:

①1.2×105Pa时丙烯的物质的量分数随温度变化的关系曲线是
②下列叙述能说明此反应已达平衡状态的是
a.混合气体密度保持不变
b.C3H6和H2的浓度相等
c.相同时间断开和形成的碳氢键数目相同
d.混合气体的摩尔质量不再改变
③计算M点的平衡常数Kp=
您最近一年使用:0次
5 . 甲、乙均为1 L的恒容密闭容器,向甲中充入1 mol CH4和1 mol CO2,乙中充入1 mol CH4和n mol CO2,在催化剂存在下发生反应:CH4(g)+CO2(g)⇌2CO(g)+2H2(g),测得CH4的平衡转化率随温度的变化如图所示。下列说法正确的是
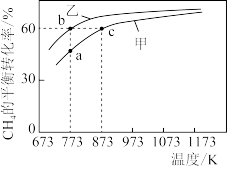

| A.该反应的正反应是放热反应 |
| B.773K时,该反应的平衡常数小于12.96 |
| C.H2的体积分数:φ(b)=φ(c) |
| D.873K时,向甲的平衡体系中再充入CO2、CH4各0.4mol,CO、H2各1.2 mol,平衡不发生移动 |
您最近一年使用:0次
2021-03-17更新
|
1665次组卷
|
14卷引用:四川省广安友谊中学2021-2022学年高二上学期11月质量检测化学试题
四川省广安友谊中学2021-2022学年高二上学期11月质量检测化学试题山东省临沂市2020届高三下学期4月一模考试化学试题湖北省安陆市第一中学2021届高三8月月考化学试题江苏省扬州市2020-2021高二上学期期末调研化学试题河南省开封市五县2020-2021学年高二上学期期末考试化学试题重庆市南开中学2020-2021学年二上学期期末考试化学试题浙江省天台中学2021-2022学年高二上学期返校考试化学试题浙江省绍兴市诸暨中学2021-2022学年高一上学期期中考试(实验班)化学试题湖南省嘉禾县第一中学2021-2022学年高二上学期10月月考化学试题黑龙江省哈尔滨市第三中学校2021-2022学年高二上学期期末考试化学试题河北省保定市徐水综合高级中学2021-2022学年高二上学期第二次月考化学试题重庆市重庆实验外国语学校2021-2022学年高二上学期1月月考化学试题黑龙江省双鸭山市第一中学2021-2022学年高二下学期开学考试化学试题广东省汕头市金山中学2023-2024学年高二上学期10月阶段考试 化学 Word版含答案
名校
解题方法
6 . 硝酸工业中产生的NO是一种大气污染物,可以通过如下反应处理:2NO(g)+2CO(g)  N2 (g)+ 2CO2(g); △H1。
N2 (g)+ 2CO2(g); △H1。
(1)已知:2CO(g)+O2(g)=2CO2(g);△H2=-566 kJ·mol-l,N2(g)+O2(g) 2NO(g); △H3=+181 kJ ·mol-l,则△H1=
2NO(g); △H3=+181 kJ ·mol-l,则△H1=___________
(2)在一定温度下,向体积为2L的密闭容器中充入4 mol NO、2 mol CO。
①若为恒容密闭容器,在10min时达到平衡状态,压强为原来的14/15,这段时间内,NO的平均反应速率为___________ ,平衡常数为___________ L· mol-1,此时NO的转化率a%;平衡后,向恒容密闭容器中再充入2 mol NO、1 mol CO,重新达到平衡时,NO的转化率将___________ (填“增大”、“不变”或“减小”);
②若为恒压密闭容器,平衡后NO的转化率为b%,则a%________ b%(填“<”、“=”或>”)
(3)工业上,NO与CO混合气体以一定流速和一定的比例,通过填充有A、B催化剂的反应器,在A、B两种催化剂作用下,CO转化率与温度的关系如下图所示。
①工业上选择催化剂___________ (填“A”或“B),理由是___________ 。
②在催化剂B作用下,高于550K时,CO转化率下降的理由可能是___________ 。
 N2 (g)+ 2CO2(g); △H1。
N2 (g)+ 2CO2(g); △H1。(1)已知:2CO(g)+O2(g)=2CO2(g);△H2=-566 kJ·mol-l,N2(g)+O2(g)
 2NO(g); △H3=+181 kJ ·mol-l,则△H1=
2NO(g); △H3=+181 kJ ·mol-l,则△H1=(2)在一定温度下,向体积为2L的密闭容器中充入4 mol NO、2 mol CO。
①若为恒容密闭容器,在10min时达到平衡状态,压强为原来的14/15,这段时间内,NO的平均反应速率为
②若为恒压密闭容器,平衡后NO的转化率为b%,则a%
(3)工业上,NO与CO混合气体以一定流速和一定的比例,通过填充有A、B催化剂的反应器,在A、B两种催化剂作用下,CO转化率与温度的关系如下图所示。

①工业上选择催化剂
②在催化剂B作用下,高于550K时,CO转化率下降的理由可能是
您最近一年使用:0次
2019-01-02更新
|
688次组卷
|
4卷引用:【省级联考】四川省2019届高三上学期“联测促改”活动(上)理科综合化学试题
7 . 氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。回答下列问题:
已知:2C(s)+O2(g)=2CO(g) ΔH=- 221 kJ/mol
C(s)+O2(g)=CO2(g) ΔH=- 393.5 kJ/mol
N2(g)+O2(g)=2NO(g) ΔH= +181 kJ/mol
(1)若某反应的平衡常数表达式为K=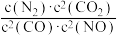 ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:_______ ;下列措施能够增大此反应中NO的转化率的是(填字母代号)_______ 。
a.增大容器压强 b.升高温度 c.使用优质催化剂 d.增大CO的浓度
(2)向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
①T1℃,0~5min内,以CO2表示的该反应速率v(CO2)=_______ ,该条件下的平衡常数K=_______ 。
②第15 min后,温度调整到T2,数据变化如上表所示,则T1_______ T2(填“>”、“<”或“=”)。
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2 mol,则此时反应_______ 移动(填“正向”、“逆向”或“不”);最终达平衡时NO的转化率a=_______ 。
已知:2C(s)+O2(g)=2CO(g) ΔH=- 221 kJ/mol
C(s)+O2(g)=CO2(g) ΔH=- 393.5 kJ/mol
N2(g)+O2(g)=2NO(g) ΔH= +181 kJ/mol
(1)若某反应的平衡常数表达式为K=
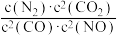 ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:a.增大容器压强 b.升高温度 c.使用优质催化剂 d.增大CO的浓度
(2)向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g)
 N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。| 物质的量/mol | T1/℃ | T2/℃ | |||||
| 0 | 5 min | 10 min | 15 min | 20 min | 15 min | 30 min | |
| NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
| N2 | 0 | 0.42 | 0.60 | 0.60 | 0.75 | 0.80 | 0.80 |
②第15 min后,温度调整到T2,数据变化如上表所示,则T1
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2 mol,则此时反应
您最近一年使用:0次
2018-09-10更新
|
353次组卷
|
6卷引用:四川省广安市北京师范大学广安实验学校2020-2021学年高二上学期9月月考化学试题



