1 . 甲醇是一种用途非常广泛的基础化工原料,可通过下列反应合成:
Ⅰ.CO(g)+2H2(g) CH3OH(g)△H1
CH3OH(g)△H1
Ⅱ.CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2
Ⅲ.CO(g)+H2O(g) CO2(g)+H2(g)△H3
CO2(g)+H2(g)△H3
回答下列问题
(1)反应(Ⅰ)的△S________ (填“>”或“<”)0,△H1=________ (用△H2、△H3表示)。
(2)上述反应的平衡常数的自然对数值lnKP(KP为以分压表示的平衡常数)与温度的关系如图甲所示
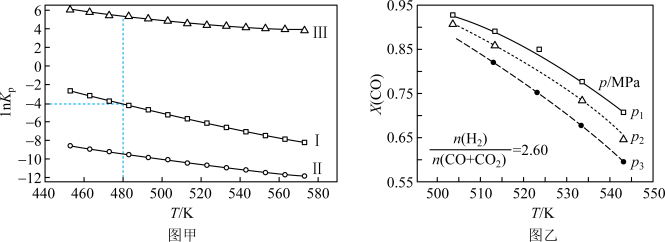
①反应(Ⅱ)的△H________ (填“>”或“<”)0。
②480K时,lnKP(Ⅰ)+lnKp(Ⅱ)+lnKp(Ⅲ)=________ 。
③某温度下,向某恒容密闭容器中充入0.1 molCO和0.2molH2发生反应(Ⅰ),达到平衡时,CO的转化率为90%,若平衡时总压强5MPa,则KP=________ (KP为以分压表示的平衡常数,分压=总压×物质的量分数)。
(3)若用CO和CO2混合气体合成甲醇,起始时均控制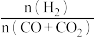 =2.60,CO的平衡转化率X(CO)与温度及压强的关系如图乙所示。下列说法正确的是
=2.60,CO的平衡转化率X(CO)与温度及压强的关系如图乙所示。下列说法正确的是_____ (填字母)。
A p1<p2<p3
B 升高温度,反应速率和X(CO)均减小
C 起始时若p2=7.2MPa,则H2的分压为5.2MPa
D 其他条件不变,增大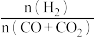 ,X(CO)增大
,X(CO)增大
Ⅰ.CO(g)+2H2(g)
 CH3OH(g)△H1
CH3OH(g)△H1Ⅱ.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2Ⅲ.CO(g)+H2O(g)
 CO2(g)+H2(g)△H3
CO2(g)+H2(g)△H3回答下列问题
(1)反应(Ⅰ)的△S
(2)上述反应的平衡常数的自然对数值lnKP(KP为以分压表示的平衡常数)与温度的关系如图甲所示

①反应(Ⅱ)的△H
②480K时,lnKP(Ⅰ)+lnKp(Ⅱ)+lnKp(Ⅲ)=
③某温度下,向某恒容密闭容器中充入0.1 molCO和0.2molH2发生反应(Ⅰ),达到平衡时,CO的转化率为90%,若平衡时总压强5MPa,则KP=
(3)若用CO和CO2混合气体合成甲醇,起始时均控制
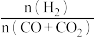 =2.60,CO的平衡转化率X(CO)与温度及压强的关系如图乙所示。下列说法正确的是
=2.60,CO的平衡转化率X(CO)与温度及压强的关系如图乙所示。下列说法正确的是A p1<p2<p3
B 升高温度,反应速率和X(CO)均减小
C 起始时若p2=7.2MPa,则H2的分压为5.2MPa
D 其他条件不变,增大
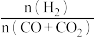 ,X(CO)增大
,X(CO)增大
您最近一年使用:0次
名校
2 . CO、H2是煤的气化产物,在生产生活中用途广泛。
(1)CO还原法处理大气污染物SO2
①2CO(g)+ SO2(g) S(s)+2CO2(g)∆H = -270 kJ·mol-1,该反应的平衡常数表达式为
S(s)+2CO2(g)∆H = -270 kJ·mol-1,该反应的平衡常数表达式为__ 。
②在绝热恒容的密闭容器中进行上述反应,下列说法正确的是_____ 。
a若混合气体密度保持不变,则已达平衡状态
b达平衡后若再充人一定量CO2,平衡常数保持不变
c分离出部分S,正、逆反应速率均保持不变,平衡不移动
d从反应开始到平衡,容器内气体的压强保持不变
③向2 L恒温恒容密闭容器中通入2 mol CO、1 mol SO2,分别进行a、b、c三组实验。在不同催化剂件下发生反应:2CO(g)+ SO2(g) S(s)+2CO2(g)∆H = -270 kJ·mol-1,反应体系总压随时间的变化如下表所示,则三组实验温度的大小关系是
S(s)+2CO2(g)∆H = -270 kJ·mol-1,反应体系总压随时间的变化如下表所示,则三组实验温度的大小关系是_____ (用a、b、c表示),实验a从反应开始至45s达到平衡,则该过程反应速率v(SO2)__________ (结果保留2位有效数字)。

(2)利用CO、H2可制备天然气,主要反应为:
CO(g)+ 3H2(g) CH4(g)+ H2O(g)∆H1=-206.2 kJ·mol-1;
CH4(g)+ H2O(g)∆H1=-206.2 kJ·mol-1;
CO(g)+ H2O(g) CO2(g)+ H2(g)∆H2= -41.0 kJ·mol-1;
CO2(g)+ H2(g)∆H2= -41.0 kJ·mol-1;
H2O(l)═H2O(g)∆H3=+44 kJ·mol-1。
回答下列问题:
①反应CO2(g)+ 4H2(g) CH4(g)+ 2H2O(l)的∆H4=
CH4(g)+ 2H2O(l)的∆H4=________ kJ·mol-1。某温度下,分别在起始容积相同的恒压容器A、恒容容器B中加入1molCO2和4molH2的混合气体,两容器反应达到平衡后放出或吸收的热量较多的是__ (填“A”或“B")。
②在恒压管道反应器中按n(H2):n(CO)= 3:1通入原料气,在催化剂作用下制备合成天然气,400℃p总为100 kPa时反应体系平衡组成如下表所示:
则该条件下CO的总转化率α=____ 。
③制备合成天然气采用在原料气中通入水蒸气来缓解催化剂积碳。
积碳反应为:反应I:CH4(g) C(s)+ 2H2(g)∆H = +75 kJ·mol-1;
C(s)+ 2H2(g)∆H = +75 kJ·mol-1;
反应Ⅱ:2CO(g) C(s)+ CO2(g)∆H = -172 kJ·mol-1,
C(s)+ CO2(g)∆H = -172 kJ·mol-1,
平衡体系中水蒸气浓度对积碳量的影响如图所示,下列说法正确的是__ 。
A曲线1在700 ~ 800℃积碳量减小的原因可能是反应Ⅱ逆向移动
B曲线1在550 ~700℃积碳量增大的原因可能是反应I、Ⅱ的速率增大
C曲线2、3在550 ~800℃积碳量较低的原因是水蒸气稀释作用使积碳反应速率减小
D水蒸气能吸收反应放出的热量,降低体系温度至550℃以下,有利于减少积碳

(1)CO还原法处理大气污染物SO2
①2CO(g)+ SO2(g)
 S(s)+2CO2(g)∆H = -270 kJ·mol-1,该反应的平衡常数表达式为
S(s)+2CO2(g)∆H = -270 kJ·mol-1,该反应的平衡常数表达式为②在绝热恒容的密闭容器中进行上述反应,下列说法正确的是
a若混合气体密度保持不变,则已达平衡状态
b达平衡后若再充人一定量CO2,平衡常数保持不变
c分离出部分S,正、逆反应速率均保持不变,平衡不移动
d从反应开始到平衡,容器内气体的压强保持不变
③向2 L恒温恒容密闭容器中通入2 mol CO、1 mol SO2,分别进行a、b、c三组实验。在不同催化剂件下发生反应:2CO(g)+ SO2(g)
 S(s)+2CO2(g)∆H = -270 kJ·mol-1,反应体系总压随时间的变化如下表所示,则三组实验温度的大小关系是
S(s)+2CO2(g)∆H = -270 kJ·mol-1,反应体系总压随时间的变化如下表所示,则三组实验温度的大小关系是
(2)利用CO、H2可制备天然气,主要反应为:
CO(g)+ 3H2(g)
 CH4(g)+ H2O(g)∆H1=-206.2 kJ·mol-1;
CH4(g)+ H2O(g)∆H1=-206.2 kJ·mol-1;CO(g)+ H2O(g)
 CO2(g)+ H2(g)∆H2= -41.0 kJ·mol-1;
CO2(g)+ H2(g)∆H2= -41.0 kJ·mol-1;H2O(l)═H2O(g)∆H3=+44 kJ·mol-1。
回答下列问题:
①反应CO2(g)+ 4H2(g)
 CH4(g)+ 2H2O(l)的∆H4=
CH4(g)+ 2H2O(l)的∆H4=②在恒压管道反应器中按n(H2):n(CO)= 3:1通入原料气,在催化剂作用下制备合成天然气,400℃p总为100 kPa时反应体系平衡组成如下表所示:
| 组分 | CH4 | H2O | H2 | CO2 | CO |
| 体积分数/% | 45.0 | 42.5 | 10.0 | 1.50 | 1.00 |

③制备合成天然气采用在原料气中通入水蒸气来缓解催化剂积碳。
积碳反应为:反应I:CH4(g)
 C(s)+ 2H2(g)∆H = +75 kJ·mol-1;
C(s)+ 2H2(g)∆H = +75 kJ·mol-1;反应Ⅱ:2CO(g)
 C(s)+ CO2(g)∆H = -172 kJ·mol-1,
C(s)+ CO2(g)∆H = -172 kJ·mol-1,平衡体系中水蒸气浓度对积碳量的影响如图所示,下列说法正确的是
A曲线1在700 ~ 800℃积碳量减小的原因可能是反应Ⅱ逆向移动
B曲线1在550 ~700℃积碳量增大的原因可能是反应I、Ⅱ的速率增大
C曲线2、3在550 ~800℃积碳量较低的原因是水蒸气稀释作用使积碳反应速率减小
D水蒸气能吸收反应放出的热量,降低体系温度至550℃以下,有利于减少积碳

您最近一年使用:0次
2020-03-05更新
|
193次组卷
|
2卷引用:黑龙江省大庆实验中学2020届高三下学期开学考试理综化学试题



