名校
解题方法
1 . 甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。
Ⅰ.用CO2生产甲醇
(1)已知:H2的燃烧热为-285.8kJ/mol,CH3OH(l)的燃烧热为-725.8kJ/mol,
CH3OH(g)=CH3OH(l) ΔH=-37.3kJ/mol
则CO2(g)+3H2(g) CH3OH(g)+H2O(l)ΔH=
CH3OH(g)+H2O(l)ΔH=__ kJ/mol。
(2)将CO2和H2按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应,如图1两条曲线分别表示压强为0.1MPa和5.0MPa下CO2转化率随温度的变化关系。

其中a点的平衡常数表达式为:__ 。
②a,b两点化学反应速率分别用Va、Vb表示,则Va__ Vb(填“大于”、“小于”或“等于”)。
(3)在1.0L恒容密闭容器中投入1molCO2和2.75molH2发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是
CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是__ 。
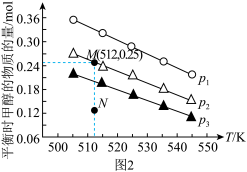
A.该反应的正反应为放热反应
B.压强大小关系为p1<p2<p3
C.M点对应的平衡常数K的值约为1.04×10-2
D.在p2及512K时,图中N点v(正)<v(逆)
Ⅱ.用CO生产甲醇
(4)已知:CO(g)+2H2(g) CH3OH(g),如图3是该反应在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g),如图3是该反应在不同温度下CO的转化率随时间变化的曲线。
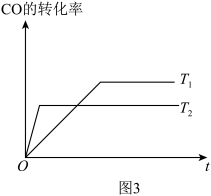
①该反应的焓变ΔH__ 0(填“ ”、“ ”或“ ”)。
②T1和T2温度下的平衡常数大小关系是K1___ K2(填“>”、“<”或“=”)。
Ⅲ.甲醇的应用
(5)甲醇制氢气。甲醇水蒸气重整制氢反应:CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49kJ/mol。某温度下,将[n(H2O):n(CH3OH)]=1:1的原料气充入恒容密闭容器中,初始压强为p1,反应达到平衡时总压强为p2,则平衡时甲醇的转化率为___ 。
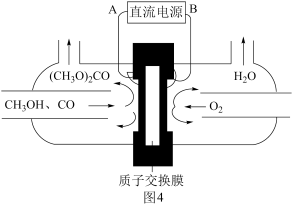
(6)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图4所示。阳极的电极反应式为__ 。
Ⅰ.用CO2生产甲醇
(1)已知:H2的燃烧热为-285.8kJ/mol,CH3OH(l)的燃烧热为-725.8kJ/mol,
CH3OH(g)=CH3OH(l) ΔH=-37.3kJ/mol
则CO2(g)+3H2(g)
 CH3OH(g)+H2O(l)ΔH=
CH3OH(g)+H2O(l)ΔH=(2)将CO2和H2按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应,如图1两条曲线分别表示压强为0.1MPa和5.0MPa下CO2转化率随温度的变化关系。

其中a点的平衡常数表达式为:
②a,b两点化学反应速率分别用Va、Vb表示,则Va
(3)在1.0L恒容密闭容器中投入1molCO2和2.75molH2发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是
CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是
A.该反应的正反应为放热反应
B.压强大小关系为p1<p2<p3
C.M点对应的平衡常数K的值约为1.04×10-2
D.在p2及512K时,图中N点v(正)<v(逆)
Ⅱ.用CO生产甲醇
(4)已知:CO(g)+2H2(g)
 CH3OH(g),如图3是该反应在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g),如图3是该反应在不同温度下CO的转化率随时间变化的曲线。
①该反应的焓变ΔH
②T1和T2温度下的平衡常数大小关系是K1
Ⅲ.甲醇的应用
(5)甲醇制氢气。甲醇水蒸气重整制氢反应:CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49kJ/mol。某温度下,将[n(H2O):n(CH3OH)]=1:1的原料气充入恒容密闭容器中,初始压强为p1,反应达到平衡时总压强为p2,则平衡时甲醇的转化率为
(6)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图4所示。阳极的电极反应式为

您最近一年使用:0次
2 . 重铬酸钠是一种用途极广的强氧化剂,工业上可以用铬铁矿[主要成分为Fe(CrO2)2或FeO·Cr2O3,还含有Al2O3、Fe2O3、SiO2等杂质]制备,其主要工艺流程如图所示。请回答下列问题:

(1)煅烧铬铁矿生成Na2CrO4的化学方程式为______________________ 。
(2)调节溶液的pH所选的试剂为___________ (填名称),写出生成Al(OH)3的化学方程式______________________ 。
(3)Na2CrO4溶液酸化时发生反应2CrO42-(黄色)+2H+ Cr2O72-(橙红色)+H2O。
Cr2O72-(橙红色)+H2O。
①该反应___________ 氧化还原反应(填“是”或“不是”),反应的平衡常数表达式:K=___________ 。
②若向Na2Cr2O7溶液(橙红色)中加入足量的NaOH固体,溶液___________ (填标号)
A 变黄色 B 颜色不变 C 变红色溶液
③已知:25℃时,Ag2CrO4的Ksp=1.12×10-12,Ag2Cr2O7,的Ksp=2×10-7。25℃时,向Na2Cr2O7溶液中加入AgNO3溶液,生成砖红色沉淀,且溶液酸性增强,该沉淀的化学式是___________ 。
(4)用重铬酸钠(Na2Cr2O7)结晶后的母液生产重铬酸钾的反应为Na2Cr2O7+2KCl=K2Cr2O7+2NaCl,结合溶解度图回答,冷却结晶析出大量K2Cr2O7的原因是___________ 。


(1)煅烧铬铁矿生成Na2CrO4的化学方程式为
(2)调节溶液的pH所选的试剂为
(3)Na2CrO4溶液酸化时发生反应2CrO42-(黄色)+2H+
 Cr2O72-(橙红色)+H2O。
Cr2O72-(橙红色)+H2O。①该反应
②若向Na2Cr2O7溶液(橙红色)中加入足量的NaOH固体,溶液
A 变黄色 B 颜色不变 C 变红色溶液
③已知:25℃时,Ag2CrO4的Ksp=1.12×10-12,Ag2Cr2O7,的Ksp=2×10-7。25℃时,向Na2Cr2O7溶液中加入AgNO3溶液,生成砖红色沉淀,且溶液酸性增强,该沉淀的化学式是
(4)用重铬酸钠(Na2Cr2O7)结晶后的母液生产重铬酸钾的反应为Na2Cr2O7+2KCl=K2Cr2O7+2NaCl,结合溶解度图回答,冷却结晶析出大量K2Cr2O7的原因是

您最近一年使用:0次
2019-04-18更新
|
986次组卷
|
2卷引用:【市级联考】陕西省榆林市2019届高三下学期高考模拟第三次测试理科综合化学试题
名校
解题方法
3 . Ⅰ.在1.0 L密闭容器中放入0.10molA(g),在一定温度进行如下反应:A(g) 2B(g)+C(g)+D(s) △H= +85.1kJ·mol-1,容器内气体总压强(P)与起始压强P0的比值随反应时间(t)数据见下表:
2B(g)+C(g)+D(s) △H= +85.1kJ·mol-1,容器内气体总压强(P)与起始压强P0的比值随反应时间(t)数据见下表:
回答下列问题:
(1)下列能提高A的转化率的是____ 。
A 升高温度 B 体系中通入A气体
C 将D的浓度减小 D 通入稀有气体He,使体系压强增大到原来的5倍
E 若体系中的C为HCl,其它物质均难溶于水,滴入少许水
(2)该反应的平衡常数表达式K=___ ;前2小时C的反应速率是____ ;计算平衡时A的转化率_____ 。
(3)若将容器改为恒压容器,改变条件,使反应达到与上述相同的转化率,则达到平衡时B浓度为____ 。(保留两位有效数字)
Ⅱ.锂的化合物用途广泛。Li3N是非常有前途的储氢材料;LiFePO4、Li2FeSiO4等可以作为电池的正极材料。请回答下列问题:
(4)氮化锂在氢气中加热时可得到氨基锂(LiNH2),其反应的化学方程式为:Li3N+2H2 LiNH2+2LiH,在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的
LiNH2+2LiH,在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的____ %(精确到0.1%)。
(5)将Li2CO3、FeC2O4·2H2O和SiO2粉末均匀混合,在800℃的氩气中烧结6小时制得Li2FeSiO4,写出该反应的化学方程式______ 。
(6)磷酸亚铁锂电池稳定性高、安全、对环境友好,该电池在充放电过程中,发生LiFePO4与Li1-xFePO4之间的转化,电池放电时负极发生的反应为LiXC6-xe- =xLi++6C,写出电池放电时的化学方程式____ 。
 2B(g)+C(g)+D(s) △H= +85.1kJ·mol-1,容器内气体总压强(P)与起始压强P0的比值随反应时间(t)数据见下表:
2B(g)+C(g)+D(s) △H= +85.1kJ·mol-1,容器内气体总压强(P)与起始压强P0的比值随反应时间(t)数据见下表:| 时间t/ h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 |
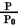 | 1.00 | 1.50 | 1.80 | 2.20 | 2.30 | 2.38 | 2.40 | 2.40 |
回答下列问题:
(1)下列能提高A的转化率的是
A 升高温度 B 体系中通入A气体
C 将D的浓度减小 D 通入稀有气体He,使体系压强增大到原来的5倍
E 若体系中的C为HCl,其它物质均难溶于水,滴入少许水
(2)该反应的平衡常数表达式K=
(3)若将容器改为恒压容器,改变条件,使反应达到与上述相同的转化率,则达到平衡时B浓度为
Ⅱ.锂的化合物用途广泛。Li3N是非常有前途的储氢材料;LiFePO4、Li2FeSiO4等可以作为电池的正极材料。请回答下列问题:
(4)氮化锂在氢气中加热时可得到氨基锂(LiNH2),其反应的化学方程式为:Li3N+2H2
 LiNH2+2LiH,在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的
LiNH2+2LiH,在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的(5)将Li2CO3、FeC2O4·2H2O和SiO2粉末均匀混合,在800℃的氩气中烧结6小时制得Li2FeSiO4,写出该反应的化学方程式
(6)磷酸亚铁锂电池稳定性高、安全、对环境友好,该电池在充放电过程中,发生LiFePO4与Li1-xFePO4之间的转化,电池放电时负极发生的反应为LiXC6-xe- =xLi++6C,写出电池放电时的化学方程式
您最近一年使用:0次
名校
4 . 金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下密闭容器中用H2还原WO3可得到金属钨,其总反应为: WO3(s)+3H2(g) W (s) +3H2O (g),请回答下列问题:
W (s) +3H2O (g),请回答下列问题:
(1)上述反应的化学平衡常数表达式为___________________ 。
(2)某温度下反应达到平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为_________ ;随着温度的升高,H2与水蒸气的体积比减小,则该反应为________ 反应(填“吸热”或“放热”)。
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
第一阶段反应的化学方程式为_______________________________________ ;
(4)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W(s)+ I2 (g) WI2 (g)。下列说法正确的有
WI2 (g)。下列说法正确的有________ 。
a.利用该反应原理可以提纯钨
b.WI2在灯丝上分解,产生的W又沉积在灯丝上
c.WI2在灯管壁上分解,使灯管的寿命延长
d.温度升高时,WI2的分解速率加快,W和I2的化合速率减慢
 W (s) +3H2O (g),请回答下列问题:
W (s) +3H2O (g),请回答下列问题:(1)上述反应的化学平衡常数表达式为
(2)某温度下反应达到平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
| 温度 | 25 ℃~550 ℃~600 ℃~700 ℃ |
| 主要成分 | WO3 W2O5 WO2 W |
第一阶段反应的化学方程式为
(4)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W(s)+ I2 (g)
 WI2 (g)。下列说法正确的有
WI2 (g)。下列说法正确的有a.利用该反应原理可以提纯钨
b.WI2在灯丝上分解,产生的W又沉积在灯丝上
c.WI2在灯管壁上分解,使灯管的寿命延长
d.温度升高时,WI2的分解速率加快,W和I2的化合速率减慢
您最近一年使用:0次



