名校
解题方法
1 . 在人们高度重视环境和保护环境的今天,消除和利用硫氧化物、氮氧化物、碳氧化物对改善大气质量具有重要的意义。
(1)在绝热的某刚性容器中置入 和
和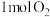 ,发生反应:
,发生反应:
 。下列说法中能够判断该反应一定处于平衡状态的有
。下列说法中能够判断该反应一定处于平衡状态的有___________ (填数字序号)。
①容器中 、
、 、
、 共存 ②单位时间内生成
共存 ②单位时间内生成 的同时消耗
的同时消耗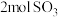
③反应容器中压强不随时间变化 ④容器中温度恒定不变
⑤容器中 、
、 、
、 的物质的量之比为2∶1∶2
的物质的量之比为2∶1∶2
(2)氮氧化物是造成光化学污染的罪魁祸首,用一氧化碳还原氮氧化物,可防止氮氧化物污染,如反应:
 =
= 。
。
①已知该反应在不同条件下的化学反应速率如下:
a.v(CO)=1.5 mol·L-1·min-1 b.v(NO)=0.03 mol·L-1·s-1
c.v(N2)=0.6 mol·L-1·min-1 d.v(CO2)=1.6 mol·L-1·min-1
上述4种情况反应速率最快的是___________ (填字母)。
②实验测得反应2CO(g)+2NO(g) 2CO2(g)+N2 (g)
2CO2(g)+N2 (g)  =
= ,v正=k正•c2(NO)•c2(CO),v逆=k逆•c(N2)•c2(CO2)(k正、k逆为速率常数,只与温度有关)。在一定温度下达到平衡时v正 = v逆,则
,v正=k正•c2(NO)•c2(CO),v逆=k逆•c(N2)•c2(CO2)(k正、k逆为速率常数,只与温度有关)。在一定温度下达到平衡时v正 = v逆,则
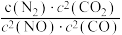 ,达到平衡后,仅升高温度,平衡向
,达到平衡后,仅升高温度,平衡向___________ 移动(填“正反应方向”“逆反应方向”或“不”)。k正增大的倍数___________ (填“>”、“<”或“=”)k逆增大的倍数。
(3)已知:
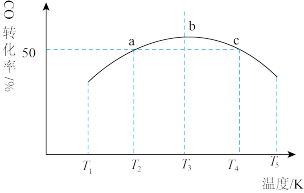
 。将1mol CO和
。将1mol CO和 充入1L恒容密闭容器中,在一定条件下发生反应,相同时间内测得CO的转化率与温度的对应关系如图所示:
充入1L恒容密闭容器中,在一定条件下发生反应,相同时间内测得CO的转化率与温度的对应关系如图所示:
①
___________ 0(填“>”或“<”)。
②由图可知,T3前反应中CO的转化率随温度升高而增大,原因是___________ 。
③已知c点时容器内的压强为p,在 温度下该反应的压强平衡常数
温度下该反应的压强平衡常数 为
为___________ (用含p的关系式表示)。( 为以分压表示的平衡常数,分压=总压×物质的量分数)
为以分压表示的平衡常数,分压=总压×物质的量分数)
(1)在绝热的某刚性容器中置入
 和
和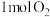 ,发生反应:
,发生反应:
 。下列说法中能够判断该反应一定处于平衡状态的有
。下列说法中能够判断该反应一定处于平衡状态的有①容器中
 、
、 、
、 共存 ②单位时间内生成
共存 ②单位时间内生成 的同时消耗
的同时消耗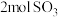
③反应容器中压强不随时间变化 ④容器中温度恒定不变
⑤容器中
 、
、 、
、 的物质的量之比为2∶1∶2
的物质的量之比为2∶1∶2(2)氮氧化物是造成光化学污染的罪魁祸首,用一氧化碳还原氮氧化物,可防止氮氧化物污染,如反应:

 =
= 。
。①已知该反应在不同条件下的化学反应速率如下:
a.v(CO)=1.5 mol·L-1·min-1 b.v(NO)=0.03 mol·L-1·s-1
c.v(N2)=0.6 mol·L-1·min-1 d.v(CO2)=1.6 mol·L-1·min-1
上述4种情况反应速率最快的是
②实验测得反应2CO(g)+2NO(g)
 2CO2(g)+N2 (g)
2CO2(g)+N2 (g)  =
= ,v正=k正•c2(NO)•c2(CO),v逆=k逆•c(N2)•c2(CO2)(k正、k逆为速率常数,只与温度有关)。在一定温度下达到平衡时v正 = v逆,则
,v正=k正•c2(NO)•c2(CO),v逆=k逆•c(N2)•c2(CO2)(k正、k逆为速率常数,只与温度有关)。在一定温度下达到平衡时v正 = v逆,则
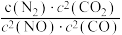 ,达到平衡后,仅升高温度,平衡向
,达到平衡后,仅升高温度,平衡向(3)已知:

 。将1mol CO和
。将1mol CO和 充入1L恒容密闭容器中,在一定条件下发生反应,相同时间内测得CO的转化率与温度的对应关系如图所示:
充入1L恒容密闭容器中,在一定条件下发生反应,相同时间内测得CO的转化率与温度的对应关系如图所示:
①

②由图可知,T3前反应中CO的转化率随温度升高而增大,原因是
③已知c点时容器内的压强为p,在
 温度下该反应的压强平衡常数
温度下该反应的压强平衡常数 为
为 为以分压表示的平衡常数,分压=总压×物质的量分数)
为以分压表示的平衡常数,分压=总压×物质的量分数)
您最近一年使用:0次
解题方法
2 . 生产生活中氨及铵盐有重要用途,而汽车尾气中含NO、NO2则应降低其排放。
(1)在20℃时,已知:①N2(g) +O2(g)=2NO(g) ,正、逆反应活化能分别为a kJ/mol、b kJ/mol;②4NH3(g) +5O2(g) =4NO(g)+6H2O(l),正、逆反应活化能分别为c kJ/mol、d kJ/mol;则4NH3(g)+6NO(g)=5N2(g)+6H2O(l)的ΔH为___________ 。
(2)10.0L的密闭容器中,按物质的量比1:3投入氮气和氢气,发生反应N2(g)+3H2(g)⇌2NH3(g) ΔH<0用传感器测得温度为T1、T2时容器中n(N2 )随时间变化如表:
①T2时,0~5 min内NH3平均速率为v(NH3)=___________
②T1时,该反应平衡常数为___________ (列出计算式);
③x___________ 0.06(填“>”“<”或“=”),原因是___________ 。
(3)汽车排气管装有三元催化剂装置,在催化剂表面通过发生吸附、解吸消除CO、NO等污染物。反应机理如下[Pt(s)表示催化剂,右上角带“*”表示吸附状态]:
I.NO+ Pt(s) =NO* II. CO+ Pt(s)=CO* III.NO*=N*+ O* IV. CO*+ O*= CO2+ Pt(s) V. N*+ N*=N2+ Pt(s) VI.NO*+ N* = N2O+ Pt(s)
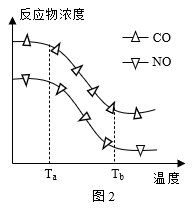
经测定汽车尾气中反应物及生成物浓度随温度变化关系如图一和图二所示:
①图一,温度为330 ℃时发生的主要反应为___________ (填“IV”、“V”或“VI”);反应VI为___________ 反应(填“放热”或“吸热”)。
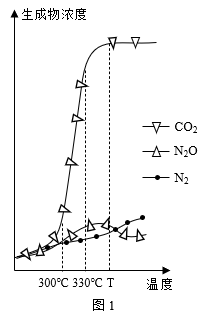
②图二,温度从Ta升至Tb的过程中,反应物浓度急剧减小的主要原因是___________ 。
③气体在固体催化剂表面反应中,吸附和解吸同时影响总反应速率。温度一定时,反应2NO+2CO N2+2CO2的反应速率随压强的变化如图所示。结合(3)中反应机理,试从吸附和解吸角度解释bc段化学反应速率下降的原因
N2+2CO2的反应速率随压强的变化如图所示。结合(3)中反应机理,试从吸附和解吸角度解释bc段化学反应速率下降的原因___________ 。

(1)在20℃时,已知:①N2(g) +O2(g)=2NO(g) ,正、逆反应活化能分别为a kJ/mol、b kJ/mol;②4NH3(g) +5O2(g) =4NO(g)+6H2O(l),正、逆反应活化能分别为c kJ/mol、d kJ/mol;则4NH3(g)+6NO(g)=5N2(g)+6H2O(l)的ΔH为
(2)10.0L的密闭容器中,按物质的量比1:3投入氮气和氢气,发生反应N2(g)+3H2(g)⇌2NH3(g) ΔH<0用传感器测得温度为T1、T2时容器中n(N2 )随时间变化如表:
| 时间 物质的量n(N2) 温度 | 0 | 5 min | 10 min | 15 min | 20 min |
| T1 | 0.1 mol | 0.08mol | 0.062mol | 0.05mol | 0.05mol |
| T2 | 0.1 mol | 0.07 mol | — | x mol | 0.06 mol |
①T2时,0~5 min内NH3平均速率为v(NH3)=
②T1时,该反应平衡常数为
③x
(3)汽车排气管装有三元催化剂装置,在催化剂表面通过发生吸附、解吸消除CO、NO等污染物。反应机理如下[Pt(s)表示催化剂,右上角带“*”表示吸附状态]:
I.NO+ Pt(s) =NO* II. CO+ Pt(s)=CO* III.NO*=N*+ O* IV. CO*+ O*= CO2+ Pt(s) V. N*+ N*=N2+ Pt(s) VI.NO*+ N* = N2O+ Pt(s)
经测定汽车尾气中反应物及生成物浓度随温度变化关系如图一和图二所示:
①图一,温度为330 ℃时发生的主要反应为

②图二,温度从Ta升至Tb的过程中,反应物浓度急剧减小的主要原因是

③气体在固体催化剂表面反应中,吸附和解吸同时影响总反应速率。温度一定时,反应2NO+2CO
 N2+2CO2的反应速率随压强的变化如图所示。结合(3)中反应机理,试从吸附和解吸角度解释bc段化学反应速率下降的原因
N2+2CO2的反应速率随压强的变化如图所示。结合(3)中反应机理,试从吸附和解吸角度解释bc段化学反应速率下降的原因
您最近一年使用:0次
3 . 氨气是一种用途广泛的化工原料。金属镓是一种广泛用于电子工业和通讯领域的重要金属,镓元素(31Ga)在元素周期表中位于第四周期IIIA族,化学性质与铝元素相似。
(1)下图是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。
已知:N2(g)+3H2(g) 2NH3(g) △H<0
2NH3(g) △H<0
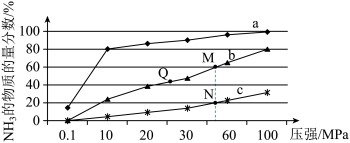
①曲线c对应的温度是_____ 。
②关于工业合成氨的反应,下列叙述正确的是_____ (填字母)。
A.及时分离出NH3可以提高H2的平衡转化率
B.根据勒夏特列原理,一般采用高温下发生反应
C.上图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N)
③工业上合成氨的催化剂为铁触媒,选择温度为500℃的原因是______ 。
(2)工业上利用Ga与NH3合成固体半导体材料氮化镓(GaN)同时有氢气生成。反应中,生成3molH2时就会放出30.8kJ的热量。
①该反应的热化学方程式是__________ 。
②该反应的化学平衡常数表达式是_____ 。
③在恒温恒容的密闭体系内进行上述可逆反应,下列有关表达正确的是_____ 。
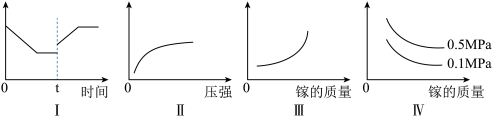
A.I图象中如果纵坐标为正反应速率,则t时刻改变的条件可以为升温
B.II图象中纵坐标可以为镓的转化率
C.III图象中纵坐标可以为化学反应速率
D.Ⅳ图象中纵坐标可以为体系内混合气体平均相对分子质量
④氮化镓(GaN)性质稳定,但能缓慢的溶解在热的NaOH溶液中,该反应的离子方程式是________ 。
(3)将一块镓铝合金完全溶于烧碱溶液中得到溶液X。已知:
往X溶液中缓缓通入CO2,最先析出的氢氧化物是_____ 。
(1)下图是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。
已知:N2(g)+3H2(g)
 2NH3(g) △H<0
2NH3(g) △H<0
①曲线c对应的温度是
②关于工业合成氨的反应,下列叙述正确的是
A.及时分离出NH3可以提高H2的平衡转化率
B.根据勒夏特列原理,一般采用高温下发生反应
C.上图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N)
③工业上合成氨的催化剂为铁触媒,选择温度为500℃的原因是
(2)工业上利用Ga与NH3合成固体半导体材料氮化镓(GaN)同时有氢气生成。反应中,生成3molH2时就会放出30.8kJ的热量。
①该反应的热化学方程式是
②该反应的化学平衡常数表达式是
③在恒温恒容的密闭体系内进行上述可逆反应,下列有关表达正确的是

A.I图象中如果纵坐标为正反应速率,则t时刻改变的条件可以为升温
B.II图象中纵坐标可以为镓的转化率
C.III图象中纵坐标可以为化学反应速率
D.Ⅳ图象中纵坐标可以为体系内混合气体平均相对分子质量
④氮化镓(GaN)性质稳定,但能缓慢的溶解在热的NaOH溶液中,该反应的离子方程式是
(3)将一块镓铝合金完全溶于烧碱溶液中得到溶液X。已知:
| Al(OH)3 | Ga(OH)3 | |
| 酸式电离常数Ka | 2×10-11 | 1×10-7 |
| 碱式电离常数Kb | 1.3×10-33 | 1.4×10-34 |
您最近一年使用:0次
名校
4 . 二氧化碳是用途非常广泛的化工基础原料,回答下列问题:
(1)工业上可以用CO2来生产燃料甲醇。已知:
CO2(g) + 3H2(g) CH3OH(l) + H2O(l) ΔH1 = -131.0 kJ·mol−1
CH3OH(l) + H2O(l) ΔH1 = -131.0 kJ·mol−1
H2(g) + O2(g) = H2O(l) ΔH2 = -285.8 kJ·mol−1
O2(g) = H2O(l) ΔH2 = -285.8 kJ·mol−1
则CH3OH的燃烧热ΔH =________________ 。
(2)在催化剂作用下,CO2和CH4可以直接转化为乙酸:CO2(g) + CH4(g) CH3COOH(g) ΔH = +36.0 kJ·mol−1
CH3COOH(g) ΔH = +36.0 kJ·mol−1
欲使乙酸的平衡产率提高,应采取的措施是__________ (填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强
(3)高温下,CO2与足量的碳在密闭容器中实现反应:C(s) + CO2(g) 2CO(g)。
2CO(g)。
① 该反应的平衡常数表达式K =_____________ 。
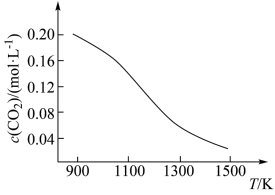
② 向容积为1 L的恒容容器中加入足量的碳和0.2 mol CO2,在不同温度下达到平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示。则该反应为__________ (填“放热”或“吸热”)反应。某温度下,若向该平衡体系中再通入0.2 mol CO2,达到新平衡后,体系中CO的百分含量______________ (填“变大”或“变小”或“不变”,下同),平衡常数__________ 。
(1)工业上可以用CO2来生产燃料甲醇。已知:
CO2(g) + 3H2(g)
 CH3OH(l) + H2O(l) ΔH1 = -131.0 kJ·mol−1
CH3OH(l) + H2O(l) ΔH1 = -131.0 kJ·mol−1H2(g) +
 O2(g) = H2O(l) ΔH2 = -285.8 kJ·mol−1
O2(g) = H2O(l) ΔH2 = -285.8 kJ·mol−1则CH3OH的燃烧热ΔH =
(2)在催化剂作用下,CO2和CH4可以直接转化为乙酸:CO2(g) + CH4(g)
 CH3COOH(g) ΔH = +36.0 kJ·mol−1
CH3COOH(g) ΔH = +36.0 kJ·mol−1欲使乙酸的平衡产率提高,应采取的措施是
A.升高温度 B.降低温度 C.增大压强 D.降低压强
(3)高温下,CO2与足量的碳在密闭容器中实现反应:C(s) + CO2(g)
 2CO(g)。
2CO(g)。① 该反应的平衡常数表达式K =
② 向容积为1 L的恒容容器中加入足量的碳和0.2 mol CO2,在不同温度下达到平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示。则该反应为

您最近一年使用:0次
解题方法
5 . 甲醇在工业中有广阔的用途
已知:①2CH3OH(l)+2O2(g)=2CO(g)+4H2O(l) △H=-a kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) △H=-b kJ·mol-1
(1)反应2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(1)的△H=___________ 。
(2)CH3OH不充分燃烧时,生成C、CO和CO2以及气态水,将所有的产物通入一个10L的密闭容器中,在一定条件下发生可逆反应:
CO(g)+ H2O(g) CO2(g)+H2(g) △H>0
CO2(g)+H2(g) △H>0
①有利于提高CO平衡转化率的条件是___________ 。(填正确答案标号)
A.高温 B.低温 C.低压 D.高压
②下列事实能说明该反应达到平衡的是___________ 。(填正确答案标号)
A.体系中的颜色不发生变化 B. v正(CO)/v逆(H2)=1
C.c(CO)/c(H2)=1 D.CO2的浓度不再发生变化
③向该密闭容器中充入2 mol CO,4.8molH2O。在200℃下,20分钟后达到平衡,测得CO的转化率为60%,v(CO2)=___________ ;该温度下的平衡常数是___________ 。
(3)在加热条件下用甲醇气相法制备CO和H2时,常采用加NiO作催化剂。发生2CH3OH(l) 2CO(g)+4H2(g) △H>0,日产量与温度的关系如图所示。
2CO(g)+4H2(g) △H>0,日产量与温度的关系如图所示。

①保证较高日产量的适宜温度是______________ ;
②310℃以后日产量下降的原因可能是___________ 。
(4)21世纪甲醇燃料电池是最佳动力源之一。甲醇空气电池成为了车载电池,该燃料电池工作时的电池反应:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(1)。原理如图

①c处应通入_________________________________ ;
②该电池的负极反应式为_________________________________ 。
已知:①2CH3OH(l)+2O2(g)=2CO(g)+4H2O(l) △H=-a kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) △H=-b kJ·mol-1
(1)反应2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(1)的△H=
(2)CH3OH不充分燃烧时,生成C、CO和CO2以及气态水,将所有的产物通入一个10L的密闭容器中,在一定条件下发生可逆反应:
CO(g)+ H2O(g)
 CO2(g)+H2(g) △H>0
CO2(g)+H2(g) △H>0①有利于提高CO平衡转化率的条件是
A.高温 B.低温 C.低压 D.高压
②下列事实能说明该反应达到平衡的是
A.体系中的颜色不发生变化 B. v正(CO)/v逆(H2)=1
C.c(CO)/c(H2)=1 D.CO2的浓度不再发生变化
③向该密闭容器中充入2 mol CO,4.8molH2O。在200℃下,20分钟后达到平衡,测得CO的转化率为60%,v(CO2)=
(3)在加热条件下用甲醇气相法制备CO和H2时,常采用加NiO作催化剂。发生2CH3OH(l)
 2CO(g)+4H2(g) △H>0,日产量与温度的关系如图所示。
2CO(g)+4H2(g) △H>0,日产量与温度的关系如图所示。
①保证较高日产量的适宜温度是
②310℃以后日产量下降的原因可能是
(4)21世纪甲醇燃料电池是最佳动力源之一。甲醇空气电池成为了车载电池,该燃料电池工作时的电池反应:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(1)。原理如图

①c处应通入
②该电池的负极反应式为
您最近一年使用:0次
6 . 二氧化碳是用途非常广泛的化工基础原料,回答下列问题:
(1)工业上可以用CO2来生产燃料甲醇。
已知;:CO2(g)+3H2(g) CH3OH(l)+H2O(l) △H=-131.0kJ/mol;
CH3OH(l)+H2O(l) △H=-131.0kJ/mol;
H2(g)+ O2(g)= H2O(l) △H=-285.8 kJ/mol。
O2(g)= H2O(l) △H=-285.8 kJ/mol。
CH3OH的燃烧热△H=_______ 。
(2)在催化剂作用下,CO2和CH4可以直接转化为乙酸:CO2(g)+CH4(g) CH3COOH(g) △H=+36.0kJ/mol。在不同温度下乙酸的生成速率变化如右图所示。
CH3COOH(g) △H=+36.0kJ/mol。在不同温度下乙酸的生成速率变化如右图所示。
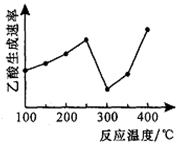
①当温度在250℃~300℃范围时,乙酸的生成速率减慢的主要原因是______ ;当温度在300℃~400℃范围时,影响乙酸生成速率的主要因素是________ 。
②欲使乙酸的平衡产率提高,应采取的措施是________ (填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强
(3)高温下,CO2与足量的碳在密闭容器中实现反应:C(s)+CO2(g) 2CO(g)。
2CO(g)。
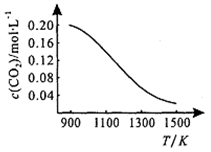
①向容积为1L的恒容容器中加入0.2mol CO2,在不同温度下达到平衡时CO2的物质的量浓度c(CO2)随温度的变化如右图所示,则该反应为_____ (填“放热”或“吸热”)反应。某温度下,若向该平衡体系中再通入0.2mol CO2,平衡____ (填“正向”、“逆向”或“不”)移动,达到新平衡后,体系中CO的百分含量________ (填“变大”、“变小”或“不变”)。
②向压强为p,体积可变的恒压容器中充入一定量CO2,650℃时反应达平衡,CO的体积分数为40.0%,则CO2的转化率为_________ 。气体分压(p分)=气体总压(p总)×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数(记作Kp),此温度下,该反应的化学平衡常数Kp=_________ (用含p的代数式表示),若向平衡体系中再充入V(CO2): V(CO)=5:4的混合气体,平衡______ (填“正向”、“逆向”或“不”)移动。
(1)工业上可以用CO2来生产燃料甲醇。
已知;:CO2(g)+3H2(g)
 CH3OH(l)+H2O(l) △H=-131.0kJ/mol;
CH3OH(l)+H2O(l) △H=-131.0kJ/mol;H2(g)+
 O2(g)= H2O(l) △H=-285.8 kJ/mol。
O2(g)= H2O(l) △H=-285.8 kJ/mol。CH3OH的燃烧热△H=
(2)在催化剂作用下,CO2和CH4可以直接转化为乙酸:CO2(g)+CH4(g)
 CH3COOH(g) △H=+36.0kJ/mol。在不同温度下乙酸的生成速率变化如右图所示。
CH3COOH(g) △H=+36.0kJ/mol。在不同温度下乙酸的生成速率变化如右图所示。
①当温度在250℃~300℃范围时,乙酸的生成速率减慢的主要原因是
②欲使乙酸的平衡产率提高,应采取的措施是
A.升高温度 B.降低温度 C.增大压强 D.降低压强
(3)高温下,CO2与足量的碳在密闭容器中实现反应:C(s)+CO2(g)
 2CO(g)。
2CO(g)。①向容积为1L的恒容容器中加入0.2mol CO2,在不同温度下达到平衡时CO2的物质的量浓度c(CO2)随温度的变化如右图所示,则该反应为

②向压强为p,体积可变的恒压容器中充入一定量CO2,650℃时反应达平衡,CO的体积分数为40.0%,则CO2的转化率为
您最近一年使用:0次
2017-11-03更新
|
795次组卷
|
4卷引用:四川省绵阳市2018届高三第一次诊断性考试理综化学试题
四川省绵阳市2018届高三第一次诊断性考试理综化学试题四川省邻水实验学校2017-2018学年高二上学期第三次月考化学试题(已下线)黄金30题系列 高三化学 大题易丢分(已下线)第02章 化学反应速率与化学平衡(B卷能力提高篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)
名校
解题方法
7 . 碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2。该反应的还原产物为______ 。
(2)已知反应2HI(g) H2(g)+I2(g)的△H = +11 kJ·mol-1,l molH2(g)、1 mol I2(g)分子中化学键断裂时分别需要吸收436 kJ、151 kJ的能量,则1 mol HI(s)分子中化学键断裂时需吸收的能量为
H2(g)+I2(g)的△H = +11 kJ·mol-1,l molH2(g)、1 mol I2(g)分子中化学键断裂时分别需要吸收436 kJ、151 kJ的能量,则1 mol HI(s)分子中化学键断裂时需吸收的能量为______ kJ。
(3)Bodensteins研究了下列反应:2HI(g) H2(g)+I2(g)。在716 K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
H2(g)+I2(g)。在716 K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
①根据上述实验结果,该反应的平衡常数K的计算式为__________________ 。
②上述反应中,正反应速率为 正=k正x2(HI),逆反应速率为
正=k正x2(HI),逆反应速率为 逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为
逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为____________________ (以K和k正表示)。若k正=0.0027 min-1,在t = 40 min时, 正 =
正 = _______________ min-1。
③由上述实验数据计算得到 正~x(HI)和
正~x(HI)和 逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为
逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为______________ (填字母)。

(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2。该反应的还原产物为
(2)已知反应2HI(g)
 H2(g)+I2(g)的△H = +11 kJ·mol-1,l molH2(g)、1 mol I2(g)分子中化学键断裂时分别需要吸收436 kJ、151 kJ的能量,则1 mol HI(s)分子中化学键断裂时需吸收的能量为
H2(g)+I2(g)的△H = +11 kJ·mol-1,l molH2(g)、1 mol I2(g)分子中化学键断裂时分别需要吸收436 kJ、151 kJ的能量,则1 mol HI(s)分子中化学键断裂时需吸收的能量为(3)Bodensteins研究了下列反应:2HI(g)
 H2(g)+I2(g)。在716 K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
H2(g)+I2(g)。在716 K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为
②上述反应中,正反应速率为
 正=k正x2(HI),逆反应速率为
正=k正x2(HI),逆反应速率为 逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为
逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为 正 =
正 = ③由上述实验数据计算得到
 正~x(HI)和
正~x(HI)和 逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为
逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为
您最近一年使用:0次
2017-02-17更新
|
342次组卷
|
4卷引用:2016-2017学年四川省成都七中高二上11月考试化学卷
14-15高二上·北京·期中
名校
8 . 金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:
WO3 (s) + 3H2 (g) W (s) + 3H2O (g)。请回答下列问题:
W (s) + 3H2O (g)。请回答下列问题:
(1)上述反应的化学平衡常数表达式为____________________ 。
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为___________ ;随温度的升高,H2与水蒸气的体积比减小,则该反应为______ 反应(填“吸热”或“放热”)。
(3)用H2还原WO2也可得到金属钨。已知:
WO2 (s) + 2H2 (g) W (s) + 2H2O (g) ΔH =+66.0 kJ·mol–1
W (s) + 2H2O (g) ΔH =+66.0 kJ·mol–1
WO2 (g) + 2H2 (g) W (s) + 2H2O (g) ΔH =-137.9 kJ·mol–1
W (s) + 2H2O (g) ΔH =-137.9 kJ·mol–1
则WO2 (s) WO2 (g) 的ΔH =
WO2 (g) 的ΔH = ______________________ 。
(4)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W (s) +2I2 (g) WI4 (g)。下列说法正确的有
WI4 (g)。下列说法正确的有________ (填序号)。
a.灯管内的I2可循环使用
b.WI4在灯丝上分解,产生的W又沉积在灯丝上
c.WI4在灯管壁上分解,使灯管的寿命延长
d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
WO3 (s) + 3H2 (g)
 W (s) + 3H2O (g)。请回答下列问题:
W (s) + 3H2O (g)。请回答下列问题:(1)上述反应的化学平衡常数表达式为
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为
(3)用H2还原WO2也可得到金属钨。已知:
WO2 (s) + 2H2 (g)
 W (s) + 2H2O (g) ΔH =+66.0 kJ·mol–1
W (s) + 2H2O (g) ΔH =+66.0 kJ·mol–1WO2 (g) + 2H2 (g)
 W (s) + 2H2O (g) ΔH =-137.9 kJ·mol–1
W (s) + 2H2O (g) ΔH =-137.9 kJ·mol–1则WO2 (s)
 WO2 (g) 的ΔH =
WO2 (g) 的ΔH = (4)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W (s) +2I2 (g)
 WI4 (g)。下列说法正确的有
WI4 (g)。下列说法正确的有a.灯管内的I2可循环使用
b.WI4在灯丝上分解,产生的W又沉积在灯丝上
c.WI4在灯管壁上分解,使灯管的寿命延长
d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
您最近一年使用:0次
2016-12-09更新
|
1425次组卷
|
4卷引用:四川省什邡中学2017-2018学年高二春秋招班第三次月考化学试题
四川省什邡中学2017-2018学年高二春秋招班第三次月考化学试题(已下线)2013-2014北京四中高二上学期期中考试化学试卷2015-2016学年吉林长春第十一中高一下期末考化学新疆伊犁州霍城县江苏中学2023-2024学年高二上学期9月月考化学试卷



