解题方法
1 . 回答下列问题:
(1)合成气(CO、H2)是一种重要的化工原料,在化工生产中具有十分广泛的用途。工业上用CO和H2合成CH3OH: △H。则该反应的平衡常数表达式为
△H。则该反应的平衡常数表达式为_______ ;
(2)测得不同温度下反应的平衡常数 如下表:
如下表:
下列说法错误的是_______。
(3)工业上,利用水煤气法制取合成气,其中发生的一步反应为:CO(g)+H2O(g) CO2(g)+H2(g) △H=-41.2kJ·mol-1。已知
CO2(g)+H2(g) △H=-41.2kJ·mol-1。已知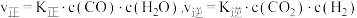 (k正、k逆为化学反应速率常数,只与温度有关,与浓度、压强无关)。830℃时,体积为2L的恒容密闭容器中,投入2molCO(g)和2molH2O(g)。5min达到平衡,测得H2的平均生成速率为0.1mol∙L-1∙min-1,则反应达到平衡后,速率常数
(k正、k逆为化学反应速率常数,只与温度有关,与浓度、压强无关)。830℃时,体积为2L的恒容密闭容器中,投入2molCO(g)和2molH2O(g)。5min达到平衡,测得H2的平均生成速率为0.1mol∙L-1∙min-1,则反应达到平衡后,速率常数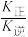 =
=_______ 。
(4)以天然气为原料生产合成气也有多种方法,其中Sparg工艺的原理为CH4(g)+CO2(g) 2CO(g)+2H2(g) △H1。T℃下,向容积可变的密闭容器中充入一定量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如表所示:
2CO(g)+2H2(g) △H1。T℃下,向容积可变的密闭容器中充入一定量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如表所示:
①T℃下,该反应的平衡常数K=_______ 。
②实验1中,CO的平衡体积分数为_______ %(保留三位有效数字)。
③V1:V2=_______ 。
(1)合成气(CO、H2)是一种重要的化工原料,在化工生产中具有十分广泛的用途。工业上用CO和H2合成CH3OH:
 △H。则该反应的平衡常数表达式为
△H。则该反应的平衡常数表达式为(2)测得不同温度下反应的平衡常数
 如下表:
如下表:| 温度/℃ | T1 | 100 | T2 | 200 | 300 |
| 平衡常数K | 100 | 13 | 1 | 1.9×10-2 | 2.4×10-4 |
| A.△H<0 |
| B.该反应的ΔS<0 |
| C.T2时,某时刻1L容器中含0.1mol CO、0.2mol H2和0.3mol CH3OH,此时v正>v逆 |
| D.T1时,向1L密闭容器中投入0.1mol CO和0.2mol H2,平衡时CO转化率为50% |
 CO2(g)+H2(g) △H=-41.2kJ·mol-1。已知
CO2(g)+H2(g) △H=-41.2kJ·mol-1。已知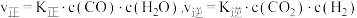 (k正、k逆为化学反应速率常数,只与温度有关,与浓度、压强无关)。830℃时,体积为2L的恒容密闭容器中,投入2molCO(g)和2molH2O(g)。5min达到平衡,测得H2的平均生成速率为0.1mol∙L-1∙min-1,则反应达到平衡后,速率常数
(k正、k逆为化学反应速率常数,只与温度有关,与浓度、压强无关)。830℃时,体积为2L的恒容密闭容器中,投入2molCO(g)和2molH2O(g)。5min达到平衡,测得H2的平均生成速率为0.1mol∙L-1∙min-1,则反应达到平衡后,速率常数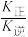 =
=(4)以天然气为原料生产合成气也有多种方法,其中Sparg工艺的原理为CH4(g)+CO2(g)
 2CO(g)+2H2(g) △H1。T℃下,向容积可变的密闭容器中充入一定量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如表所示:
2CO(g)+2H2(g) △H1。T℃下,向容积可变的密闭容器中充入一定量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如表所示:| 实验编号 | 容器体积 | 物质浓度/mol·L-1 | ||
| CH4 | CO2 | CO | ||
| 1 | V1 | 0.02 | 0.02 | 0.10 |
| 2 | V2 | x | x | 0.05 |
②实验1中,CO的平衡体积分数为
③V1:V2=
您最近一年使用:0次
解题方法
2 . 氮气是制备含氮化合物的重要原料,而含氮化合物的用途广泛。回答下列问题:
(1)两个常见的固氮反应为:
N2(g)+O2(g) 2NO(g)…………(Ⅰ)
2NO(g)…………(Ⅰ)
N2(g)+3H2(g) 2NH3(g)…………(Ⅱ)
2NH3(g)…………(Ⅱ)
①气相反应中,某物质A 的组成习惯用分压p(A)代替浓度c(A),相应的平衡常数用Kp表示。反应(Ⅰ)的平衡常数表达式Kp=_________________ 。
②反应(Ⅱ)在不同温度下的平衡常数Kp如下表:
则反应(Ⅱ) 的ΔH________ 0(填“>”、“<”或“=”)
(2)合成氨工业中原料气所含的少量CO对合成塔中的催化剂有害,可由“铜洗”工序实现对原料气精制。有关反应的化学方程式如下:
[Cu(NH3)2]Ac(aq)+CO(g) +NH3(g) [Cu(NH3)3] ]Ac·CO(aq)
[Cu(NH3)3] ]Ac·CO(aq)
ΔH=-35 kJ·mol-1,用化学平衡移动原理分析该工序生产的适宜条件为________________________ 。
(3)氨气是工业制硝酸的主要原料。T℃时,NH3和O2可能发生如下反应:
①4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H= -907kJ•mol-1
4NO(g)+6H2O(g) △H= -907kJ•mol-1
②4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H= -1269kJ•mol-1
2N2(g)+6H2O(g) △H= -1269kJ•mol-1
其中②是副反应。若要减少副反应,提高NO的产率,最合理的措施是___________________ ;
T℃时N2和O2反应生成NO的热化学方程式为________________________________ 。
(4)生产和实验中常采用甲醛法测定铵盐的含氢量。反应原理如下:
4NH4++6HCHO==(CH2)6N4H+(一元酸)+3H++6H2O
实验步骤如下:
①取铵盐样品溶液a mL,加入稍过量的甲醛溶液(已除去其中的酸),静置1分钟;
②滴入1-2滴酚酞溶液,用cmol·L-1的氢氧化钠溶液滴定至溶液呈粉红色且半分钟内不褪去为止,记录消耗氢氧化钠溶液的体积;
③重复以上操作2 次,三次实验平均消耗氢氧化钠溶液VmL。
则样品中的含氮量为____ mg·L-1;下列铵盐不适合用甲醛法测定含氮量的是____________ (填标号)。
a.NH4HCO3 b. (NH4)2SO4 c.NH4Cl d.CH3COONH4
(1)两个常见的固氮反应为:
N2(g)+O2(g)
 2NO(g)…………(Ⅰ)
2NO(g)…………(Ⅰ)N2(g)+3H2(g)
 2NH3(g)…………(Ⅱ)
2NH3(g)…………(Ⅱ)①气相反应中,某物质A 的组成习惯用分压p(A)代替浓度c(A),相应的平衡常数用Kp表示。反应(Ⅰ)的平衡常数表达式Kp=
②反应(Ⅱ)在不同温度下的平衡常数Kp如下表:
| 温度/K | 298 | 473 | 673 |
| Kp | 62(KPa)-2 | 6.2×10-5(KPa)-2 | 6.0×10-8(KPa)-2 |
则反应(Ⅱ) 的ΔH
(2)合成氨工业中原料气所含的少量CO对合成塔中的催化剂有害,可由“铜洗”工序实现对原料气精制。有关反应的化学方程式如下:
[Cu(NH3)2]Ac(aq)+CO(g) +NH3(g)
 [Cu(NH3)3] ]Ac·CO(aq)
[Cu(NH3)3] ]Ac·CO(aq)ΔH=-35 kJ·mol-1,用化学平衡移动原理分析该工序生产的适宜条件为
(3)氨气是工业制硝酸的主要原料。T℃时,NH3和O2可能发生如下反应:
①4NH3(g)+5O2(g)
 4NO(g)+6H2O(g) △H= -907kJ•mol-1
4NO(g)+6H2O(g) △H= -907kJ•mol-1 ②4NH3(g)+3O2(g)
 2N2(g)+6H2O(g) △H= -1269kJ•mol-1
2N2(g)+6H2O(g) △H= -1269kJ•mol-1其中②是副反应。若要减少副反应,提高NO的产率,最合理的措施是
T℃时N2和O2反应生成NO的热化学方程式为
(4)生产和实验中常采用甲醛法测定铵盐的含氢量。反应原理如下:
4NH4++6HCHO==(CH2)6N4H+(一元酸)+3H++6H2O
实验步骤如下:
①取铵盐样品溶液a mL,加入稍过量的甲醛溶液(已除去其中的酸),静置1分钟;
②滴入1-2滴酚酞溶液,用cmol·L-1的氢氧化钠溶液滴定至溶液呈粉红色且半分钟内不褪去为止,记录消耗氢氧化钠溶液的体积;
③重复以上操作2 次,三次实验平均消耗氢氧化钠溶液VmL。
则样品中的含氮量为
a.NH4HCO3 b. (NH4)2SO4 c.NH4Cl d.CH3COONH4
您最近一年使用:0次
11-12高三上·福建龙岩·期末
解题方法
3 . 部分短周期元素的原子半径及常见化合价如下表:
根据要求回答问题(如需填化学用语的,请用各元素的元素符号表示)
(1)X元素在元素周期表的位置是______________ 。
(2)R的气态氢化物比X的气态氢化物_______ (填稳定或不稳定)。
(3)写出M的单质与ZT2反应的化学方程式____________________________ 。
(4)Q的最高价氧化物在现代通信的重要用途是______________ 。
(5)已知XO2在500℃,1大气压下被氧气氧化,每生成1 mol气态XO3,放出98.3 kJ热量,该反应的热化学方程式是____________________________ 。
(6)工业上用Z的单质与水蒸气反应制水煤气,则该反应的平衡常数表达式K=_____ 。
| 元素代号 | Z | M | Q | R | T | X |
| 原子半径/nm | 0.077 | 0.130 | 0.111 | 0.099 | 0.073 | 0.102 |
| 常见化合价 | +4,-4 | +2 | +4,-4 | -1,+7 | -2 | +6,-2 |
(1)X元素在元素周期表的位置是
(2)R的气态氢化物比X的气态氢化物
(3)写出M的单质与ZT2反应的化学方程式
(4)Q的最高价氧化物在现代通信的重要用途是
(5)已知XO2在500℃,1大气压下被氧气氧化,每生成1 mol气态XO3,放出98.3 kJ热量,该反应的热化学方程式是
(6)工业上用Z的单质与水蒸气反应制水煤气,则该反应的平衡常数表达式K=
您最近一年使用:0次



