解题方法
1 . 化学与资源回收、生命活动息息相关。
I.废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是_______(填标号)。
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知常温常压下:
①2Cu(s)+O2(g)=2CuO(s) ΔH1=-157.00kJ·mol-1
②CuO(s)+2H+(aq)=Cu2+(aq)+H2O(l) ΔH2=-142.95kJ·mol-1
③2H2O2(aq)=2H2O(l)+O2(g) ΔH3=-196.46kJ·mol-1
则在H2SO4(aq)溶液中Cu(s)与H2O2(aq)反应生成Cu2+(aq)和H2O(l)的热化学方程式为_______ 。
(3)控制其他条件不变,废旧印刷电路板的金属粉末用10%H2O2和3.0mol·L-1H2SO4溶液处理,测得不同温度下铜离子的平均生成速率v如下表所示。
当温度高于40°C时,铜离子的平均生成速率随着反应温度的升高而下降,其主要原因是_______ 。所得的CuSO4溶液的一种用途是_______ 。
II.水体中的有毒无机污染物主要是汞、铜、铅等重金属和砷的化合物,它们对人类及生态系统产生直接或积累性损害,当人体中因Pb2+聚集较多而发生中毒时,常采用CaY2-来治疗(分析化学中用H4Y表示EDTA,EDTA是乙二胺四乙酸的简称,Y4-表示其酸根离子)。这时人体中就存在下列平衡:M2++Y4- MY2-(I式),式中M=Ca或Pb。
MY2-(I式),式中M=Ca或Pb。
(4)请写出该反应的平衡常数表达式K=_______ ,K值越大,表明Y4-和金属离子生成的配离子的稳定性越_______ (填“强”或“弱”)。
(5)已知:常温下I式的平衡常数 =1.1×1018,
=1.1×1018, =4.9×1010。上述治疗方法可看作是一个离子交换反应:Pb2++CaY2-
=4.9×1010。上述治疗方法可看作是一个离子交换反应:Pb2++CaY2- Ca2++PbY2-。则K交换和
Ca2++PbY2-。则K交换和 、
、 之间的关系为K交换=
之间的关系为K交换=_______ ,代入数据计算可知K交换=_______ (计算结果保留两位有效数字)。
I.废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是_______(填标号)。
| A.转化为气态清洁燃料 | B.露天焚烧 |
| C.作为有机复合建筑材料的原料 | D.直接填埋 |
①2Cu(s)+O2(g)=2CuO(s) ΔH1=-157.00kJ·mol-1
②CuO(s)+2H+(aq)=Cu2+(aq)+H2O(l) ΔH2=-142.95kJ·mol-1
③2H2O2(aq)=2H2O(l)+O2(g) ΔH3=-196.46kJ·mol-1
则在H2SO4(aq)溶液中Cu(s)与H2O2(aq)反应生成Cu2+(aq)和H2O(l)的热化学方程式为
(3)控制其他条件不变,废旧印刷电路板的金属粉末用10%H2O2和3.0mol·L-1H2SO4溶液处理,测得不同温度下铜离子的平均生成速率v如下表所示。
| 温度(°C) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| v(mol·L-1·min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
当温度高于40°C时,铜离子的平均生成速率随着反应温度的升高而下降,其主要原因是
II.水体中的有毒无机污染物主要是汞、铜、铅等重金属和砷的化合物,它们对人类及生态系统产生直接或积累性损害,当人体中因Pb2+聚集较多而发生中毒时,常采用CaY2-来治疗(分析化学中用H4Y表示EDTA,EDTA是乙二胺四乙酸的简称,Y4-表示其酸根离子)。这时人体中就存在下列平衡:M2++Y4-
 MY2-(I式),式中M=Ca或Pb。
MY2-(I式),式中M=Ca或Pb。(4)请写出该反应的平衡常数表达式K=
(5)已知:常温下I式的平衡常数
 =1.1×1018,
=1.1×1018, =4.9×1010。上述治疗方法可看作是一个离子交换反应:Pb2++CaY2-
=4.9×1010。上述治疗方法可看作是一个离子交换反应:Pb2++CaY2- Ca2++PbY2-。则K交换和
Ca2++PbY2-。则K交换和 、
、 之间的关系为K交换=
之间的关系为K交换=
您最近一年使用:0次
名校
2 .  、
、 是大气污染物但又有着重要用途。
是大气污染物但又有着重要用途。
Ⅰ.已知: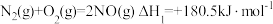
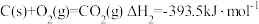
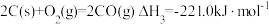
(1)某反应的平衡常数表达式为 ,此反应的热化学方程式为:
,此反应的热化学方程式为:___________ 。
(2)向绝热恒容密闭容器中充入等量的 和
和 进行反应,能判断反应已达到化学平衡状态的是
进行反应,能判断反应已达到化学平衡状态的是___________ (填序号)。
a.容器中的压强不变b.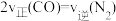
c.气体的平均相对分子质量保持34.2不变d.该反应平衡常数保持不变
e. 和
和 的体积比保持不变
的体积比保持不变
Ⅱ. 可用于制。为探究某浓度的的化学性质,某同学设计如下实验流程:
可用于制。为探究某浓度的的化学性质,某同学设计如下实验流程:

(3)用离子方程式表示 溶液具有碱性的原因
溶液具有碱性的原因___________ 。 与氯水反应的离子方程式是
与氯水反应的离子方程式是___________ 。
(4)含 的烟气可用
的烟气可用 溶液吸收。可将吸收液送至电解槽再生后循环使用。再生电解槽如图所示。a电极上含硫微粒放电的反应式为
溶液吸收。可将吸收液送至电解槽再生后循环使用。再生电解槽如图所示。a电极上含硫微粒放电的反应式为___________ 。(任写一个)。离子交换膜___________ (填标号)为阴离子交换膜。
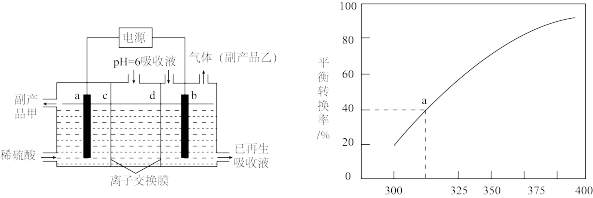
(5)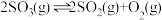 ,将一定量的
,将一定量的 放入恒容的密闭容器中,测得其平衡转化率随温度变化如图所示。图中a点对应温度下,已知
放入恒容的密闭容器中,测得其平衡转化率随温度变化如图所示。图中a点对应温度下,已知 的起始压强为
的起始压强为 ,该温度下反应的平衡常数
,该温度下反应的平衡常数
___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
 、
、 是大气污染物但又有着重要用途。
是大气污染物但又有着重要用途。Ⅰ.已知:
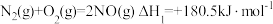
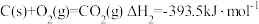
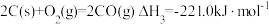
(1)某反应的平衡常数表达式为
 ,此反应的热化学方程式为:
,此反应的热化学方程式为:(2)向绝热恒容密闭容器中充入等量的
 和
和 进行反应,能判断反应已达到化学平衡状态的是
进行反应,能判断反应已达到化学平衡状态的是a.容器中的压强不变b.
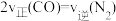
c.气体的平均相对分子质量保持34.2不变d.该反应平衡常数保持不变
e.
 和
和 的体积比保持不变
的体积比保持不变Ⅱ.
 可用于制。为探究某浓度的的化学性质,某同学设计如下实验流程:
可用于制。为探究某浓度的的化学性质,某同学设计如下实验流程:
(3)用离子方程式表示
 溶液具有碱性的原因
溶液具有碱性的原因 与氯水反应的离子方程式是
与氯水反应的离子方程式是(4)含
 的烟气可用
的烟气可用 溶液吸收。可将吸收液送至电解槽再生后循环使用。再生电解槽如图所示。a电极上含硫微粒放电的反应式为
溶液吸收。可将吸收液送至电解槽再生后循环使用。再生电解槽如图所示。a电极上含硫微粒放电的反应式为
(5)
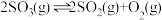 ,将一定量的
,将一定量的 放入恒容的密闭容器中,测得其平衡转化率随温度变化如图所示。图中a点对应温度下,已知
放入恒容的密闭容器中,测得其平衡转化率随温度变化如图所示。图中a点对应温度下,已知 的起始压强为
的起始压强为 ,该温度下反应的平衡常数
,该温度下反应的平衡常数
您最近一年使用:0次
2022-04-04更新
|
172次组卷
|
4卷引用:河北省保定市蠡县中学2023-2024学年高二上学期化学月考试题
解题方法
3 . 纳米级Fe3O4呈黑色,因其有磁性且粒度小而在磁记录材料、生物功能材料等诸多领域有重要应用,探究其制备和用途意义重大。
(1)还原-沉淀法:①用还原剂Na2SO3将一定量Fe3+可溶盐溶液中的 Fe3+还原,使Fe2+和Fe3+的物质的量比为1 : 2。②然后在①所得体系中加入氨水,铁元素完全沉淀形成纳米Fe3O4。写出②过程的离子方程式:
Fe3+还原,使Fe2+和Fe3+的物质的量比为1 : 2。②然后在①所得体系中加入氨水,铁元素完全沉淀形成纳米Fe3O4。写出②过程的离子方程式:__________ 。
(2)电化学法也可制备纳米级Fe3O4,用面积为4 cm2的不锈钢小球(不含镍、铬)为工作电极,铂丝作阴极,用Na2SO4溶液作为电解液,电解液的pH维持在10左右,电流50 mA。生成Fe3O4的电极反应为______ 。
(3)已知:H2O(1) === H2(g)+ O2(g) △H =+285.5 kJ·mol-l,以太阳能为热源分解Fe3O4,经由热化学铁氧化合物循环分解水制H2的过程如下,完善以下过程I的热化学方程式。过程I:
O2(g) △H =+285.5 kJ·mol-l,以太阳能为热源分解Fe3O4,经由热化学铁氧化合物循环分解水制H2的过程如下,完善以下过程I的热化学方程式。过程I:__________ 。过程Ⅱ:3FeO(s)+H2O(l) === H2(g)+Fe3O4(s) △H =+128.9 kJ·mol-1
(4)磁铁矿(Fe3O4)常作冶铁的原料,主要反应为Fe3O4(s)+4CO(g) 3Fe(s)+4CO2 (g),该反应的△H < 0,T℃时,在1 L恒容密闭容器中,加入Fe3O4、CO各0.5 mol,10 min后反应达到平衡时,容器中CO2的浓度是0.4 mol·L-1。
3Fe(s)+4CO2 (g),该反应的△H < 0,T℃时,在1 L恒容密闭容器中,加入Fe3O4、CO各0.5 mol,10 min后反应达到平衡时,容器中CO2的浓度是0.4 mol·L-1。
①T℃时,10 min内用Fe3O4表示的平均反应速率为___ g·min-1。
②T℃时,该反应的平衡常数为____________ 。
(1)还原-沉淀法:①用还原剂Na2SO3将一定量Fe3+可溶盐溶液中的
 Fe3+还原,使Fe2+和Fe3+的物质的量比为1 : 2。②然后在①所得体系中加入氨水,铁元素完全沉淀形成纳米Fe3O4。写出②过程的离子方程式:
Fe3+还原,使Fe2+和Fe3+的物质的量比为1 : 2。②然后在①所得体系中加入氨水,铁元素完全沉淀形成纳米Fe3O4。写出②过程的离子方程式:(2)电化学法也可制备纳米级Fe3O4,用面积为4 cm2的不锈钢小球(不含镍、铬)为工作电极,铂丝作阴极,用Na2SO4溶液作为电解液,电解液的pH维持在10左右,电流50 mA。生成Fe3O4的电极反应为
(3)已知:H2O(1) === H2(g)+
 O2(g) △H =+285.5 kJ·mol-l,以太阳能为热源分解Fe3O4,经由热化学铁氧化合物循环分解水制H2的过程如下,完善以下过程I的热化学方程式。过程I:
O2(g) △H =+285.5 kJ·mol-l,以太阳能为热源分解Fe3O4,经由热化学铁氧化合物循环分解水制H2的过程如下,完善以下过程I的热化学方程式。过程I: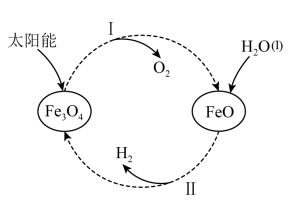
(4)磁铁矿(Fe3O4)常作冶铁的原料,主要反应为Fe3O4(s)+4CO(g)
 3Fe(s)+4CO2 (g),该反应的△H < 0,T℃时,在1 L恒容密闭容器中,加入Fe3O4、CO各0.5 mol,10 min后反应达到平衡时,容器中CO2的浓度是0.4 mol·L-1。
3Fe(s)+4CO2 (g),该反应的△H < 0,T℃时,在1 L恒容密闭容器中,加入Fe3O4、CO各0.5 mol,10 min后反应达到平衡时,容器中CO2的浓度是0.4 mol·L-1。①T℃时,10 min内用Fe3O4表示的平均反应速率为
②T℃时,该反应的平衡常数为
您最近一年使用:0次
名校
解题方法
4 . Ⅰ.硫在地壳中主要以硫化物、硫酸盐等形式存在,其单质和化合物在工农业生产中有着重要的应用。
(1)重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下;
①BaSO4(s)+4C(s)=BaS(s)+4CO(g) ΔH=+571.2 kJ·mol-1
②BaS(s)=Ba(s)+S(s)ΔH=+460 kJ·mol-1
已知:③2C(s)+O2(g)=2CO(g)ΔH=-221kJ·mol-1
则:Ba(s)+S(s)+2O2(g)=BaSO4(s) ΔH =________________ 。
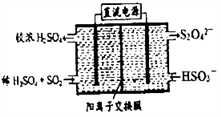
(2)利用下图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。
①阳极的电极反应式为__________________ 。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应中氧化剂与还原剂的物质的量之比为________________ 。
Ⅱ.乙炔(C2H2)在气焊、气割及有机合成中用途非常广泛,可由电石(CaC2)直接水化法或甲烷在1500℃左右气相裂解法生产。哈斯特研究得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图所示。
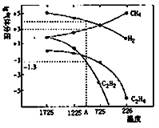
(3)T2℃时,向1L恒容密闭容器中充入0.3molCH4只发生反应2CH4(g) C2H4(g)+2H2(g) ΔH,达到平衡时,测得c(C2H4)= c(CH4)。该反应的ΔH
C2H4(g)+2H2(g) ΔH,达到平衡时,测得c(C2H4)= c(CH4)。该反应的ΔH____ 0(填“>”或“<”),CH4的平衡转化率为_________ 。上述平衡状态某一时刻,若改变温度至T℃,CH4以0.01mol/(L·s)的平均速率增多,经ts后再次达到平衡,平衡时2c(C2H4) = c(CH4),则t=________ s。
(4)计算反应2CH4(g) =C2H2(g)+3H2(g)在图中A点温度时的平衡常数K=_________ (用平衡分压代替平衡浓度计算:lg ≈-1.3)
≈-1.3)
(1)重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下;
①BaSO4(s)+4C(s)=BaS(s)+4CO(g) ΔH=+571.2 kJ·mol-1
②BaS(s)=Ba(s)+S(s)ΔH=+460 kJ·mol-1
已知:③2C(s)+O2(g)=2CO(g)ΔH=-221kJ·mol-1
则:Ba(s)+S(s)+2O2(g)=BaSO4(s) ΔH =
(2)利用下图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。
①阳极的电极反应式为
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应中氧化剂与还原剂的物质的量之比为

Ⅱ.乙炔(C2H2)在气焊、气割及有机合成中用途非常广泛,可由电石(CaC2)直接水化法或甲烷在1500℃左右气相裂解法生产。哈斯特研究得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图所示。

(3)T2℃时,向1L恒容密闭容器中充入0.3molCH4只发生反应2CH4(g)
 C2H4(g)+2H2(g) ΔH,达到平衡时,测得c(C2H4)= c(CH4)。该反应的ΔH
C2H4(g)+2H2(g) ΔH,达到平衡时,测得c(C2H4)= c(CH4)。该反应的ΔH(4)计算反应2CH4(g) =C2H2(g)+3H2(g)在图中A点温度时的平衡常数K=
 ≈-1.3)
≈-1.3)
您最近一年使用:0次
2017-10-28更新
|
427次组卷
|
2卷引用:河北省武邑中学2018届高三上学期第三次调研考试化学试题



