名校
1 .  和
和 是两种重要的温室气体,通过
是两种重要的温室气体,通过 和
和 反应制造更高价值化学品是目前的研究目标。请回答下列问题:
反应制造更高价值化学品是目前的研究目标。请回答下列问题:
Ⅰ.工业上可以利用 和
和 合成
合成 :
:
 。该反应在起始温度和体积均相同(T℃、IL)的两个密闭容器中分别进行,反应物起始物质的量如表。
。该反应在起始温度和体积均相同(T℃、IL)的两个密闭容器中分别进行,反应物起始物质的量如表。
(1)下列能说明反应a达到平衡状态的是_______。(填字母)
(2)达到平衡时,反应a,b对比: 的体积分数
的体积分数
_______  。(填“>”、“<”或“=”)
。(填“>”、“<”或“=”)
Ⅱ.我国科学家研究了不同反应温度对含碳产物组成的影响。
已知:反应1:

反应2:

在密闭容器中通入3mol的 和1mol的
和1mol的 ,分别在0.1MPa和1MPa下进行反应。实验中对平衡体系进行分析,其中温度对CO和的影响如图1所示
,分别在0.1MPa和1MPa下进行反应。实验中对平衡体系进行分析,其中温度对CO和的影响如图1所示
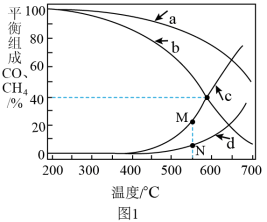
(3)1MPa时,表示 和CO平衡组成随温度变化关系的曲线分别是
和CO平衡组成随温度变化关系的曲线分别是_______ 和_______ 。M点平衡组成含量高于N点的原因是_______ 。
Ⅲ.在 时,向体积为2L的恒容容器中充入物质的量之和为3mol的CO和
时,向体积为2L的恒容容器中充入物质的量之和为3mol的CO和 ,发生反应:
,发生反应: ,反应达到平衡时
,反应达到平衡时 的体积分数(
的体积分数(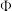 )与
)与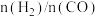 的关系如图2所示。
的关系如图2所示。

(4)当 时,达到平衡后,
时,达到平衡后, 的体积分数可能是图象中的
的体积分数可能是图象中的_______ (填“D”、“E”或“F”)点。
(5)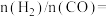
_______ 时, 的体积分数最大。
的体积分数最大。
 和
和 是两种重要的温室气体,通过
是两种重要的温室气体,通过 和
和 反应制造更高价值化学品是目前的研究目标。请回答下列问题:
反应制造更高价值化学品是目前的研究目标。请回答下列问题:Ⅰ.工业上可以利用
 和
和 合成
合成 :
:
 。该反应在起始温度和体积均相同(T℃、IL)的两个密闭容器中分别进行,反应物起始物质的量如表。
。该反应在起始温度和体积均相同(T℃、IL)的两个密闭容器中分别进行,反应物起始物质的量如表。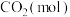 |  | 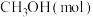 |  | |
| 反应a(恒温恒容) | 1 | 3 | 0 | 0 |
| 反应b(绝热恒容) | 0 | 0 | 1 | 1 |
A. | B.混合气体的平均摩尔质量不再改变 |
C.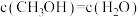 | D.容器内压强不再改变 |
 的体积分数
的体积分数
 。(填“>”、“<”或“=”)
。(填“>”、“<”或“=”) Ⅱ.我国科学家研究了不同反应温度对含碳产物组成的影响。
已知:反应1:


反应2:


在密闭容器中通入3mol的
 和1mol的
和1mol的 ,分别在0.1MPa和1MPa下进行反应。实验中对平衡体系进行分析,其中温度对CO和的影响如图1所示
,分别在0.1MPa和1MPa下进行反应。实验中对平衡体系进行分析,其中温度对CO和的影响如图1所示
(3)1MPa时,表示
 和CO平衡组成随温度变化关系的曲线分别是
和CO平衡组成随温度变化关系的曲线分别是Ⅲ.在
 时,向体积为2L的恒容容器中充入物质的量之和为3mol的CO和
时,向体积为2L的恒容容器中充入物质的量之和为3mol的CO和 ,发生反应:
,发生反应: ,反应达到平衡时
,反应达到平衡时 的体积分数(
的体积分数(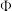 )与
)与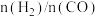 的关系如图2所示。
的关系如图2所示。
(4)当
 时,达到平衡后,
时,达到平衡后, 的体积分数可能是图象中的
的体积分数可能是图象中的(5)
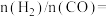
 的体积分数最大。
的体积分数最大。
您最近一年使用:0次
解题方法
2 . CO2、CO、H2催化合成醇可减排温室气体并合成可再生燃料,是新能源领域的研究前沿。已知CO2与H2混合后一定条件下可发生下列两个可逆反应:
I、CO2(g)+3H2(g) = CH3OH(g)+H2O(g) ΔH1=-49.0 kJ·mol−1
II、CO2(g)+H2(g) = CO(g)+H2O(g) ΔH2= 41.1 kJ·mol−1
(1)H2还原CO反应合成甲醇的热化学方程式为:CO(g)+2H2(g) = CH3OH(g) ΔH,则ΔH=_______ kJ·mol−1。
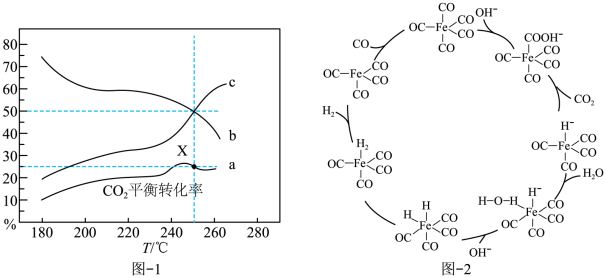
(2)1 mol CO2和3 mol H2混和气体在一定条件下反应,测得CO2平衡转化率、平衡时含碳产物中CH3OH和CO的物质的量分数随温度变化如图-1所示
①图中平衡时产物中CO的百分含量对应的曲线是_______ (填“b”或“c”),理由为_______ 。
②图中X点时,CO2的平衡转化率为25%,则此时混合体系中n(CH3OH)∶n(CO)∶n(CO2)=_______ ;H2的转化率为_______ %(保留三位有效数字)。
(3)CO和H2O可以在Fe(CO)5催化作用下发生反应II,其反应机理如图-2所示。OH-在此反应中的作用是_______ ;若参与反应的为C18O,则生成的二氧化碳成分为_______ (填“只有CO18O”或“只有CO2” 或“CO18O和CO2”)
I、CO2(g)+3H2(g) = CH3OH(g)+H2O(g) ΔH1=-49.0 kJ·mol−1
II、CO2(g)+H2(g) = CO(g)+H2O(g) ΔH2= 41.1 kJ·mol−1
(1)H2还原CO反应合成甲醇的热化学方程式为:CO(g)+2H2(g) = CH3OH(g) ΔH,则ΔH=
(2)1 mol CO2和3 mol H2混和气体在一定条件下反应,测得CO2平衡转化率、平衡时含碳产物中CH3OH和CO的物质的量分数随温度变化如图-1所示
①图中平衡时产物中CO的百分含量对应的曲线是
②图中X点时,CO2的平衡转化率为25%,则此时混合体系中n(CH3OH)∶n(CO)∶n(CO2)=

(3)CO和H2O可以在Fe(CO)5催化作用下发生反应II,其反应机理如图-2所示。OH-在此反应中的作用是
您最近一年使用:0次



