 和
和 是两种重要的温室气体,通过
是两种重要的温室气体,通过 和
和 反应制造更高价值化学品是目前的研究目标。请回答下列问题:
反应制造更高价值化学品是目前的研究目标。请回答下列问题:Ⅰ.工业上可以利用
 和
和 合成
合成 :
:
 。该反应在起始温度和体积均相同(T℃、IL)的两个密闭容器中分别进行,反应物起始物质的量如表。
。该反应在起始温度和体积均相同(T℃、IL)的两个密闭容器中分别进行,反应物起始物质的量如表。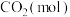 |  | 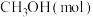 |  | |
| 反应a(恒温恒容) | 1 | 3 | 0 | 0 |
| 反应b(绝热恒容) | 0 | 0 | 1 | 1 |
A. | B.混合气体的平均摩尔质量不再改变 |
C.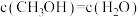 | D.容器内压强不再改变 |
 的体积分数
的体积分数
 。(填“>”、“<”或“=”)
。(填“>”、“<”或“=”) Ⅱ.我国科学家研究了不同反应温度对含碳产物组成的影响。
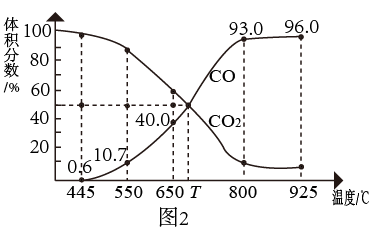
已知:反应1:


反应2:


在密闭容器中通入3mol的
 和1mol的
和1mol的 ,分别在0.1MPa和1MPa下进行反应。实验中对平衡体系进行分析,其中温度对CO和的影响如图1所示
,分别在0.1MPa和1MPa下进行反应。实验中对平衡体系进行分析,其中温度对CO和的影响如图1所示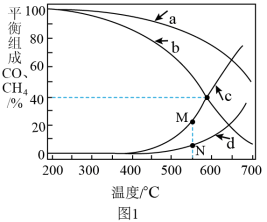
(3)1MPa时,表示
 和CO平衡组成随温度变化关系的曲线分别是
和CO平衡组成随温度变化关系的曲线分别是Ⅲ.在
 时,向体积为2L的恒容容器中充入物质的量之和为3mol的CO和
时,向体积为2L的恒容容器中充入物质的量之和为3mol的CO和 ,发生反应:
,发生反应: ,反应达到平衡时
,反应达到平衡时 的体积分数(
的体积分数(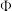 )与
)与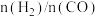 的关系如图2所示。
的关系如图2所示。
(4)当
 时,达到平衡后,
时,达到平衡后, 的体积分数可能是图象中的
的体积分数可能是图象中的(5)
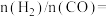
 的体积分数最大。
的体积分数最大。
21-22高二上·江苏镇江·期末 查看更多[2]
更新时间:2022-04-08 20:32:00
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】我国力争在2030年前实现碳达峰,2060年前实现碳中和。将二氧化碳资源化尤为重要。
(1)CO2可与H2制甲醇:在催化剂作用下,发生以下反应:
Ⅰ.

Ⅱ.
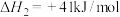
①则: △H=
△H=______ 。
若将等物质的量的CO和H2充入恒温恒容密闭容器中进行上述反应,下列事实能说明此反应已达到平衡状态的是______ 。
A.生成CH3OH的速率与生成H2的速率相等 B.CO和H2的物质的量之比为定值
C.混合气体的平均相对分子质量不变 D.容器内气体密度保持不变
E.CO的体积分数保持不变
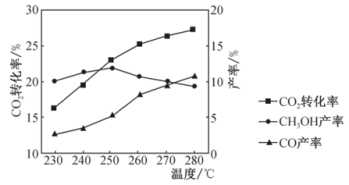
②将CO2与H2充入装有催化剂的密闭容器中,发生反应Ⅰ和Ⅱ。CO2的转化率和CO、CH3OH的产率随反应温度的变化如图所示。由图判断合成CH3OH最适宜的温度是______ 。反应过程中CH3OH产率随温度升高先增大后减小,降低的主要原因是______ 。
(2)CO2可与NH3制尿素: △H=-87 kJ/mol。研究发现,合成尿素的反应分两步进行。
△H=-87 kJ/mol。研究发现,合成尿素的反应分两步进行。
第1步: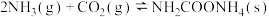
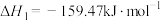
第2步: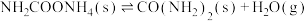
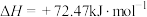
①一定条件下,向刚性容器中充入3 mol NH3和4 mol CO2,平衡时CO2的体积分数为60%,则平衡时NH3的转化率α(NH3)=______ (保留一位小数),此条件下,第2步反应的Kp=a kPa,则反应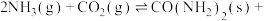
 的平衡常数Kp=
的平衡常数Kp=______ (kPa)-2。
②若要加快反应速率并提高NH3平衡转化率,可采取的措施有______ (任写一条)。
(1)CO2可与H2制甲醇:在催化剂作用下,发生以下反应:
Ⅰ.


Ⅱ.

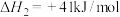
①则:
 △H=
△H=若将等物质的量的CO和H2充入恒温恒容密闭容器中进行上述反应,下列事实能说明此反应已达到平衡状态的是
A.生成CH3OH的速率与生成H2的速率相等 B.CO和H2的物质的量之比为定值
C.混合气体的平均相对分子质量不变 D.容器内气体密度保持不变
E.CO的体积分数保持不变
②将CO2与H2充入装有催化剂的密闭容器中,发生反应Ⅰ和Ⅱ。CO2的转化率和CO、CH3OH的产率随反应温度的变化如图所示。由图判断合成CH3OH最适宜的温度是

(2)CO2可与NH3制尿素:
 △H=-87 kJ/mol。研究发现,合成尿素的反应分两步进行。
△H=-87 kJ/mol。研究发现,合成尿素的反应分两步进行。第1步:
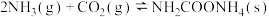
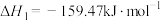
第2步:
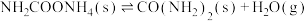
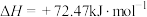
①一定条件下,向刚性容器中充入3 mol NH3和4 mol CO2,平衡时CO2的体积分数为60%,则平衡时NH3的转化率α(NH3)=
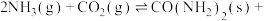
 的平衡常数Kp=
的平衡常数Kp=②若要加快反应速率并提高NH3平衡转化率,可采取的措施有
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】一定温度下,向容积为2L的恒容密闭容器中加入等物质的量的H2和I2,发生反应H2(g)+I2(g)  2HI(g)ΔH<0。测得不同反应时间容器内H2的物质的量如表;
2HI(g)ΔH<0。测得不同反应时间容器内H2的物质的量如表;
回答下列问题:
(1)0~20min内HI的平均反应速率为___ 。
(2)反应达到化学平衡状态时,I2的转化率为___ 。
(3)该条件下,能说明上述反应达到化学平衡状态的是__ 。(填标号)
A.混合气体颜色不再改变
B.容器内压强不再改变
C.H2、I2、HI三种气体体积分数不再改变
D.混合气体密度不再改变
E.c(H2)︰c(I2)=1︰1
F.n(H2)︰n(HI)不变
G.1molH—H键断裂的同时,生成2molH—I键
(4)该反应在三种不同情况下的化学反应速率分别为:①v(H2)=0.02mol·L-1·s-1,②v(I2)=0.32mol·L-1·min-1,③v(HI)=0.84mol·L-1·min-1。则反应进行的速率由快到慢的顺序为__ 。(用序号回答)
 2HI(g)ΔH<0。测得不同反应时间容器内H2的物质的量如表;
2HI(g)ΔH<0。测得不同反应时间容器内H2的物质的量如表;| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(H2)/mol | 1 | 0.75 | 0.65 | 0.6 | 0.6 |
回答下列问题:
(1)0~20min内HI的平均反应速率为
(2)反应达到化学平衡状态时,I2的转化率为
(3)该条件下,能说明上述反应达到化学平衡状态的是
A.混合气体颜色不再改变
B.容器内压强不再改变
C.H2、I2、HI三种气体体积分数不再改变
D.混合气体密度不再改变
E.c(H2)︰c(I2)=1︰1
F.n(H2)︰n(HI)不变
G.1molH—H键断裂的同时,生成2molH—I键
(4)该反应在三种不同情况下的化学反应速率分别为:①v(H2)=0.02mol·L-1·s-1,②v(I2)=0.32mol·L-1·min-1,③v(HI)=0.84mol·L-1·min-1。则反应进行的速率由快到慢的顺序为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】深入研究碳元素的化合物有重要意义,回答下列问题:
(1)在恒温、恒容密闭容器中加入H2C2O4,发生反应:H2C2O4(s) CO2(g)+CO(g)+H2O(g),下列叙述能说明反应已经达到平衡状态的是
CO2(g)+CO(g)+H2O(g),下列叙述能说明反应已经达到平衡状态的是________ 。
A.压强不再变化
B.CO2(g)的体积分数保持不变
C.混合气体的密度不再变化
D.混合气体的平均摩尔质量保持不变
(2)工业上可以通过反应CO(g)+2H2(g) CH3OH(g)制备甲醇。在一容积可变容器中充入2molCO和4molH2,CO的平衡转 化率随温度(T)、压强(P)的变化关系如图所示。该反应的∆H
CH3OH(g)制备甲醇。在一容积可变容器中充入2molCO和4molH2,CO的平衡转 化率随温度(T)、压强(P)的变化关系如图所示。该反应的∆H_______ 0(填“>”、“<”或“=”),比较A点时用CO表示的正反应速率与B点时用CH3OH表示的逆反应速率的大小v正(CO)____ v逆(CH3OH)(填“>”、“<”或“=”)。若在压强P1下达到化学平衡状态A时,容器的体积为10L。如果反应开始时仍充入2molCO和4molH2,则在压强P2下达到平衡状态B时容器的体积V(B)=________ L。

(3)从平衡移动的角度分析AlCl3溶液可以溶解CaCO3固体的原因是_________________
(4)常温下,测得某CaCO3的饱和溶液pH=10.0,忽略CO32-的第二步水解,计算Ksp(CaCO3)=__________ (保留三位有效数字)(已知:Ka1(H2CO3)=4.4×10-7 Ka2(H2CO3)=4.7×10-11)
(5)有一种可充电电池Na-Al/FeS,电池工作时Na+的物质的量保持不变,并且用含Na+的导电固体作为电解质,已知该电池的正极反应式为2Na++FeS+2e-=Na2S+Fe, 则放电时负极反应式为____________________ 。该电池充电时,当转移2mol电子时,阳极质量的变化量为______ g。
(1)在恒温、恒容密闭容器中加入H2C2O4,发生反应:H2C2O4(s)
 CO2(g)+CO(g)+H2O(g),下列叙述能说明反应已经达到平衡状态的是
CO2(g)+CO(g)+H2O(g),下列叙述能说明反应已经达到平衡状态的是A.压强不再变化
B.CO2(g)的体积分数保持不变
C.混合气体的密度不再变化
D.混合气体的平均摩尔质量保持不变
(2)工业上可以通过反应CO(g)+2H2(g)
 CH3OH(g)制备甲醇。在一容积可变容器中充入2molCO和4molH2,CO的平衡转 化率随温度(T)、压强(P)的变化关系如图所示。该反应的∆H
CH3OH(g)制备甲醇。在一容积可变容器中充入2molCO和4molH2,CO的平衡转 化率随温度(T)、压强(P)的变化关系如图所示。该反应的∆H
(3)从平衡移动的角度分析AlCl3溶液可以溶解CaCO3固体的原因是
(4)常温下,测得某CaCO3的饱和溶液pH=10.0,忽略CO32-的第二步水解,计算Ksp(CaCO3)=
(5)有一种可充电电池Na-Al/FeS,电池工作时Na+的物质的量保持不变,并且用含Na+的导电固体作为电解质,已知该电池的正极反应式为2Na++FeS+2e-=Na2S+Fe, 则放电时负极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】研究含氮污染物的治理是环保的一项重要工作。合理应用和处理氮的化合物,在生产生活中有重要意义,利用甲烷催化还原NOx消除氮氧化物的污染:
①CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g)ΔH1=-574kJ·mol-1
4NO(g)+CO2(g)+2H2O(g)ΔH1=-574kJ·mol-1
②CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g)ΔH2=-1160kJ·mol-1
2N2(g)+CO2(g)+2H2O(g)ΔH2=-1160kJ·mol-1
③CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g)ΔH3
N2(g)+CO2(g)+2H2O(g)ΔH3
(1)上述三个反应中ΔH3=___ ,第三个反应的平衡常数表达式为K3=___ 。
(2)在2L恒容密闭容器中充入1molCH4和2molNO2进行反应③,CH4的平衡转化率α(CH4)与温度和压强的关系如图所示。
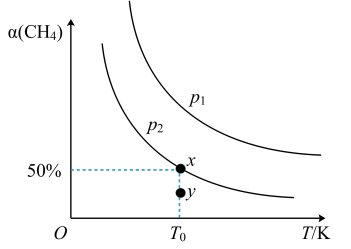
若容器中的压强为p2,y点:v正(填“大于”“等于”或“小于”)___ v逆。
(3)用活性炭还原法也可以处理氮氧化物。向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s)+2NO(g) N2(g)+CO2(g)ΔH。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)ΔH。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
①T1℃时,该反应在0~20min的平均反应速率v(CO2)=___ ;
②30min后只改变某一条件,根据上表数据判断改变的条件可能是__ (填序号)。
A.加入一定量的活性炭 B.恒温恒压充入氩气
C.适当缩小容器的体积 D.加入合适的催化剂
①CH4(g)+4NO2(g)
 4NO(g)+CO2(g)+2H2O(g)ΔH1=-574kJ·mol-1
4NO(g)+CO2(g)+2H2O(g)ΔH1=-574kJ·mol-1②CH4(g)+4NO(g)
 2N2(g)+CO2(g)+2H2O(g)ΔH2=-1160kJ·mol-1
2N2(g)+CO2(g)+2H2O(g)ΔH2=-1160kJ·mol-1③CH4(g)+2NO2(g)
 N2(g)+CO2(g)+2H2O(g)ΔH3
N2(g)+CO2(g)+2H2O(g)ΔH3(1)上述三个反应中ΔH3=
(2)在2L恒容密闭容器中充入1molCH4和2molNO2进行反应③,CH4的平衡转化率α(CH4)与温度和压强的关系如图所示。

若容器中的压强为p2,y点:v正(填“大于”“等于”或“小于”)
(3)用活性炭还原法也可以处理氮氧化物。向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)
 N2(g)+CO2(g)ΔH。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)ΔH。在T1℃时,反应进行到不同时间测得各物质的浓度如下:| 时间 浓度/mol•L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①T1℃时,该反应在0~20min的平均反应速率v(CO2)=
②30min后只改变某一条件,根据上表数据判断改变的条件可能是
A.加入一定量的活性炭 B.恒温恒压充入氩气
C.适当缩小容器的体积 D.加入合适的催化剂
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】当前,世界多国相继规划了“碳达峰”、“碳中和”的时间节点。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。
(1)工业上有一种方法是用 来生产燃料甲醇。为探究该反应原理,进行如下实验:某温度下,在容积为5L的密闭容器中,充入4mol
来生产燃料甲醇。为探究该反应原理,进行如下实验:某温度下,在容积为5L的密闭容器中,充入4mol 和12mol
和12mol 在一定条件下发生反应生成
在一定条件下发生反应生成 ,测得
,测得 、
、 (g)和
(g)和 (g)的物质的量(n)随时间变化如图所示。
(g)的物质的量(n)随时间变化如图所示。

①反应到第2分钟时,氢气的浓度为___________ 。
②该温度下,此反应的平衡常数K=___________ (保留一位小数)。
③保持温度和体积不变,向上述平衡体系中再同时充入1.5mol 和0.5mol
和0.5mol ,平衡
,平衡___________ (填“正向”“逆向”或“不”)移动。
④下列措施中,一定能使 的平衡转化率增大的是
的平衡转化率增大的是___________ (填标号)。
A.在原容器中充入1mol氦气 B.在原容器中再充入1mol
C.在原容器中再充入1mol D.使用更有效的催化剂
D.使用更有效的催化剂
E.增大容器的容积 F.将水蒸气从体系中分离
(2)甲醇的组成元素的电负性从大到小依次为___________ 。
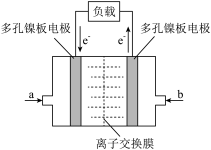
(3)甲醇被称为21世纪新型燃料,可用于甲醇燃料电池,如图(电解质溶液为稀硫酸),则a处通入的是(填“甲醇”或“氧气”)___________ ,其电极上发生的电极反应式为___________ 。若将电解质溶液换成KOH溶液,则该燃料电池的电极总反应式为___________ 。
(1)工业上有一种方法是用
 来生产燃料甲醇。为探究该反应原理,进行如下实验:某温度下,在容积为5L的密闭容器中,充入4mol
来生产燃料甲醇。为探究该反应原理,进行如下实验:某温度下,在容积为5L的密闭容器中,充入4mol 和12mol
和12mol 在一定条件下发生反应生成
在一定条件下发生反应生成 ,测得
,测得 、
、 (g)和
(g)和 (g)的物质的量(n)随时间变化如图所示。
(g)的物质的量(n)随时间变化如图所示。
①反应到第2分钟时,氢气的浓度为
②该温度下,此反应的平衡常数K=
③保持温度和体积不变,向上述平衡体系中再同时充入1.5mol
 和0.5mol
和0.5mol ,平衡
,平衡④下列措施中,一定能使
 的平衡转化率增大的是
的平衡转化率增大的是A.在原容器中充入1mol氦气 B.在原容器中再充入1mol

C.在原容器中再充入1mol
 D.使用更有效的催化剂
D.使用更有效的催化剂E.增大容器的容积 F.将水蒸气从体系中分离
(2)甲醇的组成元素的电负性从大到小依次为
(3)甲醇被称为21世纪新型燃料,可用于甲醇燃料电池,如图(电解质溶液为稀硫酸),则a处通入的是(填“甲醇”或“氧气”)

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的正反应为____ 热反应,且m+n____ p(填“>”、“=”或“<”)。
(2)若容积不变加入B,则A的转化率____ ,B的转化率____ 。(填“增大”、“减小”或“不变”,下同)
(3)若升高温度,则平衡时B、C的浓度之比 将
将____ 。
(4)若加入催化剂,平衡时气体混合物的总物质的量____ 。
(5)若B是有色物质,A、C均无色,体积不变、加入C时混合物颜色____ ;维持容器内压强不变,充入氖气时,混合物颜色____ 。(填“变深”、“变浅”或“不变”)
 pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:(1)该反应的正反应为
(2)若容积不变加入B,则A的转化率
(3)若升高温度,则平衡时B、C的浓度之比
 将
将(4)若加入催化剂,平衡时气体混合物的总物质的量
(5)若B是有色物质,A、C均无色,体积不变、加入C时混合物颜色
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】科学家积极探索新技术对CO2进行综合利用, CO2可用来合成低碳烃。
(1)已知:①4H2(g)+ 2O2(g)=4H2O(g) △H=-967.2kJ/mol。
②CH4(g)+ 2O2(g) =CO2(g) + 2H2O(g) ΔH=-802.0 kJ/mol。
则CO2(g) +4H2(g) CH4(g) + 2H2O(g) ΔH=
CH4(g) + 2H2O(g) ΔH=_______ kJ/mol
(2)在体积为1L的密闭刚性容器中,充入4mol H2和1mol CO2,测得温度对CO2的平衡转化率和催化剂催化效率的影响如图1所示。
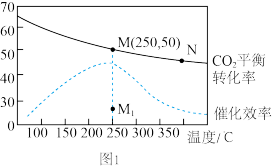
①已知M点总压为1MPa,该反应在此温度下的平衡常数Kp=_______ MPa-2.(Kp是用平衡分压代替平衡浓度表示的化学平衡常数,气体分压=气体总压×体积分数。)
②欲增加二氧化碳的平衡转化率,可采取的措施有_______ 。
A.通入惰性气体 B.提高温度 C.增加二氧化碳浓度 D.增加氢气浓度
③下列说法正确的是_______ 。
A.当压强或 不变时均可证明化学反应已达到平衡状态
不变时均可证明化学反应已达到平衡状态
B.其他条件不变,若不使用催化剂,则250℃ 时CO2的平衡转化率可能位于点M1
C.图1中M点时,甲烷的体积分数为12.5%
D.平衡常数大小:KN>KM
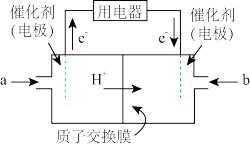
(3)新型高效的甲烷燃料电池工作时总反应式:CH4+2O2=CO2+2H2O。
①该电池的负极是_______ (填a或b),
②负极电极反应式为_______ 。
(1)已知:①4H2(g)+ 2O2(g)=4H2O(g) △H=-967.2kJ/mol。
②CH4(g)+ 2O2(g) =CO2(g) + 2H2O(g) ΔH=-802.0 kJ/mol。
则CO2(g) +4H2(g)
 CH4(g) + 2H2O(g) ΔH=
CH4(g) + 2H2O(g) ΔH=(2)在体积为1L的密闭刚性容器中,充入4mol H2和1mol CO2,测得温度对CO2的平衡转化率和催化剂催化效率的影响如图1所示。

①已知M点总压为1MPa,该反应在此温度下的平衡常数Kp=
②欲增加二氧化碳的平衡转化率,可采取的措施有
A.通入惰性气体 B.提高温度 C.增加二氧化碳浓度 D.增加氢气浓度
③下列说法正确的是
A.当压强或
 不变时均可证明化学反应已达到平衡状态
不变时均可证明化学反应已达到平衡状态B.其他条件不变,若不使用催化剂,则250℃ 时CO2的平衡转化率可能位于点M1
C.图1中M点时,甲烷的体积分数为12.5%
D.平衡常数大小:KN>KM
(3)新型高效的甲烷燃料电池工作时总反应式:CH4+2O2=CO2+2H2O。

①该电池的负极是
②负极电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】中科院大连化学物理研究所的一项最新成果实现了甲烷高效生产乙烯,甲烷在催化作用下脱氢,在气相中经自由基偶联反应生成乙烯,如图所示。

(1)已知相关物质的燃烧热如上表,写出甲烷制备乙烯的热化学方程式__ 。
(2)在400℃时,向1L的恒容反应器中充入1molCH4,发生上述反应,测得平衡混合气体中C2H4的体积分数为20.0%。则在该温度下,其平衡常数K=_ 。按化学平衡移动原理,在图中画出CH4的平衡转化率与温度及压强(p1>p2)的关系曲线___ 。
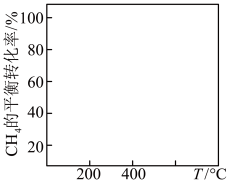
(3)在制备C2H4时,通常存在副反应:2CH4(g)=C2H6(g)+H2(g)。在常温下,向体积为1L的恒容反应器中充入1molCH4,然后不断升高温度,得到如图。

①在200℃时,测出乙烷的量比乙烯多的主要原因是__ 。
②在600℃后,乙烯的体积分数减少的主要原因是__ 。

| 物质 | 燃烧热/(kJ·mol-1) |
| 氢气 | 285.8 |
| 甲烷 | 890.3 |
| 乙烯 | 1411.0 |
(2)在400℃时,向1L的恒容反应器中充入1molCH4,发生上述反应,测得平衡混合气体中C2H4的体积分数为20.0%。则在该温度下,其平衡常数K=

(3)在制备C2H4时,通常存在副反应:2CH4(g)=C2H6(g)+H2(g)。在常温下,向体积为1L的恒容反应器中充入1molCH4,然后不断升高温度,得到如图。

①在200℃时,测出乙烷的量比乙烯多的主要原因是
②在600℃后,乙烯的体积分数减少的主要原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】用CH4催化还原NOx可以消除氮氧化物的污染。例如:
a.CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) ΔH1=﹣574kJ/mol
4NO(g)+CO2(g)+2H2O(g) ΔH1=﹣574kJ/mol
b.CH4(g)+4NO(g) 2N2(g) +CO2(g)+2H2O(g) ΔH2=﹣1160kJ/mol
2N2(g) +CO2(g)+2H2O(g) ΔH2=﹣1160kJ/mol
(1)写出1mol CH4还原NO2至N2的热化学方程式___________ 。
(2)用CH4催化还原NO,欲提高N2的平衡产率,应该采取的措施是___________(填序号)。
(3)一定温度下,在初始体积为2L恒容密闭容器中通入1molCH4和4molNO(假设只发生反应b),20min后该反应达到平衡,测得容器中N2的物质的量为0.8mol。则从反应开始至刚达到平衡用NO表示的反应速率v(NO)=___________ ,该温度下反应的平衡常数K=___________ (用分数表示)。
(4)在(3)的平衡状态下NO的体积分数为φ1,向容器中再充入0.6molCH4和0.4molCO2,此时v正___________ v逆(填“大于”“小于”或“等于”,下同),则平衡时NO的体积分数φ2___________ φ1。
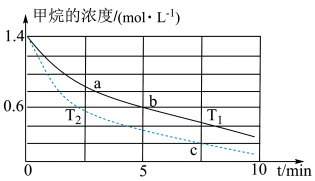
(5)对于反应b而言,不同温度下,CH4的浓度变化如下图所示,下列说法正确的是___________(填序号)。
a.CH4(g)+4NO2(g)
 4NO(g)+CO2(g)+2H2O(g) ΔH1=﹣574kJ/mol
4NO(g)+CO2(g)+2H2O(g) ΔH1=﹣574kJ/molb.CH4(g)+4NO(g)
 2N2(g) +CO2(g)+2H2O(g) ΔH2=﹣1160kJ/mol
2N2(g) +CO2(g)+2H2O(g) ΔH2=﹣1160kJ/mol(1)写出1mol CH4还原NO2至N2的热化学方程式
(2)用CH4催化还原NO,欲提高N2的平衡产率,应该采取的措施是___________(填序号)。
| A.升高温度 | B.增大压强 | C.降低温度 | D.降低压强 |
(3)一定温度下,在初始体积为2L恒容密闭容器中通入1molCH4和4molNO(假设只发生反应b),20min后该反应达到平衡,测得容器中N2的物质的量为0.8mol。则从反应开始至刚达到平衡用NO表示的反应速率v(NO)=
(4)在(3)的平衡状态下NO的体积分数为φ1,向容器中再充入0.6molCH4和0.4molCO2,此时v正
(5)对于反应b而言,不同温度下,CH4的浓度变化如下图所示,下列说法正确的是___________(填序号)。

| A.T1大于T2 |
| B.a点正反应速率大于b点的正反应速率 |
| C.c时二氧化碳的浓度为0.2mol/L |
| D.a点的反应速率一定比c点的反应速率小 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】党的二十大指出,我国力争在2030年前实现碳达峰,2060年前实现碳中和的目标。以下是转化二氧化碳的几种方案:
(1) 转化为
转化为 是目前科学研究的热点。回答下列问题:
是目前科学研究的热点。回答下列问题:
①已知:①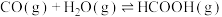
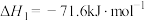
②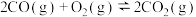
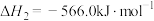
则反应③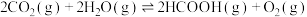

_______  。
。
②刚性绝热密闭容器中,等物质的量的 和
和 发生反应③,下列不能判断反应达到平衡的是
发生反应③,下列不能判断反应达到平衡的是_______ (填标号)。
A. 和
和 的物质的量之比不变 B.容器内温度不变
的物质的量之比不变 B.容器内温度不变
C.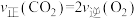 D.容器中气体平均摩尔质量不变
D.容器中气体平均摩尔质量不变
(2)以 、
、 为原料合成
为原料合成 涉及的反应如下:
涉及的反应如下:
Ⅰ.

Ⅱ.

在 恒压条件下,按照
恒压条件下,按照 投料,平衡时,
投料,平衡时, 和
和 在含碳产物中物质的量分数及
在含碳产物中物质的量分数及 的转化率随温度的变化如图,回答下列问题:
的转化率随温度的变化如图,回答下列问题:

①图中代表 的曲线为
的曲线为_______ (填“m”或“n”)。
②解释150~250℃范围内 转化率随温度升高而降低的原因
转化率随温度升高而降低的原因_______ 。
③下列说法正确的是_______ (填字母)。
A. 的平衡转化率始终低于
的平衡转化率始终低于 的
的
B.温度越低,越有利于工业生产
C.加入选择性高的催化剂,可提高 的平衡转化率
的平衡转化率
D.150~400℃范围内,温度升高, 的平衡产量先减小后增大
的平衡产量先减小后增大
④270℃时,反应Ⅱ的平衡常数
_______ (用 表示,只需列出计算式)。
表示,只需列出计算式)。
(3)电解法转化 可实现
可实现 资源化利用。电解
资源化利用。电解 制
制 的原理示意图如图所示。
的原理示意图如图所示。
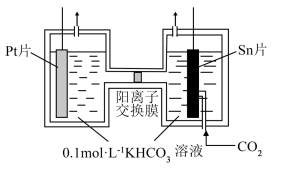
电解一段时间后,阳极区的 溶液浓度降低,其原因是
溶液浓度降低,其原因是_______ 。
(1)
 转化为
转化为 是目前科学研究的热点。回答下列问题:
是目前科学研究的热点。回答下列问题:①已知:①
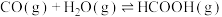
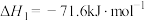
②
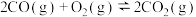
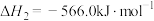
则反应③
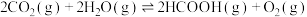

 。
。②刚性绝热密闭容器中,等物质的量的
 和
和 发生反应③,下列不能判断反应达到平衡的是
发生反应③,下列不能判断反应达到平衡的是A.
 和
和 的物质的量之比不变 B.容器内温度不变
的物质的量之比不变 B.容器内温度不变C.
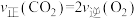 D.容器中气体平均摩尔质量不变
D.容器中气体平均摩尔质量不变(2)以
 、
、 为原料合成
为原料合成 涉及的反应如下:
涉及的反应如下:Ⅰ.


Ⅱ.


在
 恒压条件下,按照
恒压条件下,按照 投料,平衡时,
投料,平衡时, 和
和 在含碳产物中物质的量分数及
在含碳产物中物质的量分数及 的转化率随温度的变化如图,回答下列问题:
的转化率随温度的变化如图,回答下列问题:
①图中代表
 的曲线为
的曲线为②解释150~250℃范围内
 转化率随温度升高而降低的原因
转化率随温度升高而降低的原因③下列说法正确的是
A.
 的平衡转化率始终低于
的平衡转化率始终低于 的
的B.温度越低,越有利于工业生产

C.加入选择性高的催化剂,可提高
 的平衡转化率
的平衡转化率D.150~400℃范围内,温度升高,
 的平衡产量先减小后增大
的平衡产量先减小后增大④270℃时,反应Ⅱ的平衡常数

 表示,只需列出计算式)。
表示,只需列出计算式)。(3)电解法转化
 可实现
可实现 资源化利用。电解
资源化利用。电解 制
制 的原理示意图如图所示。
的原理示意图如图所示。
电解一段时间后,阳极区的
 溶液浓度降低,其原因是
溶液浓度降低,其原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】资源化利用碳及其化合物具有重要意义。
(1)CO是高炉炼铁的重要还原剂,炼铁时发生的主要反应有:
Ⅰ.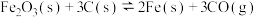

Ⅱ.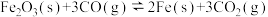
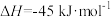
反应Ⅱ中,正反应的活化能_______ (填“ ”、“
”、“ ”或“
”或“ ”)逆反应的活化能。
”)逆反应的活化能。
(2)在一定温度下,向某体积可变的恒压(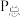 )密闭容器中加入
)密闭容器中加入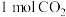 与足量的碳发生反应
与足量的碳发生反应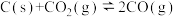 ,平衡时体系中气体体积分数与温度关系如图2所示。
,平衡时体系中气体体积分数与温度关系如图2所示。
①650℃时,反应达平衡后 的转化率为
的转化率为_______ ;
②T℃时,在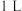 恒容密闭容器中加入
恒容密闭容器中加入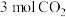 与足量的碳,
与足量的碳,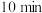 后测得
后测得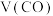 为
为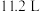 (标况下),则
(标况下),则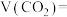
_______ ;上述反应达到平衡状态时,下列说法正确的是_______ (填序号);
a.单位时间内生成的CO2的物质的量是CO的两倍
b.容器中气体的压强不随时间而变化
c.升高温度,再次达到平衡时,C的质量减少
d.保持其它条件不变,充入惰性气体,反应速率减小,平衡移动
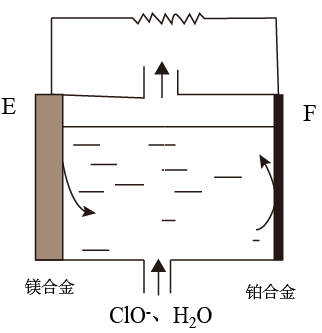
(3)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。如图为“镁-次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。E为该燃料电池的_______ (填“正”或“负”)极。F电极上的电极反应式为_______ 。
(1)CO是高炉炼铁的重要还原剂,炼铁时发生的主要反应有:
Ⅰ.
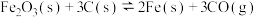

Ⅱ.
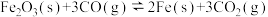
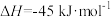
反应Ⅱ中,正反应的活化能
 ”、“
”、“ ”或“
”或“ ”)逆反应的活化能。
”)逆反应的活化能。(2)在一定温度下,向某体积可变的恒压(
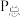 )密闭容器中加入
)密闭容器中加入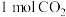 与足量的碳发生反应
与足量的碳发生反应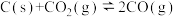 ,平衡时体系中气体体积分数与温度关系如图2所示。
,平衡时体系中气体体积分数与温度关系如图2所示。
①650℃时,反应达平衡后
 的转化率为
的转化率为②T℃时,在
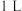 恒容密闭容器中加入
恒容密闭容器中加入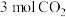 与足量的碳,
与足量的碳,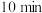 后测得
后测得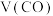 为
为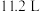 (标况下),则
(标况下),则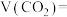
a.单位时间内生成的CO2的物质的量是CO的两倍
b.容器中气体的压强不随时间而变化
c.升高温度,再次达到平衡时,C的质量减少
d.保持其它条件不变,充入惰性气体,反应速率减小,平衡移动
(3)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。如图为“镁-次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。E为该燃料电池的

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】用 代替
代替 与燃料CO反应,既可以提高燃烧效率,又能得到高纯
与燃料CO反应,既可以提高燃烧效率,又能得到高纯 ,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
①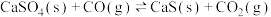
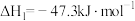
②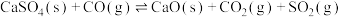
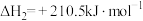
③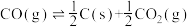
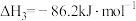
(1)反应①~③的平衡常数的对数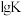 随反应温度T的变化曲线如图中所示,图中曲线b对应反应
随反应温度T的变化曲线如图中所示,图中曲线b对应反应___________ (填①、②或③,判断依据是___________ 。
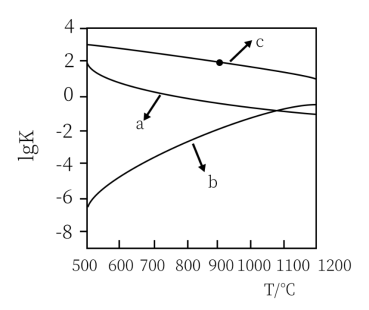
(2)反应①的
___________ (用表达式表示)。向盛有 的真空恒容容器中充入CO,反应①于900℃达到平衡,平衡时测得
的真空恒容容器中充入CO,反应①于900℃达到平衡,平衡时测得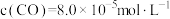 ,结合上图曲线c中相关数据,计算CO的平衡转化率为
,结合上图曲线c中相关数据,计算CO的平衡转化率为___________ (忽略副反应,结果保留2位有效数字)。
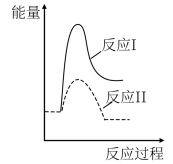
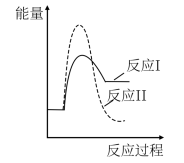
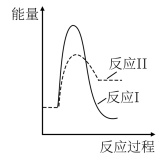
(3)假设某温度下,反应②的速率( )大于反应①的速率(
)大于反应①的速率( ),则下列反应过程能量变化示意图正确的是
),则下列反应过程能量变化示意图正确的是___________ 。
(4)恒温恒容条件下,假设反应①和②同时发生,且 ,则反应体系中
,则反应体系中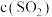 随时间t变化的趋势为
随时间t变化的趋势为___________ 。
 代替
代替 与燃料CO反应,既可以提高燃烧效率,又能得到高纯
与燃料CO反应,既可以提高燃烧效率,又能得到高纯 ,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。①
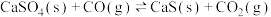
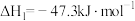
②
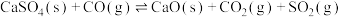
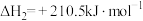
③
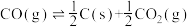
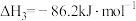
(1)反应①~③的平衡常数的对数
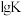 随反应温度T的变化曲线如图中所示,图中曲线b对应反应
随反应温度T的变化曲线如图中所示,图中曲线b对应反应
(2)反应①的

 的真空恒容容器中充入CO,反应①于900℃达到平衡,平衡时测得
的真空恒容容器中充入CO,反应①于900℃达到平衡,平衡时测得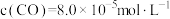 ,结合上图曲线c中相关数据,计算CO的平衡转化率为
,结合上图曲线c中相关数据,计算CO的平衡转化率为(3)假设某温度下,反应②的速率(
 )大于反应①的速率(
)大于反应①的速率( ),则下列反应过程能量变化示意图正确的是
),则下列反应过程能量变化示意图正确的是| A | B | C | D |
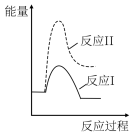 |  |  |  |
(4)恒温恒容条件下,假设反应①和②同时发生,且
 ,则反应体系中
,则反应体系中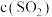 随时间t变化的趋势为
随时间t变化的趋势为
您最近一年使用:0次



