我国力争在2030年前实现碳达峰,2060年前实现碳中和。将二氧化碳资源化尤为重要。
(1)CO2可与H2制甲醇:在催化剂作用下,发生以下反应:
Ⅰ.

Ⅱ.
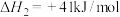
①则: △H=
△H=______ 。
若将等物质的量的CO和H2充入恒温恒容密闭容器中进行上述反应,下列事实能说明此反应已达到平衡状态的是______ 。
A.生成CH3OH的速率与生成H2的速率相等 B.CO和H2的物质的量之比为定值
C.混合气体的平均相对分子质量不变 D.容器内气体密度保持不变
E.CO的体积分数保持不变
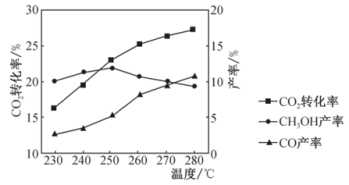
②将CO2与H2充入装有催化剂的密闭容器中,发生反应Ⅰ和Ⅱ。CO2的转化率和CO、CH3OH的产率随反应温度的变化如图所示。由图判断合成CH3OH最适宜的温度是______ 。反应过程中CH3OH产率随温度升高先增大后减小,降低的主要原因是______ 。
(2)CO2可与NH3制尿素: △H=-87 kJ/mol。研究发现,合成尿素的反应分两步进行。
△H=-87 kJ/mol。研究发现,合成尿素的反应分两步进行。
第1步: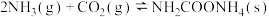
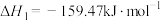
第2步: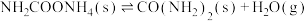
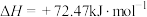
①一定条件下,向刚性容器中充入3 mol NH3和4 mol CO2,平衡时CO2的体积分数为60%,则平衡时NH3的转化率α(NH3)=______ (保留一位小数),此条件下,第2步反应的Kp=a kPa,则反应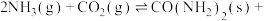
 的平衡常数Kp=
的平衡常数Kp=______ (kPa)-2。
②若要加快反应速率并提高NH3平衡转化率,可采取的措施有______ (任写一条)。
(1)CO2可与H2制甲醇:在催化剂作用下,发生以下反应:
Ⅰ.


Ⅱ.

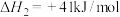
①则:
 △H=
△H=若将等物质的量的CO和H2充入恒温恒容密闭容器中进行上述反应,下列事实能说明此反应已达到平衡状态的是
A.生成CH3OH的速率与生成H2的速率相等 B.CO和H2的物质的量之比为定值
C.混合气体的平均相对分子质量不变 D.容器内气体密度保持不变
E.CO的体积分数保持不变
②将CO2与H2充入装有催化剂的密闭容器中,发生反应Ⅰ和Ⅱ。CO2的转化率和CO、CH3OH的产率随反应温度的变化如图所示。由图判断合成CH3OH最适宜的温度是

(2)CO2可与NH3制尿素:
 △H=-87 kJ/mol。研究发现,合成尿素的反应分两步进行。
△H=-87 kJ/mol。研究发现,合成尿素的反应分两步进行。第1步:
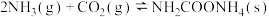
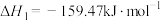
第2步:
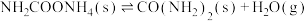
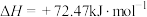
①一定条件下,向刚性容器中充入3 mol NH3和4 mol CO2,平衡时CO2的体积分数为60%,则平衡时NH3的转化率α(NH3)=
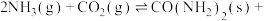
 的平衡常数Kp=
的平衡常数Kp=②若要加快反应速率并提高NH3平衡转化率,可采取的措施有
更新时间:2023-01-13 16:44:37
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】(1)S8分子可形成单斜硫和斜方硫,转化过程如下:S(s,单斜)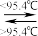 S (s,斜方) ΔH=-0.398 kJ·mol-1,则S(单斜)、S(斜方)相比,较稳定的是
S (s,斜方) ΔH=-0.398 kJ·mol-1,则S(单斜)、S(斜方)相比,较稳定的是________ (填“S(单斜)”或“S(斜方)”)。
(2)下表中的数据表示破坏1 mol化学键需消耗的能量(即键能,单位为kJ·mol-1)
热化学方程式:H2(g)+Cl2(g)===2HCl(g) ΔH=-183 kJ·mol-1,则Cl2的键能为________ kJ·mol-1。
(3)标准状况下,6.72 L C2H2(g)在O2(g)中完全燃烧生成CO2(g)和H2O(l),放出389.7 kJ热量,请写出表示C2H2燃烧热的热化学方程式:____________________________________ 。
(4)已知:C(石墨,s)+ O2(g)===CO2(g) ΔH1=-a kJ·mol-1
H2(g)+ O2(g)===H2O(l) ΔH2=-b kJ·mol-1
O2(g)===H2O(l) ΔH2=-b kJ·mol-1
CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH3=-c kJ·mol-1
计算C(石墨,s)与H2(g)反应生成1 mol CH4(g)的ΔH为____________ kJ·mol-1 (用含a、b、c的式子表示)。
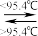 S (s,斜方) ΔH=-0.398 kJ·mol-1,则S(单斜)、S(斜方)相比,较稳定的是
S (s,斜方) ΔH=-0.398 kJ·mol-1,则S(单斜)、S(斜方)相比,较稳定的是(2)下表中的数据表示破坏1 mol化学键需消耗的能量(即键能,单位为kJ·mol-1)
化学键 | H—H | H—Cl |
键能 | 436 | 431 |
热化学方程式:H2(g)+Cl2(g)===2HCl(g) ΔH=-183 kJ·mol-1,则Cl2的键能为
(3)标准状况下,6.72 L C2H2(g)在O2(g)中完全燃烧生成CO2(g)和H2O(l),放出389.7 kJ热量,请写出表示C2H2燃烧热的热化学方程式:
(4)已知:C(石墨,s)+ O2(g)===CO2(g) ΔH1=-a kJ·mol-1
H2(g)+
 O2(g)===H2O(l) ΔH2=-b kJ·mol-1
O2(g)===H2O(l) ΔH2=-b kJ·mol-1CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH3=-c kJ·mol-1
计算C(石墨,s)与H2(g)反应生成1 mol CH4(g)的ΔH为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。甲烷水蒸气催化重整是制高纯氢的方法之一。
(1)反应器中初始反应的生成物为H2和CO2,其物质的量之比为4∶1,甲烷和水蒸气反应的方程式是___ 。
(2)已知反应器中还存在如下反应:
i.CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1
ii.CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2
iii.CH4(g)=C(s)+2H2(g) ΔH3
……
反应iii为积炭反应,利用ΔH1和ΔH2计算ΔH3时,还需要利用__ (写化学方程式)反应的ΔH。
(3)反应物投料比采用n(H2O)∶n(CH4)=4∶1,大于反应的计量数之比,目的是__ (填字母)。
a.促进CH4转化 b.促进CO转化为CO2 c.减少积炭生成
(4)用CaO可以去除CO2。H2体积分数和CaO消耗率随时间变化关系如图所示。从t1时开始,H2体积分数显著降低,单位时间CaO消耗率__ (填“升高”“降低”或“不变”)。此时CaO消耗率约为35%,但已失效,因为此时CaO主要发生了__ (写化学方程式)反应而使(1)中反应平衡向__ 移动。

(5)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池。以此电池作电源,在实验室中模拟铝制品表面“钝化”处理过程(装置如图所示)。其中物质a是__ ,电源负极电极反应为___ 。“钝化”装置中阳极电极反应为___ 。

(1)反应器中初始反应的生成物为H2和CO2,其物质的量之比为4∶1,甲烷和水蒸气反应的方程式是
(2)已知反应器中还存在如下反应:
i.CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1
ii.CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2
iii.CH4(g)=C(s)+2H2(g) ΔH3
……
反应iii为积炭反应,利用ΔH1和ΔH2计算ΔH3时,还需要利用
(3)反应物投料比采用n(H2O)∶n(CH4)=4∶1,大于反应的计量数之比,目的是
a.促进CH4转化 b.促进CO转化为CO2 c.减少积炭生成
(4)用CaO可以去除CO2。H2体积分数和CaO消耗率随时间变化关系如图所示。从t1时开始,H2体积分数显著降低,单位时间CaO消耗率

(5)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池。以此电池作电源,在实验室中模拟铝制品表面“钝化”处理过程(装置如图所示)。其中物质a是

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】 和
和 是两种常见的温室气体,利用
是两种常见的温室气体,利用 和
和 生成高附加值合成气CO和
生成高附加值合成气CO和 ,以及甲烷部分催化裂解制备乙烯是目前研究的热点之一。回答下列问题:
,以及甲烷部分催化裂解制备乙烯是目前研究的热点之一。回答下列问题:
(1)已知: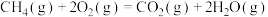
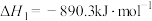 ;
;
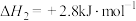 ;
;
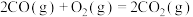
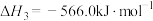 。
。
反应 的
的
________  ;对于该反应,有利于提高
;对于该反应,有利于提高 平衡转化率的条件是
平衡转化率的条件是________ (填字母)。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
(2)CO常用于工业冶炼金属,如图是在不同温度下CO还原三种金属氧化物达平衡后气体中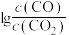 与温度(T)的关系曲线图。下列说法正确的是________(填字母)。
与温度(T)的关系曲线图。下列说法正确的是________(填字母)。
(3)甲烷部分催化裂解制备乙烯的反应原理为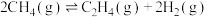
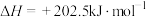 。温度为T℃,压强为100kPa时,向体积可变的密闭容器中加入
。温度为T℃,压强为100kPa时,向体积可变的密闭容器中加入 ,平衡时
,平衡时 转化率为40%,若温度、压强和
转化率为40%,若温度、压强和 初始量不变,充入
初始量不变,充入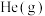 作为稀释气,平衡时
作为稀释气,平衡时 转化率为50%,则充入He的物质的量为
转化率为50%,则充入He的物质的量为________ mol。
(4)一定温度下,将 充入2L的固定容积容器中发生反应
充入2L的固定容积容器中发生反应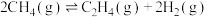
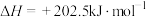 。实验测得容器内各气体分压与时间的关系如图所示。
。实验测得容器内各气体分压与时间的关系如图所示。 的平衡转化率为
的平衡转化率为________ 。
②反应的平衡常数
________ 。
③若在该温度下,向容器中再充入 ,达到平衡时,平衡混合物中
,达到平衡时,平衡混合物中 的物质的量分数
的物质的量分数________ (填“增大”“减小”或“不变”)。
 和
和 是两种常见的温室气体,利用
是两种常见的温室气体,利用 和
和 生成高附加值合成气CO和
生成高附加值合成气CO和 ,以及甲烷部分催化裂解制备乙烯是目前研究的热点之一。回答下列问题:
,以及甲烷部分催化裂解制备乙烯是目前研究的热点之一。回答下列问题:(1)已知:
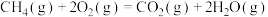
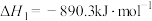 ;
;
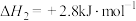 ;
;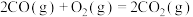
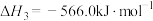 。
。反应
 的
的
 ;对于该反应,有利于提高
;对于该反应,有利于提高 平衡转化率的条件是
平衡转化率的条件是A.高温高压 B.高温低压 C.低温高压 D.低温低压
(2)CO常用于工业冶炼金属,如图是在不同温度下CO还原三种金属氧化物达平衡后气体中
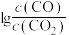 与温度(T)的关系曲线图。下列说法正确的是________(填字母)。
与温度(T)的关系曲线图。下列说法正确的是________(填字母)。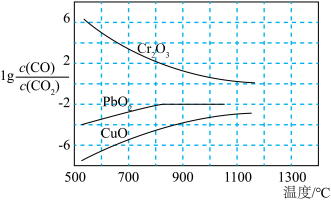
A.CO还原 的反应 的反应 |
| B.CO不适宜用于工业冶炼金属铬(Cr) |
| C.工业冶炼金属铜时较低的温度有利于提高CO的利用率 |
| D.工业上可以通过增高反应装置来延长矿石和CO接触的时间,减少尾气中CO的含量 |
(3)甲烷部分催化裂解制备乙烯的反应原理为
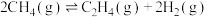
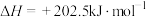 。温度为T℃,压强为100kPa时,向体积可变的密闭容器中加入
。温度为T℃,压强为100kPa时,向体积可变的密闭容器中加入 ,平衡时
,平衡时 转化率为40%,若温度、压强和
转化率为40%,若温度、压强和 初始量不变,充入
初始量不变,充入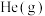 作为稀释气,平衡时
作为稀释气,平衡时 转化率为50%,则充入He的物质的量为
转化率为50%,则充入He的物质的量为(4)一定温度下,将
 充入2L的固定容积容器中发生反应
充入2L的固定容积容器中发生反应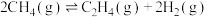
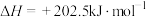 。实验测得容器内各气体分压与时间的关系如图所示。
。实验测得容器内各气体分压与时间的关系如图所示。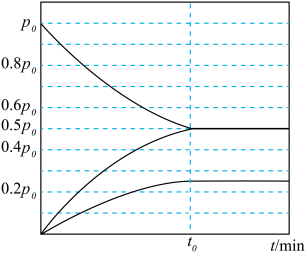
 的平衡转化率为
的平衡转化率为②反应的平衡常数

③若在该温度下,向容器中再充入
 ,达到平衡时,平衡混合物中
,达到平衡时,平衡混合物中 的物质的量分数
的物质的量分数
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】在一定体积的密闭容器中,进行如下化学反应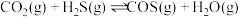 ,其化学平衡常数K和温度T的关系如下表:
,其化学平衡常数K和温度T的关系如下表:
回答下列问题:
(1)请写出该反应的平衡常数表达式:___________ ;该反应为___________ (填“吸热”或“放热”)反应。
(2)能判断该反应是否已达化学平衡状态的依据是___________ (填字母)。
A.容器中压强不变 B.
C.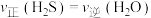 D.混合气体中
D.混合气体中 不变 E.容器中气体的密度保持不变
不变 E.容器中气体的密度保持不变
(3)某温度下,在 的密闭容器中,加入
的密闭容器中,加入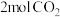 和
和 充分反应,达到平衡时,
充分反应,达到平衡时, 的平衡浓度为
的平衡浓度为 ,试判断此时的温度为
,试判断此时的温度为___________ 。
(4)若在(3)的密闭容器中,保持温度不变,再加入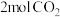 和
和 ,充分反应达到新平衡时,
,充分反应达到新平衡时, 的物质的量为
的物质的量为___________ ; 的转化率
的转化率___________ (填“增大”“减小”或“不变”)。
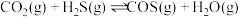 ,其化学平衡常数K和温度T的关系如下表:
,其化学平衡常数K和温度T的关系如下表: | 600 | 700 | 750 | 900 | 1100 |
| K | 0.6 | 0.9 | 1.0 | 1.5 | 2.4 |
回答下列问题:
(1)请写出该反应的平衡常数表达式:
(2)能判断该反应是否已达化学平衡状态的依据是
A.容器中压强不变 B.

C.
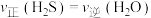 D.混合气体中
D.混合气体中 不变 E.容器中气体的密度保持不变
不变 E.容器中气体的密度保持不变(3)某温度下,在
 的密闭容器中,加入
的密闭容器中,加入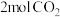 和
和 充分反应,达到平衡时,
充分反应,达到平衡时, 的平衡浓度为
的平衡浓度为 ,试判断此时的温度为
,试判断此时的温度为(4)若在(3)的密闭容器中,保持温度不变,再加入
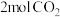 和
和 ,充分反应达到新平衡时,
,充分反应达到新平衡时, 的物质的量为
的物质的量为 的转化率
的转化率
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】某同学利用铁与水蒸气反应后的固体物质进行了如下实验:

(1)固体溶于稀盐酸的化学方程式为_________________________ ;
(2)试剂1的化学式是_______ ;加入试剂1后呈红色的原因是(用离子方程式表示)______________ 。
(3)加入新制氯水后溶液红色加深的原因是(用化学用语和必要文字解释)_________ ;_______ ;
(4)某一同学在实验中由于加入了过量新制氯水,放置一段时间后,发现深红色褪去,为了探究溶液褪色的原因,另有四位同学进行了下表的猜想,你认为丁同学的猜想会是什么?(提示:SCN-中硫元素化合价为-2价)
为验证丁同学的猜想合理与否?请同学们根据结论完成下表的实验设计方案。可选用试剂:浓硫酸、1.0 mol/L HNO3、1.0 mol/L盐酸、1.0 mol/L NaOH、0.1 mol/L FeCl3、
0.1 mol/L CuSO4、20%KSCN、蒸馏水。

(1)固体溶于稀盐酸的化学方程式为
(2)试剂1的化学式是
(3)加入新制氯水后溶液红色加深的原因是(用化学用语和必要文字解释)
(4)某一同学在实验中由于加入了过量新制氯水,放置一段时间后,发现深红色褪去,为了探究溶液褪色的原因,另有四位同学进行了下表的猜想,你认为丁同学的猜想会是什么?(提示:SCN-中硫元素化合价为-2价)
| 编 号 | 猜 想 |
| 甲 | 溶液中的+3价Fe又被还原为+2价Fe |
| 乙 | 溶液中的+3价Fe被氧化为更高的价态 |
| 丙 | 新制的氯水具有漂白性,将该溶液漂白 |
| 丁 |
0.1 mol/L CuSO4、20%KSCN、蒸馏水。
| 实验操作 | 预期现象 | 结 论 |
| 说明丁同学的猜想是合理的 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】一定条件下正戊烷(CH3CH2CH2CH2CH3)发生两种裂解反应:
Ⅰ.CH3CH2CH2 CH2CH3 (g)⇋CH3CH===CH2(g)+CH3 CH3 (g) ΔH1=+274.2 kJ·mol-1
Ⅱ.CH3CH2CH2CH2CH3(g)⇋CH3CH2CH3(g)+CH2===CH2(g) ΔH2=+122.7 kJ·mol -1
回答下列问题:
(1)在恒温恒压的密闭容器中,充入一定量的正戊烷发生裂解反应,起始时容器体积为 a L,一段时间反应达到平衡后容器体积变为 b L,此时正戊烷的转化率 α(正戊烷)=_________ ;向反应体系中充入一定量的水蒸气(水 蒸气在该条件下不参与反应),再次平衡后正戊烷的转化率将_____ (填“增大”“减小”或“不变”),原因为_______________ 。
(2)温度为 T ℃时,往压强恒为 100 kPa 的密闭容器中充入 1 mol·L-1 CH3CH=CH2和 2 mol·L-1 CH3CH3发生反应:CH3CH===CH2(g)+CH3CH3(g) ⇋CH3CH2CH3(g)+CH2===CH2(g)ΔH3。测得 CH3CH2CH3的物质的量浓度随时间 t 的变化如图中曲线Ⅰ所示。
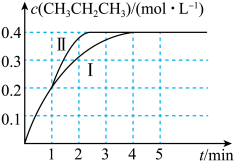
①ΔH3=_____ 。
②该反应的平衡常数 Kp=_____ 。(Kp 为以分压表示的平衡常数,分压=总压×物质的量分数,计算结果 保留 2 位小数)。
③若在 1 min 时,改变某一反应条件,曲线Ⅰ变为曲线Ⅱ,则改变的条件为_____ 。
(3)将 0.1 mol CH3CH3完全燃烧后的气体通入 100 mL 3 mol·L-1的 NaOH 溶液中,充分反应后所得溶液中离子浓度的大小顺序为_____ 。
(4)以稀硫酸为电解质溶液,CH3CH3燃料电池的负极反应式为_____ 。
Ⅰ.CH3CH2CH2 CH2CH3 (g)⇋CH3CH===CH2(g)+CH3 CH3 (g) ΔH1=+274.2 kJ·mol-1
Ⅱ.CH3CH2CH2CH2CH3(g)⇋CH3CH2CH3(g)+CH2===CH2(g) ΔH2=+122.7 kJ·mol -1
回答下列问题:
(1)在恒温恒压的密闭容器中,充入一定量的正戊烷发生裂解反应,起始时容器体积为 a L,一段时间反应达到平衡后容器体积变为 b L,此时正戊烷的转化率 α(正戊烷)=
(2)温度为 T ℃时,往压强恒为 100 kPa 的密闭容器中充入 1 mol·L-1 CH3CH=CH2和 2 mol·L-1 CH3CH3发生反应:CH3CH===CH2(g)+CH3CH3(g) ⇋CH3CH2CH3(g)+CH2===CH2(g)ΔH3。测得 CH3CH2CH3的物质的量浓度随时间 t 的变化如图中曲线Ⅰ所示。

①ΔH3=
②该反应的平衡常数 Kp=
③若在 1 min 时,改变某一反应条件,曲线Ⅰ变为曲线Ⅱ,则改变的条件为
(3)将 0.1 mol CH3CH3完全燃烧后的气体通入 100 mL 3 mol·L-1的 NaOH 溶液中,充分反应后所得溶液中离子浓度的大小顺序为
(4)以稀硫酸为电解质溶液,CH3CH3燃料电池的负极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】某反应体系中,有反应物和生成物六种物质:HCl(浓)、KClO3、KCl、ClO2、Cl2、H2O。已知该反应中,KClO3发生了一个过程:KClO3→ClO2。ClO2是黄绿色易爆的气体。
(1)写出并配平上述过程的化学方程式______
(2)该反应中,盐酸体现了_______ 、_______ 性质。氧化剂是___________ ,反应后,若产生0.6mol气体,则转移电子的物质的量为___________ 。
(3)世界卫生组织(WHO)将二氧化氯(ClO2)列为A级高效、安全灭菌消毒剂,工业上ClO2常用NaClO3和Na2SO3溶液混合,并加H2SO4反应制得,在以上反应中,NaClO3和Na2SO3的物质的量之比为_________
(4)在一固定容积的密闭容器中进行着反应:CO2(g)+H2(g) CO(g)+ H2O(g),其平衡常数K和温度的关系如下:
CO(g)+ H2O(g),其平衡常数K和温度的关系如下:
①该反应的正反应为___________ 反应。(“吸热”或“放热”)
②平衡常数K表示的意义是____________________ 。
③能判断该反应是否已经达到化学平衡状态的是( )
a.容器中密度不变
b.混合气体中CO浓度不变
c.v(H2)正= v(H2O)逆
d.c(CO2)= c(CO)
(5)该反应的逆反应速率随时间变化情况如图所示。

①从图可知,在t1时改变了某种反应条件,反应在t2时达到平衡,改变的条件可能是_______ (选填编号)。
a.升高温度 b.增大CO2的浓度
c.减小CO2的浓度 d.使用催化剂
②如果在t3时增加CO2的量,t4时反应又处于新平衡状态,请在上图画出t3~ t5时间段的v逆变化曲线。_________________
(1)写出并配平上述过程的化学方程式
(2)该反应中,盐酸体现了
(3)世界卫生组织(WHO)将二氧化氯(ClO2)列为A级高效、安全灭菌消毒剂,工业上ClO2常用NaClO3和Na2SO3溶液混合,并加H2SO4反应制得,在以上反应中,NaClO3和Na2SO3的物质的量之比为
(4)在一固定容积的密闭容器中进行着反应:CO2(g)+H2(g)
 CO(g)+ H2O(g),其平衡常数K和温度的关系如下:
CO(g)+ H2O(g),其平衡常数K和温度的关系如下:| t0C | 700 | 800 | 900 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
①该反应的正反应为
②平衡常数K表示的意义是
③能判断该反应是否已经达到化学平衡状态的是
a.容器中密度不变
b.混合气体中CO浓度不变
c.v(H2)正= v(H2O)逆
d.c(CO2)= c(CO)
(5)该反应的逆反应速率随时间变化情况如图所示。

①从图可知,在t1时改变了某种反应条件,反应在t2时达到平衡,改变的条件可能是
a.升高温度 b.增大CO2的浓度
c.减小CO2的浓度 d.使用催化剂
②如果在t3时增加CO2的量,t4时反应又处于新平衡状态,请在上图画出t3~ t5时间段的v逆变化曲线。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】煤的间接液化是煤的综合利用的一种重要方法。首先是煤燃烧生成 ,再在钼系催化剂的催化作用下与
,再在钼系催化剂的催化作用下与 反应,最终生成
反应,最终生成 过程中主要发生如下反应:
过程中主要发生如下反应:
反应Ⅰ: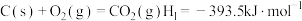
反应Ⅱ: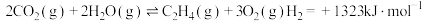
反应Ⅲ: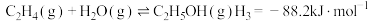
1.已知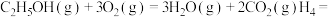
___________ 。
2.反应Ⅰ中属于共价化合物的电子式:___________ 。
为更好地研究煤的液化过程,某学习小组对反应Ⅱ进行了系统的研究。在一个 的恒容容器中加入
的恒容容器中加入 气体及
气体及 水蒸气,在
水蒸气,在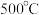 及钼系催化剂(固体)存在条件下只发生反应Ⅱ。
及钼系催化剂(固体)存在条件下只发生反应Ⅱ。
3.下列不能说明该反应已达到平衡状态的有___________(填标号)。
4.如图为四种组分的平衡时物质的量分数随温度的变化曲线。图中曲线 表示的物质是
表示的物质是___________ ,原因是___________ 。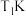 时,某同学在该容器中加入
时,某同学在该容器中加入 和
和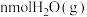 ,同时加入了
,同时加入了 和
和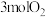 ,达到平衡后各组分体积分数仍与图中所示相同,则
,达到平衡后各组分体积分数仍与图中所示相同,则
___________ (用含 的代数式表示)。
的代数式表示)。
 ,再在钼系催化剂的催化作用下与
,再在钼系催化剂的催化作用下与 反应,最终生成
反应,最终生成 过程中主要发生如下反应:
过程中主要发生如下反应:反应Ⅰ:
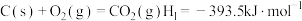
反应Ⅱ:
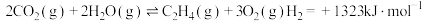
反应Ⅲ:
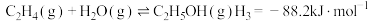
1.已知
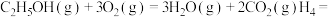
2.反应Ⅰ中属于共价化合物的电子式:
为更好地研究煤的液化过程,某学习小组对反应Ⅱ进行了系统的研究。在一个
 的恒容容器中加入
的恒容容器中加入 气体及
气体及 水蒸气,在
水蒸气,在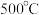 及钼系催化剂(固体)存在条件下只发生反应Ⅱ。
及钼系催化剂(固体)存在条件下只发生反应Ⅱ。3.下列不能说明该反应已达到平衡状态的有___________(填标号)。
A. 的体积分数不再改变 的体积分数不再改变 | B.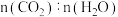 不再改变 不再改变 |
| C.容器的总压不再改变 | D.容器中气体的密度不再改变 |
 表示的物质是
表示的物质是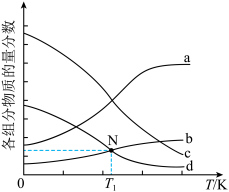
 时,某同学在该容器中加入
时,某同学在该容器中加入 和
和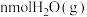 ,同时加入了
,同时加入了 和
和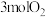 ,达到平衡后各组分体积分数仍与图中所示相同,则
,达到平衡后各组分体积分数仍与图中所示相同,则
 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
【推荐3】SO2、NOx等在大气中会形成酸雨,其排放与工业燃烧煤、石油等化石燃料有很大的关系,所以对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝
(1)催化剂存在下,H2还原NO2生成水蒸气和另一种无毒气体的化学方程式为___ 。
Ⅱ.脱碳
一定条件下CO2会和H2反应合成CH3OH。方程式为: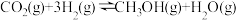 。现向2L恒容密闭容器中加入1molCO2,3molH2,在恒温下发生反应。10s后反应达到平衡,此时容器内CH3OH的浓度为0.2mol·L-1,请回答以下问题:
。现向2L恒容密闭容器中加入1molCO2,3molH2,在恒温下发生反应。10s后反应达到平衡,此时容器内CH3OH的浓度为0.2mol·L-1,请回答以下问题:
(2)前10s内的平均反应速率v(H2O)=____ ;平衡时c(H2)=____ mol·L-1。
(3)其它条件不变的情况下,在10s时往容器中再加入一定量H2,此时该反应正向速率将___ (填“增大”或“减小”或“不变”)。
(4)下列叙述能说明原反应达到平衡状态的是__ 。
A.正逆反应速率相等
B.CO2和H2的物质的量之比为1:3
C.单位时间内消耗nmolCH3OH的同时生成nmolCO2
D.容器内压强保持不变
Ⅲ.脱硫
(5)利用如图所示装置用原电池原理将SO2转化为重要的化工原料,A、B是惰性电极,A极是___ (填“正”或“负”)极,B极的电极反应式为___ 。

Ⅰ.脱硝
(1)催化剂存在下,H2还原NO2生成水蒸气和另一种无毒气体的化学方程式为
Ⅱ.脱碳
一定条件下CO2会和H2反应合成CH3OH。方程式为:
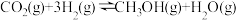 。现向2L恒容密闭容器中加入1molCO2,3molH2,在恒温下发生反应。10s后反应达到平衡,此时容器内CH3OH的浓度为0.2mol·L-1,请回答以下问题:
。现向2L恒容密闭容器中加入1molCO2,3molH2,在恒温下发生反应。10s后反应达到平衡,此时容器内CH3OH的浓度为0.2mol·L-1,请回答以下问题:(2)前10s内的平均反应速率v(H2O)=
(3)其它条件不变的情况下,在10s时往容器中再加入一定量H2,此时该反应正向速率将
(4)下列叙述能说明原反应达到平衡状态的是
A.正逆反应速率相等
B.CO2和H2的物质的量之比为1:3
C.单位时间内消耗nmolCH3OH的同时生成nmolCO2
D.容器内压强保持不变
Ⅲ.脱硫
(5)利用如图所示装置用原电池原理将SO2转化为重要的化工原料,A、B是惰性电极,A极是

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】100kPa时,反应 中NO的平衡转化率与温度的关系如图中曲线所示,回答下列问题。
中NO的平衡转化率与温度的关系如图中曲线所示,回答下列问题。
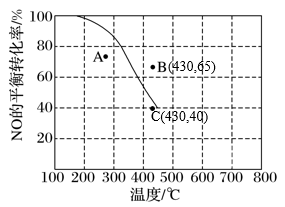
(1)100kPa时,200~500℃温度范围内,NO平衡转化率随温度变化情况可描述为___________ ,该反应的反应热
___________ 0(填“>”、“<”、“=”或“无法确定”)。
(2)根据图示和所学知识,该反应发生的最佳条件为___________ 。
(3)图中A、B、C三点表示不同压强或温度下, 达到平衡时NO的转化率,三个点对应的压强PA、PB、PC由大到小的顺序是
达到平衡时NO的转化率,三个点对应的压强PA、PB、PC由大到小的顺序是___________ ,判断PB、PC大小关系的理由是___________ 。平衡常数KA、KB、KC的大小关系是___________ 。
(4)某温度时,在1L容器中充入2molNO和1molO2,发生反应 ,若其平衡转化率为40%,计算平衡常数K?(写出计算过程,结果保留两位有效数字)。
,若其平衡转化率为40%,计算平衡常数K?(写出计算过程,结果保留两位有效数字)。___________
 中NO的平衡转化率与温度的关系如图中曲线所示,回答下列问题。
中NO的平衡转化率与温度的关系如图中曲线所示,回答下列问题。
(1)100kPa时,200~500℃温度范围内,NO平衡转化率随温度变化情况可描述为

(2)根据图示和所学知识,该反应发生的最佳条件为
(3)图中A、B、C三点表示不同压强或温度下,
 达到平衡时NO的转化率,三个点对应的压强PA、PB、PC由大到小的顺序是
达到平衡时NO的转化率,三个点对应的压强PA、PB、PC由大到小的顺序是(4)某温度时,在1L容器中充入2molNO和1molO2,发生反应
 ,若其平衡转化率为40%,计算平衡常数K?(写出计算过程,结果保留两位有效数字)。
,若其平衡转化率为40%,计算平衡常数K?(写出计算过程,结果保留两位有效数字)。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】“碳中和”引起社会的高度重视,正成为科学家研究的重要课题。CO2催化加氢合成二甲醚(CH3OCH3)涉及的反应如下:
反应Ⅰ:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)ΔH1
CH3OCH3(g)+3H2O(g)ΔH1
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g)ΔH2=+41.2kJ/mol
CO(g)+H2O(g)ΔH2=+41.2kJ/mol
回答下列问题:
(1)二甲醚也可通过煤液化过程获得,该过程是_______ (填“物理”或“化学”)变化。
(2)已知2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)ΔH3=-205.4kJ/mol,则ΔH1=
CH3OCH3(g)+H2O(g)ΔH3=-205.4kJ/mol,则ΔH1=_______ 。
(3)在恒温恒容密闭容器中充入一定量的CO2和H2,发生上述反应。下列能说明反应Ⅰ达到平衡状态的是_______ 。
a.2v正(CO2)=v逆(CH3OCH3)b.容器内气体的密度不再发生变化
c.容器内的压强不再发生变化d.容器内气体平均相对分子质量不再变化
(4)一定温度下,向体积为1L的恒容密闭容器中通入1molCO2和2molH2发生上述反应。当反应均达到平衡时,CO2的转化率为50%,CH3OCH3选择性为80%,则此时H2O(g)的浓度为_______ mol·L-1,反应Ⅱ的平衡常数为_______ 。(CH3OCH3选择性=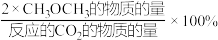 )
)
(5)在恒压、CO2和H2的起始量一定时,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如下图所示。

CH3OCH3的选择性随温度升高而降低的原因是_______ 。
(6)二甲醚可用作燃料电池,若电解质溶液呈碱性,二甲醚燃料电池的负极电极反应式为_______ 。
反应Ⅰ:2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g)ΔH1
CH3OCH3(g)+3H2O(g)ΔH1反应Ⅱ:CO2(g)+H2(g)
 CO(g)+H2O(g)ΔH2=+41.2kJ/mol
CO(g)+H2O(g)ΔH2=+41.2kJ/mol回答下列问题:
(1)二甲醚也可通过煤液化过程获得,该过程是
(2)已知2CO(g)+4H2(g)
 CH3OCH3(g)+H2O(g)ΔH3=-205.4kJ/mol,则ΔH1=
CH3OCH3(g)+H2O(g)ΔH3=-205.4kJ/mol,则ΔH1=(3)在恒温恒容密闭容器中充入一定量的CO2和H2,发生上述反应。下列能说明反应Ⅰ达到平衡状态的是
a.2v正(CO2)=v逆(CH3OCH3)b.容器内气体的密度不再发生变化
c.容器内的压强不再发生变化d.容器内气体平均相对分子质量不再变化
(4)一定温度下,向体积为1L的恒容密闭容器中通入1molCO2和2molH2发生上述反应。当反应均达到平衡时,CO2的转化率为50%,CH3OCH3选择性为80%,则此时H2O(g)的浓度为
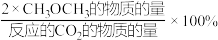 )
)(5)在恒压、CO2和H2的起始量一定时,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如下图所示。

CH3OCH3的选择性随温度升高而降低的原因是
(6)二甲醚可用作燃料电池,若电解质溶液呈碱性,二甲醚燃料电池的负极电极反应式为
您最近一年使用:0次
【推荐3】目前工业合成氨的原理是N2(g)+3H2(g) 2NH3(g) △H=-93.0kJ·mol-1
2NH3(g) △H=-93.0kJ·mol-1
(1)已知一定条件下:2N2(g)+6H2O(l) 4NH3(g)+3O2(g) △H=+l 530.0kJ·mol一1。则氢气燃烧热的热化学方程式为
4NH3(g)+3O2(g) △H=+l 530.0kJ·mol一1。则氢气燃烧热的热化学方程式为___ 。
(2)如图,在恒温恒容装置中进行合成氨反应。

①表示N2浓度变化的曲线是____ 。
②前25min内,用H2浓度变化表示的化学反应速率是____ 。
③在25min末刚好平衡,则平衡常数K=____ 。
(3)在恒温恒压装置中进行工业合成氨反应,下列说法正确的是___ 。
A.气体体积不再变化,则已平衡
B.气体密度不再变化,尚未平衡
C.平衡后,往装置中通入一定量Ar,压强不变,平衡不移动
D.平衡后,压缩容器,生成更多NH3
(4)电厂烟气脱氮的主反应①:4NH3(g)+6NO(l) 5N2(g)+6H2O(g) △H<0,副反应②:2NH3(g)+8NO(g)
5N2(g)+6H2O(g) △H<0,副反应②:2NH3(g)+8NO(g) 5N2O(g)+3H2O(g)△H>0。平衡混合气中N2与N2O含量与温度的关系如图。
5N2O(g)+3H2O(g)△H>0。平衡混合气中N2与N2O含量与温度的关系如图。

请回答:在400~600K时,平衡混合气中N2含量随温度的变化规律是___ ,导致这种规律的原因是___ (任答合理的一条原因)。
(5)直接供氨式燃料电池是以NaOH溶液为电解质溶液,电池反应为4NH3(g)+3O2=2N2+6H2O。则负极电极反应式为___ 。
 2NH3(g) △H=-93.0kJ·mol-1
2NH3(g) △H=-93.0kJ·mol-1(1)已知一定条件下:2N2(g)+6H2O(l)
 4NH3(g)+3O2(g) △H=+l 530.0kJ·mol一1。则氢气燃烧热的热化学方程式为
4NH3(g)+3O2(g) △H=+l 530.0kJ·mol一1。则氢气燃烧热的热化学方程式为(2)如图,在恒温恒容装置中进行合成氨反应。

①表示N2浓度变化的曲线是
②前25min内,用H2浓度变化表示的化学反应速率是
③在25min末刚好平衡,则平衡常数K=
(3)在恒温恒压装置中进行工业合成氨反应,下列说法正确的是
A.气体体积不再变化,则已平衡
B.气体密度不再变化,尚未平衡
C.平衡后,往装置中通入一定量Ar,压强不变,平衡不移动
D.平衡后,压缩容器,生成更多NH3
(4)电厂烟气脱氮的主反应①:4NH3(g)+6NO(l)
 5N2(g)+6H2O(g) △H<0,副反应②:2NH3(g)+8NO(g)
5N2(g)+6H2O(g) △H<0,副反应②:2NH3(g)+8NO(g) 5N2O(g)+3H2O(g)△H>0。平衡混合气中N2与N2O含量与温度的关系如图。
5N2O(g)+3H2O(g)△H>0。平衡混合气中N2与N2O含量与温度的关系如图。
请回答:在400~600K时,平衡混合气中N2含量随温度的变化规律是
(5)直接供氨式燃料电池是以NaOH溶液为电解质溶液,电池反应为4NH3(g)+3O2=2N2+6H2O。则负极电极反应式为
您最近一年使用:0次



