名校
1 .  与
与 是大气主要污染物,需要经过净化处理后才能排放。
是大气主要污染物,需要经过净化处理后才能排放。
(1)汽车发动机工作时会引发 和
和 反应生成NO,其反应过程中的能量变化如表:
反应生成NO,其反应过程中的能量变化如表:
则
_______ (填“>”或“<”)。
(2) 催化还原氨氧化物是目前应用广泛的烟气氨氧化物脱除技术,如用
催化还原氨氧化物是目前应用广泛的烟气氨氧化物脱除技术,如用 还原NO的反应为:
还原NO的反应为:
 。
。
①实验分别测得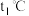 、
、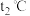 时NO的百分含量随时间变化关系如图所示,分析图象可得出该反应的
时NO的百分含量随时间变化关系如图所示,分析图象可得出该反应的
_______ 0(填“>”或“<”)。
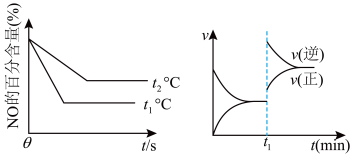
②一定条件下该可逆反应达到平衡后, 时刻改变某个外界条件,正反应的速率
时刻改变某个外界条件,正反应的速率 、逆反应的速率
、逆反应的速率 变化情况如图所示,则
变化情况如图所示,则 时刻改变的外界条件可能是
时刻改变的外界条件可能是_______ 。
(3)利用电化学联合处理法可实现 和NO同时除去,工作原理如图所示:
和NO同时除去,工作原理如图所示:

①阳极的电极反应式为_______ 。
②若工作前后阴极室成分不变,被处理的 和NO在相同条件下体积比
和NO在相同条件下体积比
_______ 。
 与
与 是大气主要污染物,需要经过净化处理后才能排放。
是大气主要污染物,需要经过净化处理后才能排放。(1)汽车发动机工作时会引发
 和
和 反应生成NO,其反应过程中的能量变化如表:
反应生成NO,其反应过程中的能量变化如表:| 反应 |  |  |  |
| 反应热 |  |  |  |

(2)
 催化还原氨氧化物是目前应用广泛的烟气氨氧化物脱除技术,如用
催化还原氨氧化物是目前应用广泛的烟气氨氧化物脱除技术,如用 还原NO的反应为:
还原NO的反应为:
 。
。①实验分别测得
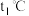 、
、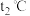 时NO的百分含量随时间变化关系如图所示,分析图象可得出该反应的
时NO的百分含量随时间变化关系如图所示,分析图象可得出该反应的

②一定条件下该可逆反应达到平衡后,
 时刻改变某个外界条件,正反应的速率
时刻改变某个外界条件,正反应的速率 、逆反应的速率
、逆反应的速率 变化情况如图所示,则
变化情况如图所示,则 时刻改变的外界条件可能是
时刻改变的外界条件可能是(3)利用电化学联合处理法可实现
 和NO同时除去,工作原理如图所示:
和NO同时除去,工作原理如图所示:
①阳极的电极反应式为
②若工作前后阴极室成分不变,被处理的
 和NO在相同条件下体积比
和NO在相同条件下体积比
您最近一年使用:0次
2 . 铬是电镀、制革和颜料等工业废水中的主要重金属污染物。在水溶液中,Cr(III)以Cr3+形态存在;Cr(VI)主要以 、HCrO
、HCrO 和
和 形态存在,其毒性是Cr(III)的100倍。处理含Cr(VI)废水的常用方法是先将其转化为Cr(III),再进一步将Cr3+转化为Cr(OH)3沉淀,减少水体中总Cr含量。已知:NaBH4是强还原剂,可与水发生反应NaBH4+4H2O=NaB(OH)4+4H2 ΔH>0。
形态存在,其毒性是Cr(III)的100倍。处理含Cr(VI)废水的常用方法是先将其转化为Cr(III),再进一步将Cr3+转化为Cr(OH)3沉淀,减少水体中总Cr含量。已知:NaBH4是强还原剂,可与水发生反应NaBH4+4H2O=NaB(OH)4+4H2 ΔH>0。
(1)“NaBH4”可用于直接还原去除废水中的 ,反应时消耗大量H+。废水的初始pH对去除溶液中的Cr(VI)和总Cr的影响关系如图1所示。
,反应时消耗大量H+。废水的初始pH对去除溶液中的Cr(VI)和总Cr的影响关系如图1所示。

①废水初始pH=2.5时, 和
和 反应生成Cr3+、H3BO3和氢气,最终溶液的pH约为9,反应生成的Cr3+转化为Cr(OH)3沉淀得到有效去除。写出反应生成Cr3+的离子方程式
反应生成Cr3+、H3BO3和氢气,最终溶液的pH约为9,反应生成的Cr3+转化为Cr(OH)3沉淀得到有效去除。写出反应生成Cr3+的离子方程式___________ 。
②废水初始pH=2时,虽然Cr(VI)的去除率达到100%,但总Cr的去除率为0.0%,其原因是___________ 。
③废水初始pH>2.5时,随着初始pH的增大,Cr(VI)的去除率逐渐下降的原因可能是______ 。
(2)当n(NaBH4)相同时,使用“NaBH4”和“FeCl3/NaBH4”体系分别处理废水中的 。
。
①当废水初始pH在3.5~5.5间,“FeCl3/NaBH4”体系中Cr(VI)和总Cr的去除率均接近100%,明显高于“NaBH4”体系,其原因是___________ 。
②温度对“FeCl3/NaBH4”去除Cr(Ⅵ)的影响关系如图2所示。当温度高于313K时,Cr(VI)的去除率随温度升高逐渐下降,其原因是___________ 。
 、HCrO
、HCrO 和
和 形态存在,其毒性是Cr(III)的100倍。处理含Cr(VI)废水的常用方法是先将其转化为Cr(III),再进一步将Cr3+转化为Cr(OH)3沉淀,减少水体中总Cr含量。已知:NaBH4是强还原剂,可与水发生反应NaBH4+4H2O=NaB(OH)4+4H2 ΔH>0。
形态存在,其毒性是Cr(III)的100倍。处理含Cr(VI)废水的常用方法是先将其转化为Cr(III),再进一步将Cr3+转化为Cr(OH)3沉淀,减少水体中总Cr含量。已知:NaBH4是强还原剂,可与水发生反应NaBH4+4H2O=NaB(OH)4+4H2 ΔH>0。(1)“NaBH4”可用于直接还原去除废水中的
 ,反应时消耗大量H+。废水的初始pH对去除溶液中的Cr(VI)和总Cr的影响关系如图1所示。
,反应时消耗大量H+。废水的初始pH对去除溶液中的Cr(VI)和总Cr的影响关系如图1所示。
①废水初始pH=2.5时,
 和
和 反应生成Cr3+、H3BO3和氢气,最终溶液的pH约为9,反应生成的Cr3+转化为Cr(OH)3沉淀得到有效去除。写出反应生成Cr3+的离子方程式
反应生成Cr3+、H3BO3和氢气,最终溶液的pH约为9,反应生成的Cr3+转化为Cr(OH)3沉淀得到有效去除。写出反应生成Cr3+的离子方程式②废水初始pH=2时,虽然Cr(VI)的去除率达到100%,但总Cr的去除率为0.0%,其原因是
③废水初始pH>2.5时,随着初始pH的增大,Cr(VI)的去除率逐渐下降的原因可能是
(2)当n(NaBH4)相同时,使用“NaBH4”和“FeCl3/NaBH4”体系分别处理废水中的
 。
。①当废水初始pH在3.5~5.5间,“FeCl3/NaBH4”体系中Cr(VI)和总Cr的去除率均接近100%,明显高于“NaBH4”体系,其原因是
②温度对“FeCl3/NaBH4”去除Cr(Ⅵ)的影响关系如图2所示。当温度高于313K时,Cr(VI)的去除率随温度升高逐渐下降,其原因是
您最近一年使用:0次
名校
解题方法
3 . CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。请回答下列问题:
I.工业上可以利用CO2和H2合成CH3OH:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH<0。该反应在起始温度和体积均相同(T℃、1L)的两个密闭容器中分别进行,反应物起始物质的量见下表:
(1)达到平衡时,反应a,b对比:CO2的体积分数φ(a)_______ φ(b)(填“>”、“<”或“=”))。
(2)下列能说明反应a达到平衡状态的是_______ (填字母)。
A.v正(CO2)=3v逆(H2)
B.混合气体的平均摩尔质量不再改变
C.c(CH3OH)=c(H2O)
D.容器内压强不再改变
II.我国科学家研究了不同反应温度对含碳产物组成的影响。
已知:反应1:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ΔH<0
反应2:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH>0
在密闭容器中通入3mol的的H2和1mol的CO2,分别在1MPa和10MPa下进行反应。实验中对平衡体系组成的三种物质(CO2、CO、CH4)进行分析,其中温度对CO和CH4的影响如图所示。
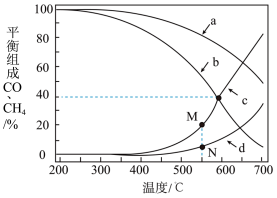
(3)1MPa时,表示CH4和CO平衡组成随温度变化关系的曲线分别是_______ 和_______ 。M点平衡组成含量高于N点的原因是_______ 。
(4)图中当CH4和CO平衡组成均为40%时,若容器的体积为1L,该温度下反应1的平衡常数K的值为_______ 。
III.在T1时,向体积为2L的恒容容器中充入物质的量之和为3mol的的CO和H2,发生反应CO(g)+2H2(g) ⇌ CH3OH(g),反应达到平衡时CH3OH(g)的体积分数(φ)与n(H2)/n(CO)的关系如下图所示。
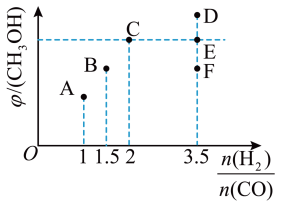
(5)当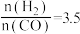 时,达到平衡后,CH3OH的体积分数可能是图象中的
时,达到平衡后,CH3OH的体积分数可能是图象中的_______ (填“D”、“E”或“F”)点。
(6) =
=_______ 时,CH3OH的体积分数最大。
I.工业上可以利用CO2和H2合成CH3OH:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH<0。该反应在起始温度和体积均相同(T℃、1L)的两个密闭容器中分别进行,反应物起始物质的量见下表:
| CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应a(恒温恒容) | 1 | 3 | 0 | 0 |
| 反应b(绝热恒容) | 0 | 0 | 1 | 1 |
(2)下列能说明反应a达到平衡状态的是
A.v正(CO2)=3v逆(H2)
B.混合气体的平均摩尔质量不再改变
C.c(CH3OH)=c(H2O)
D.容器内压强不再改变
II.我国科学家研究了不同反应温度对含碳产物组成的影响。
已知:反应1:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ΔH<0
反应2:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH>0
在密闭容器中通入3mol的的H2和1mol的CO2,分别在1MPa和10MPa下进行反应。实验中对平衡体系组成的三种物质(CO2、CO、CH4)进行分析,其中温度对CO和CH4的影响如图所示。

(3)1MPa时,表示CH4和CO平衡组成随温度变化关系的曲线分别是
(4)图中当CH4和CO平衡组成均为40%时,若容器的体积为1L,该温度下反应1的平衡常数K的值为
III.在T1时,向体积为2L的恒容容器中充入物质的量之和为3mol的的CO和H2,发生反应CO(g)+2H2(g) ⇌ CH3OH(g),反应达到平衡时CH3OH(g)的体积分数(φ)与n(H2)/n(CO)的关系如下图所示。

(5)当
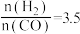 时,达到平衡后,CH3OH的体积分数可能是图象中的
时,达到平衡后,CH3OH的体积分数可能是图象中的(6)
 =
=
您最近一年使用:0次
2021-03-04更新
|
819次组卷
|
4卷引用:江苏省扬州中学2021-2022学年高二上学期期中考试化学试题
江苏省扬州中学2021-2022学年高二上学期期中考试化学试题吉林省延边州2021届高三下学期教学质量检测(2月底) 理综化学试题(已下线)第21讲 化学平衡状态 化学平衡的移动(精练)-2022年高考化学一轮复习讲练测(已下线)第21讲 化学平衡状态 化学平衡的移动(练)-2023年高考化学一轮复习讲练测(全国通用)
名校
4 . T℃时,在体积为2L的恒容密闭容器中A气体与B气体反应生成C气体,反应过程中A、B、C物质的量的变化如下图a所示;若保持其他条件不变,温度分别为T1和T2时,B的体积百分含量与时间的关系如下图b所示。

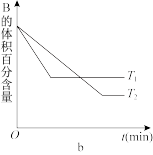
(1)从反应开始到平衡,A的平均反应速率v(A)=_____ mol/(L∙min);
(2)该反应的平衡常数表达式为___ ;为使该反应的平衡常数变大,可以采取的措施是___ 。
(3)上述反应的正反应____ (填“放热”或“吸热”);
(4)在此容器中,判断该反应达到平衡状态的标志是___ 。(填字母)
a.A和B的浓度相等 b.C的百分含量保持不变 c.容器中气体的压强不变 d.C的生成速率与C的消耗速率相等 e.容器中混合气体的密度保持不变
(5)T℃时,若在同一容器中加入2molC,达平衡后体系中各物质的百分含量与图a中的平衡状态相同,则需再加入A、B的物质的量分别为____ 、____ 。


(1)从反应开始到平衡,A的平均反应速率v(A)=
(2)该反应的平衡常数表达式为
(3)上述反应的正反应
(4)在此容器中,判断该反应达到平衡状态的标志是
a.A和B的浓度相等 b.C的百分含量保持不变 c.容器中气体的压强不变 d.C的生成速率与C的消耗速率相等 e.容器中混合气体的密度保持不变
(5)T℃时,若在同一容器中加入2molC,达平衡后体系中各物质的百分含量与图a中的平衡状态相同,则需再加入A、B的物质的量分别为
您最近一年使用:0次



