2022高三·全国·专题练习
解题方法
1 . 顺-1,2-二甲基环丙烷和反-1,2-二甲基环丙烷可发生如下转化:

该反应的速率方程可表示为:v(正)=k(正)c(顺)和v(逆)=k(逆)c(反),k(正)和k(逆)在一定温度时为常数,分别称作正,逆反应速率常数。回答下列问题:
(1)已知:t1温度下,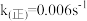 ,
,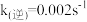 ,该温度下反应的平衡常数值K1=
,该温度下反应的平衡常数值K1=_______ 。
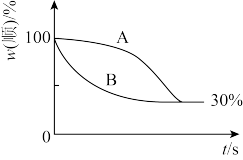
(2)t2温度下,下图中能表示顺式异构体的质量分数随时间变化的曲线是_______ (填曲线编号),平衡常数值K2=_______ 。

该反应的速率方程可表示为:v(正)=k(正)c(顺)和v(逆)=k(逆)c(反),k(正)和k(逆)在一定温度时为常数,分别称作正,逆反应速率常数。回答下列问题:
(1)已知:t1温度下,
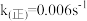 ,
,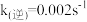 ,该温度下反应的平衡常数值K1=
,该温度下反应的平衡常数值K1=(2)t2温度下,下图中能表示顺式异构体的质量分数随时间变化的曲线是

您最近一年使用:0次
2 . “先拐先平”原则
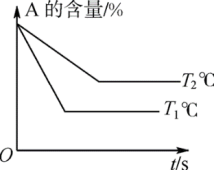
在化学平衡图像中,先出现拐点的反应则先达到平衡,先出现拐点的曲线表示的温度较高(如图1)或表示的压强较大(如图2)[仍以aA(g)+bB(g) cC(g)为例]。
cC(g)为例]。
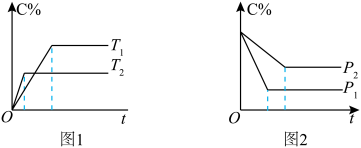
根据图像回答下列问题:
(1)图1中,温度T1、T2的大小关系是___________ ,温度升高,C%(C的含量)的变化是___________ ,化学平衡___________ 移动,正反应是___________ 反应。
(2)图2中,压强p1、p2的大小关系是___________ ,压强增大,C%(C的含量)的变化是___________ ,化学平衡___________ 移动,a+b___________ c。
在化学平衡图像中,先出现拐点的反应则先达到平衡,先出现拐点的曲线表示的温度较高(如图1)或表示的压强较大(如图2)[仍以aA(g)+bB(g)
 cC(g)为例]。
cC(g)为例]。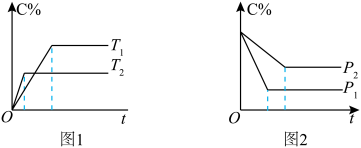
根据图像回答下列问题:
(1)图1中,温度T1、T2的大小关系是
(2)图2中,压强p1、p2的大小关系是
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
3 . 如图所示,甲、乙、丙分别表示在不同条件下,可逆反应A(g)+B(g)⇌xC(g)的生成物C在反应混合物中的百分含量w(C)和反应时间(t)的关系。
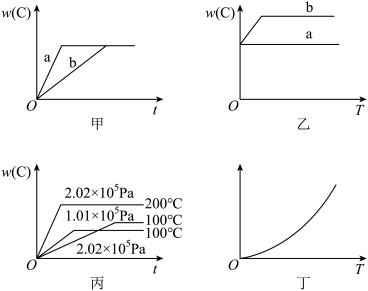
(1)若甲图中两条曲线分别表示有催化剂和无催化剂的情况,则曲线___________ 表示无催化剂时的情况,原因是___________ 。
(2)若乙图表示反应达到平衡后分别在恒温恒压条件下和恒温恒容条件下充入氦气后的情况,则曲线___________ 表示恒温恒容时的情况,原因是___________ 。
(3)根据丙图可以判断该可逆反应的正反应是___________ (填“放”或“吸”)热反应,化学计量数x的值___________ (填“大于”或“小于”)2。
(4)丁图表示在某固定容积的密闭容器中上述可逆反应达到平衡后某物理量随温度(T)的变化情况,根据你的理解,丁图的纵坐标可能是___________ ,原因为___________ 。

(1)若甲图中两条曲线分别表示有催化剂和无催化剂的情况,则曲线
(2)若乙图表示反应达到平衡后分别在恒温恒压条件下和恒温恒容条件下充入氦气后的情况,则曲线
(3)根据丙图可以判断该可逆反应的正反应是
(4)丁图表示在某固定容积的密闭容器中上述可逆反应达到平衡后某物理量随温度(T)的变化情况,根据你的理解,丁图的纵坐标可能是
您最近一年使用:0次
4 . 回答下列问题:
Ⅰ.一定条件下,在容积为 的密闭容器中, A、B、C三种气体的物质的量n随时间t的变化如图所示。已知达到平衡后,降低温度,A的体积分数减小。
的密闭容器中, A、B、C三种气体的物质的量n随时间t的变化如图所示。已知达到平衡后,降低温度,A的体积分数减小。
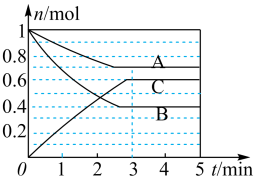
(1)达到平衡后加压,C的含量_______ (填写“变大”“变小”或“不变”)。
(2)该反应的反应速率v随时间t的关系如图所示。
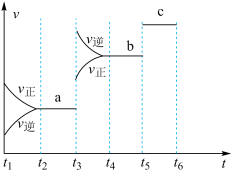
①根据图判断,在 时刻改变的外界条件是
时刻改变的外界条件是_______ 。
②a、b、c对应的平衡状态中,A的转化率最大的是状态_______ 。
Ⅱ.在密闭容器中充入一定量的 ,发生反应
,发生反应
 。如图所示为
。如图所示为 气体分解生成
气体分解生成 和
和 的平衡转化率与温度、压强的关系。
的平衡转化率与温度、压强的关系。

(3)该反应的逆反应是_______ (填“吸热反应”或“放热反应”)。
(4)N点 的体积分数是
的体积分数是_______ 。
(5)M点对应的平衡常数
_______  (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
Ⅰ.一定条件下,在容积为
 的密闭容器中, A、B、C三种气体的物质的量n随时间t的变化如图所示。已知达到平衡后,降低温度,A的体积分数减小。
的密闭容器中, A、B、C三种气体的物质的量n随时间t的变化如图所示。已知达到平衡后,降低温度,A的体积分数减小。
(1)达到平衡后加压,C的含量
(2)该反应的反应速率v随时间t的关系如图所示。

①根据图判断,在
 时刻改变的外界条件是
时刻改变的外界条件是②a、b、c对应的平衡状态中,A的转化率最大的是状态
Ⅱ.在密闭容器中充入一定量的
 ,发生反应
,发生反应
 。如图所示为
。如图所示为 气体分解生成
气体分解生成 和
和 的平衡转化率与温度、压强的关系。
的平衡转化率与温度、压强的关系。
(3)该反应的逆反应是
(4)N点
 的体积分数是
的体积分数是(5)M点对应的平衡常数

 (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
您最近一年使用:0次
22-23高二上·新疆哈密·期末
解题方法
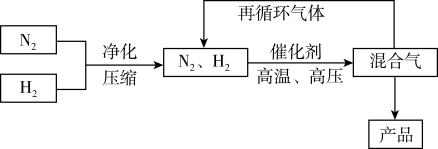
5 . 工业上合成氨是在一定条件下进行反应:N2(g)+3H2(g)  2NH3(g),ΔH=-92.4kJ·mol-1,其部分工艺流程如图所示。
2NH3(g),ΔH=-92.4kJ·mol-1,其部分工艺流程如图所示。
反应体系中各组分的部分性质如下表所示:
回答下列问题:
(1)写出该反应的化学平衡常数表达式:K=___________ 。温度升高,K值___________ (填“增大”“减小”或“不变”)。
(2)K值越大,表明___________(填序号)。
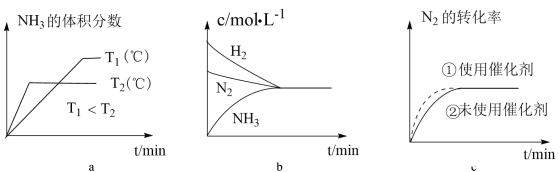
(3)对于合成氨反应而言,如图有关图像一定正确的是___________ (填字母)。
 2NH3(g),ΔH=-92.4kJ·mol-1,其部分工艺流程如图所示。
2NH3(g),ΔH=-92.4kJ·mol-1,其部分工艺流程如图所示。
反应体系中各组分的部分性质如下表所示:
| 气体 | 氮气 | 氢气 | 氨 |
| 熔点/℃ | -210.01 | -259.23 | -77.74 |
| 沸点/℃ | -195.79 | -252.77 | -33.42 |
(1)写出该反应的化学平衡常数表达式:K=
(2)K值越大,表明___________(填序号)。
| A.其他条件相同时N2的转化率越高 |
| B.其他条件相同时NH3的产率越高 |
| C.原料中N2的含量越高 |
| D.化学反应速率越快 |

您最近一年使用:0次
20-21高二下·山东淄博·期中
6 . 在一定条件下,可逆反应mA B+C变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后增大容器内压强的变化情况。
B+C变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后增大容器内压强的变化情况。
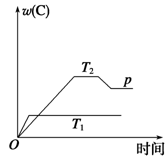
(1)该反应的逆反应为___________ (填“吸热”或“放热”)反应。
(2)若A、B、C均为气体,则m___________ 2(填“大于”、“等于”或“小于”)。
(3)若m=2,则A的状态为___________ 。
(4)当温度和容积不变时,如向平衡体系中加入一定量的某稀有气体,则平衡向___________ (填“正向移动”、“逆向移动” 或“不移动”)。
(5)当温度和压强不变时,如向平衡体系中加入一定量的某稀有气体,平衡向___________ (填“正向移动”、“逆向移动” 或“不移动”)。
 B+C变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后增大容器内压强的变化情况。
B+C变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后增大容器内压强的变化情况。
(1)该反应的逆反应为
(2)若A、B、C均为气体,则m
(3)若m=2,则A的状态为
(4)当温度和容积不变时,如向平衡体系中加入一定量的某稀有气体,则平衡向
(5)当温度和压强不变时,如向平衡体系中加入一定量的某稀有气体,平衡向
您最近一年使用:0次
2021·吉林延边·模拟预测
名校
解题方法
7 . CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。请回答下列问题:
I.工业上可以利用CO2和H2合成CH3OH:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH<0。该反应在起始温度和体积均相同(T℃、1L)的两个密闭容器中分别进行,反应物起始物质的量见下表:
(1)达到平衡时,反应a,b对比:CO2的体积分数φ(a)_______ φ(b)(填“>”、“<”或“=”))。
(2)下列能说明反应a达到平衡状态的是_______ (填字母)。
A.v正(CO2)=3v逆(H2)
B.混合气体的平均摩尔质量不再改变
C.c(CH3OH)=c(H2O)
D.容器内压强不再改变
II.我国科学家研究了不同反应温度对含碳产物组成的影响。
已知:反应1:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ΔH<0
反应2:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH>0
在密闭容器中通入3mol的的H2和1mol的CO2,分别在1MPa和10MPa下进行反应。实验中对平衡体系组成的三种物质(CO2、CO、CH4)进行分析,其中温度对CO和CH4的影响如图所示。
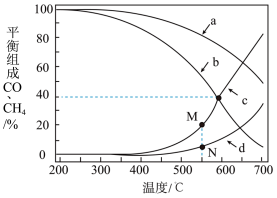
(3)1MPa时,表示CH4和CO平衡组成随温度变化关系的曲线分别是_______ 和_______ 。M点平衡组成含量高于N点的原因是_______ 。
(4)图中当CH4和CO平衡组成均为40%时,若容器的体积为1L,该温度下反应1的平衡常数K的值为_______ 。
III.在T1时,向体积为2L的恒容容器中充入物质的量之和为3mol的的CO和H2,发生反应CO(g)+2H2(g) ⇌ CH3OH(g),反应达到平衡时CH3OH(g)的体积分数(φ)与n(H2)/n(CO)的关系如下图所示。
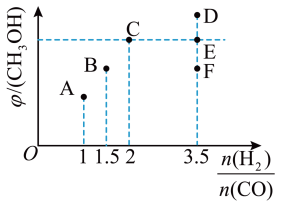
(5)当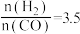 时,达到平衡后,CH3OH的体积分数可能是图象中的
时,达到平衡后,CH3OH的体积分数可能是图象中的_______ (填“D”、“E”或“F”)点。
(6) =
=_______ 时,CH3OH的体积分数最大。
I.工业上可以利用CO2和H2合成CH3OH:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH<0。该反应在起始温度和体积均相同(T℃、1L)的两个密闭容器中分别进行,反应物起始物质的量见下表:
| CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应a(恒温恒容) | 1 | 3 | 0 | 0 |
| 反应b(绝热恒容) | 0 | 0 | 1 | 1 |
(2)下列能说明反应a达到平衡状态的是
A.v正(CO2)=3v逆(H2)
B.混合气体的平均摩尔质量不再改变
C.c(CH3OH)=c(H2O)
D.容器内压强不再改变
II.我国科学家研究了不同反应温度对含碳产物组成的影响。
已知:反应1:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ΔH<0
反应2:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH>0
在密闭容器中通入3mol的的H2和1mol的CO2,分别在1MPa和10MPa下进行反应。实验中对平衡体系组成的三种物质(CO2、CO、CH4)进行分析,其中温度对CO和CH4的影响如图所示。

(3)1MPa时,表示CH4和CO平衡组成随温度变化关系的曲线分别是
(4)图中当CH4和CO平衡组成均为40%时,若容器的体积为1L,该温度下反应1的平衡常数K的值为
III.在T1时,向体积为2L的恒容容器中充入物质的量之和为3mol的的CO和H2,发生反应CO(g)+2H2(g) ⇌ CH3OH(g),反应达到平衡时CH3OH(g)的体积分数(φ)与n(H2)/n(CO)的关系如下图所示。

(5)当
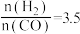 时,达到平衡后,CH3OH的体积分数可能是图象中的
时,达到平衡后,CH3OH的体积分数可能是图象中的(6)
 =
=
您最近一年使用:0次
2021-03-04更新
|
819次组卷
|
4卷引用:第21讲 化学平衡状态 化学平衡的移动(精练)-2022年高考化学一轮复习讲练测
(已下线)第21讲 化学平衡状态 化学平衡的移动(精练)-2022年高考化学一轮复习讲练测江苏省扬州中学2021-2022学年高二上学期期中考试化学试题(已下线)第21讲 化学平衡状态 化学平衡的移动(练)-2023年高考化学一轮复习讲练测(全国通用)吉林省延边州2021届高三下学期教学质量检测(2月底) 理综化学试题
名校
8 . I.可逆反应∶mA(g)+nB(g)⇌pC(g)+qD(s) ∆H,试根据图回答∶
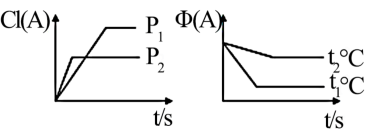
[A的转化率(%)表示为α(A)、A的含量(%)表示为φ(A)]
(1)压强P1_______ P2(填“>”,“<”或“=”下同)
(2)计量数(m+n)_______ (p)
(3)温度t1℃_______ t2℃
(4)ΔH_______ 0
II.反应A(g)+B(g)⇌C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
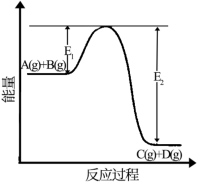
(5)该反应是_______ 反应(填“吸热”,“放热”);
(6)当反应达到平衡时,只升高温度,化学平衡向_______ (填“正反应方向”或“逆反应方向”)移动。
(7)反应体系中加入催化剂该反应的反应热_______ (填增大”“减小”“不变”);

[A的转化率(%)表示为α(A)、A的含量(%)表示为φ(A)]
(1)压强P1
(2)计量数(m+n)
(3)温度t1℃
(4)ΔH
II.反应A(g)+B(g)⇌C(g)+D(g)过程中的能量变化如图所示,回答下列问题。

(5)该反应是
(6)当反应达到平衡时,只升高温度,化学平衡向
(7)反应体系中加入催化剂该反应的反应热
您最近一年使用:0次
2021-09-15更新
|
567次组卷
|
4卷引用:新疆乌鲁木齐市第二十中学2019-2020学年高二上学期期中考试化学试题
新疆乌鲁木齐市第二十中学2019-2020学年高二上学期期中考试化学试题安徽省合肥新城高升学校2021-2022学年高二上学期第一次月考化学试题(已下线)2.2.3 浓度、压强对化学平衡的影响-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)(已下线)第10讲 影响化学平衡的因素(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)
2020高三·全国·专题练习
解题方法
9 . (1)可逆反应:aA(g)+bB(g) cC(g)+dD(g) ΔH=Q。根据如图回答:
cC(g)+dD(g) ΔH=Q。根据如图回答:
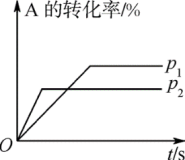
①p1___ p2;②a+b___ c+d;③T1___ T2;④ΔH___ 0。
(2)可逆反应:2A(g)+B(g) 2C(g) ΔH=Q,平衡时C的百分含量、B的转化率与温度、压强的关系满足如图,根据图象回答:
2C(g) ΔH=Q,平衡时C的百分含量、B的转化率与温度、压强的关系满足如图,根据图象回答:
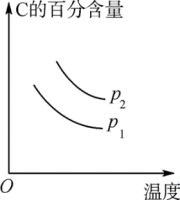
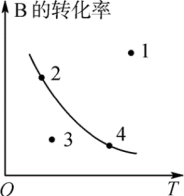
①p1___ p2;②ΔH___ 0。③图中标出的1、2、3、4四个点表示 (正)>
(正)> (逆)的点是
(逆)的点是___ 。
(3)某密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g) ΔH<0。如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。
2Z(g) ΔH<0。如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。
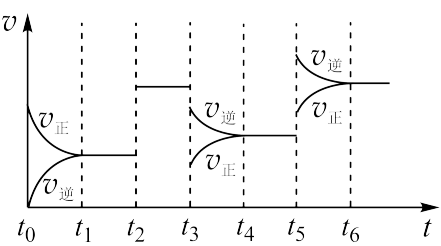
①t2、t3、t5时刻改变的条件依次是___ 、___ 、___ 。
②Z的百分含量最低的时间是___ 。
(4)将物质的量均为3.00mol的物质A、B混合于5L容器中,发生如下反应:3A+B 2C。在反应过程中C的物质的量分数随温度变化如图所示:
2C。在反应过程中C的物质的量分数随温度变化如图所示:
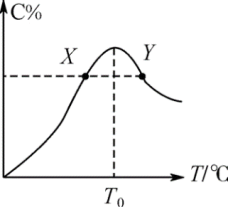
①T0对应的反应速率 (正)
(正)___ (填“>”、“<”或“=”) (逆)。
(逆)。
②此反应的正反应为___ (填“吸”或“放”)热反应。
(5)在一容积为2L的恒容密闭容器内加入0.4molA和0.6molB,一定条件下发生反应2A(g)+B(g) 2C(g),反应中C的物质的量浓度变化情况如图。
2C(g),反应中C的物质的量浓度变化情况如图。
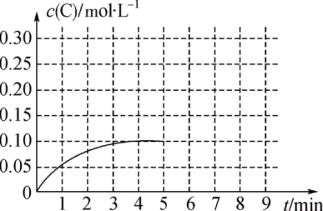
在第5min时,将容器的体积缩小一半后,若在第8min达到新的平衡时A的总转化率为75%,请在图中画出第5min到新平衡时C的物质的量浓度的变化曲线___ 。
 cC(g)+dD(g) ΔH=Q。根据如图回答:
cC(g)+dD(g) ΔH=Q。根据如图回答:

①p1
(2)可逆反应:2A(g)+B(g)
 2C(g) ΔH=Q,平衡时C的百分含量、B的转化率与温度、压强的关系满足如图,根据图象回答:
2C(g) ΔH=Q,平衡时C的百分含量、B的转化率与温度、压强的关系满足如图,根据图象回答:

①p1
 (正)>
(正)> (逆)的点是
(逆)的点是(3)某密闭容器中发生如下反应:X(g)+3Y(g)
 2Z(g) ΔH<0。如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。
2Z(g) ΔH<0。如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。
①t2、t3、t5时刻改变的条件依次是
②Z的百分含量最低的时间是
(4)将物质的量均为3.00mol的物质A、B混合于5L容器中,发生如下反应:3A+B
 2C。在反应过程中C的物质的量分数随温度变化如图所示:
2C。在反应过程中C的物质的量分数随温度变化如图所示:
①T0对应的反应速率
 (正)
(正) (逆)。
(逆)。②此反应的正反应为
(5)在一容积为2L的恒容密闭容器内加入0.4molA和0.6molB,一定条件下发生反应2A(g)+B(g)
 2C(g),反应中C的物质的量浓度变化情况如图。
2C(g),反应中C的物质的量浓度变化情况如图。
在第5min时,将容器的体积缩小一半后,若在第8min达到新的平衡时A的总转化率为75%,请在图中画出第5min到新平衡时C的物质的量浓度的变化曲线
您最近一年使用:0次
10 . 氨是化肥工业和化工生产的主要原料,工业合成氨使用的氢气主要来自合成气( ,
, 混合气体)。回答下列问题:
混合气体)。回答下列问题:
(1)合成氨的热化学方程式为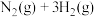


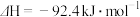 ,升高温度,合成氨反应的平衡常数
,升高温度,合成氨反应的平衡常数_______ (填“增大”“不变”或“减小”)。理论上,为了增大平衡时 的转化率,可采取的措施是
的转化率,可采取的措施是_____ (填字母)。
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物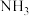
(2)合成氨的原料 可通过反应
可通过反应

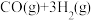
 来获取,已知该反应中,当初始混合气中的
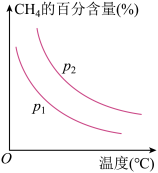
来获取,已知该反应中,当初始混合气中的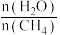 恒定时,温度、压强对平衡混合气中
恒定时,温度、压强对平衡混合气中 的百分含量的影响如图所示:
的百分含量的影响如图所示:
图中两条曲线表示压强的关系是:
________  (填“>”“<”或“=”下同),
(填“>”“<”或“=”下同),
________ 0。
(3) 的另外一个反应为
的另外一个反应为

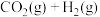
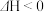 ,一定条件下,反应达到平衡后,采取
,一定条件下,反应达到平衡后,采取______________ 措施可提高 的转化率。
的转化率。
 ,
, 混合气体)。回答下列问题:
混合气体)。回答下列问题:(1)合成氨的热化学方程式为
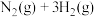


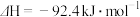 ,升高温度,合成氨反应的平衡常数
,升高温度,合成氨反应的平衡常数 的转化率,可采取的措施是
的转化率,可采取的措施是a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物
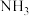
(2)合成氨的原料
 可通过反应
可通过反应

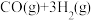
 来获取,已知该反应中,当初始混合气中的
来获取,已知该反应中,当初始混合气中的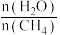 恒定时,温度、压强对平衡混合气中
恒定时,温度、压强对平衡混合气中 的百分含量的影响如图所示:
的百分含量的影响如图所示:图中两条曲线表示压强的关系是:

 (填“>”“<”或“=”下同),
(填“>”“<”或“=”下同),

(3)
 的另外一个反应为
的另外一个反应为

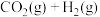
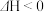 ,一定条件下,反应达到平衡后,采取
,一定条件下,反应达到平衡后,采取 的转化率。
的转化率。
您最近一年使用:0次



