1 . 请按要求回答下列问题:
(1)将100mL 0.3mol·L-1的NaHSO4溶液和100mL 0.2mol·L-1的Ba(OH)2溶液充分混合,写出所发生反应的离子方程式:____________________________ ;
若向反应后的溶液中滴加2-3滴酚酞试液,则溶液的颜色变为__________________ ;
(2)某温度时,水的离子积常数KW=10-13,将此温度下pH=11的Ba(OH)2溶液aL与pH=1的H2SO4溶液bL混合,设混合溶液体积为两者之和,所得固体体积忽略不计。若所得混合溶液为中性,则a:b=_________________
(3)已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,且Ksp(AgX)=1.8×10-10,Ksp(AgY)=1.0×10-12,Ksp(AgZ)=8.7×10-17。则AgX、AgY、AgZ三者的溶解度(mol/L)S(AgX)、S(AgY)、S(AgZ)的大小顺序为:____________________________ ;若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-)________ (填“增大”“减小”或“不变”)。
(1)将100mL 0.3mol·L-1的NaHSO4溶液和100mL 0.2mol·L-1的Ba(OH)2溶液充分混合,写出所发生反应的离子方程式:
若向反应后的溶液中滴加2-3滴酚酞试液,则溶液的颜色变为
(2)某温度时,水的离子积常数KW=10-13,将此温度下pH=11的Ba(OH)2溶液aL与pH=1的H2SO4溶液bL混合,设混合溶液体积为两者之和,所得固体体积忽略不计。若所得混合溶液为中性,则a:b=
(3)已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,且Ksp(AgX)=1.8×10-10,Ksp(AgY)=1.0×10-12,Ksp(AgZ)=8.7×10-17。则AgX、AgY、AgZ三者的溶解度(mol/L)S(AgX)、S(AgY)、S(AgZ)的大小顺序为:
您最近一年使用:0次
名校
2 . 连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。
(1)连二次硝酸中氮元素的化合价为_____________________ 。
(2)常温下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1的H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。
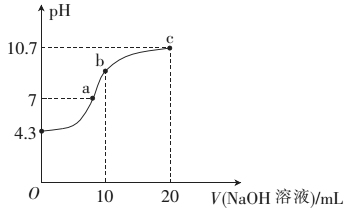
①写出H2N2O2在水溶液中的电离方程式:______________ 。
②b点时溶液中c(H2N2O2)_____ (填“>”、“<”或 “=”,下同)c(N2O22-)。
③a点时溶液中c(Na+)____ c(HN2O2-)+c(N2O22-)。
(3)硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中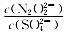 =
=______ 。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
(1)连二次硝酸中氮元素的化合价为
(2)常温下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1的H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。

①写出H2N2O2在水溶液中的电离方程式:
②b点时溶液中c(H2N2O2)
③a点时溶液中c(Na+)
(3)硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中
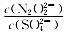 =
=
您最近一年使用:0次
2016-12-09更新
|
816次组卷
|
4卷引用:湖南省长沙浏阳市2019-2020学年高二上学期期末考试化学试题(高考类)
3 . 碱式氧化镍(NiOOH)可用作镍氢电池的正极材料。以含镍(Ni2+)废液为原料生产NiOOH的一种工艺流程如下:

(1)加入Na2CO3溶液时,确认Ni2+已经完全沉淀的实验方法是________________ 。
(2)已知Ksp[Ni(OH)2]=2×10-15,欲使NiSO4溶液中残留c(Ni2+)≤2×10-5 mol·L-1,调节pH的范围是________________ 。
(3)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式:__________________ 。
(4)若加热不充分,制得的NiOOH中会混有Ni(OH)2,其组成可表示为xNiOOH·yNi(OH)2。现称取9.18 g样品溶于稀硫酸,加入100 mL 1.0 mol·L-1 Fe2+标准溶液,搅拌至溶液清亮,定容至200 mL。取出20.00 mL,用0.010 mol·L-1 KMnO4标准溶液滴定,用去KMnO4标准溶液20.00 mL,试通过计算确定x、y的值(写出计算过程)。涉及反应如下(均未配平):
NiOOH+Fe2++H+—Ni2++Fe3++H2O Fe2++MnO4-+H+—Fe3++Mn2++H2O
____________________________

(1)加入Na2CO3溶液时,确认Ni2+已经完全沉淀的实验方法是
(2)已知Ksp[Ni(OH)2]=2×10-15,欲使NiSO4溶液中残留c(Ni2+)≤2×10-5 mol·L-1,调节pH的范围是
(3)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式:
(4)若加热不充分,制得的NiOOH中会混有Ni(OH)2,其组成可表示为xNiOOH·yNi(OH)2。现称取9.18 g样品溶于稀硫酸,加入100 mL 1.0 mol·L-1 Fe2+标准溶液,搅拌至溶液清亮,定容至200 mL。取出20.00 mL,用0.010 mol·L-1 KMnO4标准溶液滴定,用去KMnO4标准溶液20.00 mL,试通过计算确定x、y的值(写出计算过程)。涉及反应如下(均未配平):
NiOOH+Fe2++H+—Ni2++Fe3++H2O Fe2++MnO4-+H+—Fe3++Mn2++H2O
您最近一年使用:0次
2016-12-09更新
|
404次组卷
|
4卷引用:2016届湖南省师范大学附属中学高三上月考化学试卷
4 . 20.已知H2A在水中存在以下平衡:H2A H++HA-,HA-
H++HA-,HA- H++A2-。回答以下问题:
H++A2-。回答以下问题:
(1)已知常温下,H2A的钙盐(CaA)饱和溶液中存在平衡:
CaA(s) Ca2+(aq)+A2-(aq) ΔH > 0。
Ca2+(aq)+A2-(aq) ΔH > 0。
①温度升高时,Ksp_______ (填“增大”、“减小”或“不变”下同)。
②滴加少量浓盐酸,c (Ca2+)________ ,原因是___________ (用文字和离子方程式说明)。
(2)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式______ 。若某CuSO4溶液中c (Cu2+)=0.02 mol/L,如果要生成Cu(OH)2沉淀,应调整溶液pH,使之大于_____ (已知Ksp[Cu(OH)2]=2.0×10-20)。
 H++HA-,HA-
H++HA-,HA- H++A2-。回答以下问题:
H++A2-。回答以下问题:(1)已知常温下,H2A的钙盐(CaA)饱和溶液中存在平衡:
CaA(s)
 Ca2+(aq)+A2-(aq) ΔH > 0。
Ca2+(aq)+A2-(aq) ΔH > 0。①温度升高时,Ksp
②滴加少量浓盐酸,c (Ca2+)
(2)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式
您最近一年使用:0次
5 . 有关硫化物的几个问题。
(1)H2S在空气中可以燃烧。
已知:① 2H2S(g) + O2(g) 2S(s) + 2H2O(g) ΔH= -442.38 kJ/mol
2S(s) + 2H2O(g) ΔH= -442.38 kJ/mol
②S(s) + O2(g) SO2(g) ΔH= -297.04 kJ/mol
SO2(g) ΔH= -297.04 kJ/mol
H2S(g)与O2(g)反应产生SO2(g)和H2O(g)的热化学方程式是 。
(2)SO2是大气污染物,海水具有良好的吸收SO2的能力,其过程如下。
① SO2溶于海水生成H2SO3,H2SO3最终会电离出SO32—,其电离方程式是 。
② SO32—可以被海水中的溶解氧氧化为SO42—。海水的pH会 (填“升高” 、“不变”或“降低”)。
③ 为调整海水的pH,可加入新鲜的海水,使其中的HCO3—参与反应,其反应的离子方程式是 。
④ 在上述反应的同时需要大量鼓入空气,其原因是 。
(3)自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS,慢慢转变为铜蓝(CuS),用化学用语表示由ZnS转变为CuS的过程: 。
(1)H2S在空气中可以燃烧。
已知:① 2H2S(g) + O2(g)
 2S(s) + 2H2O(g) ΔH= -442.38 kJ/mol
2S(s) + 2H2O(g) ΔH= -442.38 kJ/mol②S(s) + O2(g)
 SO2(g) ΔH= -297.04 kJ/mol
SO2(g) ΔH= -297.04 kJ/molH2S(g)与O2(g)反应产生SO2(g)和H2O(g)的热化学方程式是 。
(2)SO2是大气污染物,海水具有良好的吸收SO2的能力,其过程如下。
① SO2溶于海水生成H2SO3,H2SO3最终会电离出SO32—,其电离方程式是 。
② SO32—可以被海水中的溶解氧氧化为SO42—。海水的pH会 (填“升高” 、“不变”或“降低”)。
③ 为调整海水的pH,可加入新鲜的海水,使其中的HCO3—参与反应,其反应的离子方程式是 。
④ 在上述反应的同时需要大量鼓入空气,其原因是 。
(3)自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS,慢慢转变为铜蓝(CuS),用化学用语表示由ZnS转变为CuS的过程: 。
您最近一年使用:0次
6 . 已知H2A在水中存在以下平衡:H2A H++HA-,HA-
H++HA-,HA- H++A2-。回答以下问题:
H++A2-。回答以下问题:
(1)已知常温下,H2A的钙盐(CaA)饱和溶液中存在平衡:
CaA(s) Ca2+(aq)+A2-(aq) ΔH > 0。
Ca2+(aq)+A2-(aq) ΔH > 0。
①温度升高时,Ksp_______ (填“增大”、“减小”或“不变”下同)。
②滴加少量浓盐酸,c (Ca2+)________ ,原因是___________ (用文字和离子方程式说明)。
(2)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式______ 。若某CuSO4溶液中c (Cu2+)=0.02 mol/L,如果要生成Cu(OH)2沉淀,应调整溶液pH,使之大于5 (已知Ksp[Cu(OH)2]=2.0×10-20)。
 H++HA-,HA-
H++HA-,HA- H++A2-。回答以下问题:
H++A2-。回答以下问题:(1)已知常温下,H2A的钙盐(CaA)饱和溶液中存在平衡:
CaA(s)
 Ca2+(aq)+A2-(aq) ΔH > 0。
Ca2+(aq)+A2-(aq) ΔH > 0。①温度升高时,Ksp
②滴加少量浓盐酸,c (Ca2+)
(2)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式
您最近一年使用:0次
7 . (1)CuSO4的水溶液呈 (填“酸”、“中”、“碱”) 性,实验室在配制CuSO4的溶液时,常将CuSO4固体先溶于硫酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解。
(2)泡沫灭火器中的主要成分是Al2(SO4)3和NaHCO3溶液,反应的离子方程式为
(3)用离子方程式表示明矾净水原理_________________
(4)对于Ag2S(s) 2Ag+(aq)+ S2-(aq),其Ksp=____________。
2Ag+(aq)+ S2-(aq),其Ksp=____________。
(5)下列说法不正确的是__________。
E.沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全。
(2)泡沫灭火器中的主要成分是Al2(SO4)3和NaHCO3溶液,反应的离子方程式为
(3)用离子方程式表示明矾净水原理_________________
(4)对于Ag2S(s)
 2Ag+(aq)+ S2-(aq),其Ksp=____________。
2Ag+(aq)+ S2-(aq),其Ksp=____________。(5)下列说法不正确的是__________。
| A.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小; |
| B.物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的; |
C.对于Al(OH)3(s) Al(OH)3(aq) Al(OH)3(aq) Al3++3OH-,前者为溶解平衡,后者为电离平衡; Al3++3OH-,前者为溶解平衡,后者为电离平衡; |
| D.除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3大 |
E.沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全。
您最近一年使用:0次



