名校
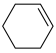
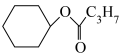
1 . 铬的化合物应用广泛,工业上以铬铁矿(含Al、Si氧化物等杂质)为主要原料制备红矾钠(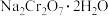 )的工艺流程如下图。已知:①
)的工艺流程如下图。已知:① 中Cr的化合价为+3;②焙烧的目的是将
中Cr的化合价为+3;②焙烧的目的是将 转化为
转化为 ,并将Al、Si氧化物转化为可溶性钠盐。
,并将Al、Si氧化物转化为可溶性钠盐。
(1)与基态铬原子的最外层电子数相同且同周期的元素有_________ 种。
(2)为了提高“焙烧”效果,可采取的一种措施是____________ 。
(3)“浸取”所得的滤渣为 由此推断
由此推断 “焙烧”时发生主要反应的化学方程式为
“焙烧”时发生主要反应的化学方程式为________ 。
(4)常温下,矿物中相关元素可溶性组分物质的量浓度的对数[ ]与pH的关系如图所示。当溶液中可溶性组分浓度
]与pH的关系如图所示。当溶液中可溶性组分浓度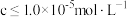 时,可认为已除尽。则“中和”时pH的理论范围为
时,可认为已除尽。则“中和”时pH的理论范围为________ ;“酸化”过程中的离子方程式为____________ 。 的酸性废水,用金属铁作阳极、石墨作阴极,一段时间后产生
的酸性废水,用金属铁作阳极、石墨作阴极,一段时间后产生 和
和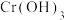 沉淀。
沉淀。
①若电解后溶液中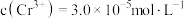 ,则
,则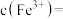
__________  {已知
{已知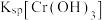
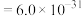 ,
,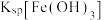 可从第(4)小题图中计算得出}。
可从第(4)小题图中计算得出}。
②电解法处理含 的酸性废水,下列有关原理的说法正确的是
的酸性废水,下列有关原理的说法正确的是_________ (填标号)。
A.阳极反应为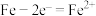
B.电解过程中溶液pH不会变化
C.如果石墨作阳极,电解过程不变
D.电路中每转移12mol电子,阳极有1mol 被还原
被还原
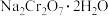 )的工艺流程如下图。已知:①
)的工艺流程如下图。已知:① 中Cr的化合价为+3;②焙烧的目的是将
中Cr的化合价为+3;②焙烧的目的是将 转化为
转化为 ,并将Al、Si氧化物转化为可溶性钠盐。
,并将Al、Si氧化物转化为可溶性钠盐。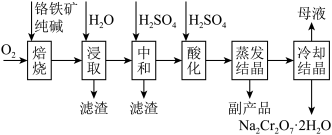
(1)与基态铬原子的最外层电子数相同且同周期的元素有
(2)为了提高“焙烧”效果,可采取的一种措施是
(3)“浸取”所得的滤渣为
 由此推断
由此推断 “焙烧”时发生主要反应的化学方程式为
“焙烧”时发生主要反应的化学方程式为(4)常温下,矿物中相关元素可溶性组分物质的量浓度的对数[
 ]与pH的关系如图所示。当溶液中可溶性组分浓度
]与pH的关系如图所示。当溶液中可溶性组分浓度 时,可认为已除尽。则“中和”时pH的理论范围为
时,可认为已除尽。则“中和”时pH的理论范围为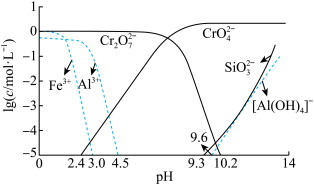
 的酸性废水,用金属铁作阳极、石墨作阴极,一段时间后产生
的酸性废水,用金属铁作阳极、石墨作阴极,一段时间后产生 和
和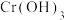 沉淀。
沉淀。①若电解后溶液中
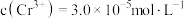 ,则
,则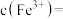
 {已知
{已知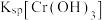
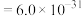 ,
,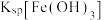 可从第(4)小题图中计算得出}。
可从第(4)小题图中计算得出}。②电解法处理含
 的酸性废水,下列有关原理的说法正确的是
的酸性废水,下列有关原理的说法正确的是A.阳极反应为
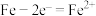
B.电解过程中溶液pH不会变化
C.如果石墨作阳极,电解过程不变
D.电路中每转移12mol电子,阳极有1mol
 被还原
被还原
您最近一年使用:0次
名校
2 .  可用于玻璃和陶瓷的着色剂。由含钴可矿(
可用于玻璃和陶瓷的着色剂。由含钴可矿( 元素主要以
元素主要以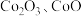 的形式存在,还含有
的形式存在,还含有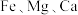 元素,碳及有机物等)制取氯化钴晶体的一种工艺流程如图所示:
元素,碳及有机物等)制取氯化钴晶体的一种工艺流程如图所示: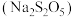 常用作食品抗氧化剂。
常用作食品抗氧化剂。
②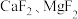 难溶于水。
难溶于水。
③部分金属阳离子形成氢氧化物沉淀的 如表所示:
如表所示:
回答下列问题:
(1)“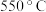 焙烧”的目的是
焙烧”的目的是__________________ 。
(2)“浸取”的过程中, 的主要作用是
的主要作用是__________________ (用离子方程式表示)。若用盐酸代替 和
和 的混合液也能达到目的,从环保角度分析不采用盐酸的原因
的混合液也能达到目的,从环保角度分析不采用盐酸的原因__________________ 。
(3)“滤液1”中加入 溶液,反应过程中氧化剂与还原剂的物质的量之比为
溶液,反应过程中氧化剂与还原剂的物质的量之比为_________ 。
(4)“滤渣2”的主要成分为_________ (填化学式)。
(5)已知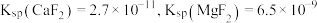 ,当
,当 恰好沉淀完全时(浓度为
恰好沉淀完全时(浓度为 ),溶液中
),溶液中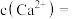
_________ (保留3位有效数字)。
(6)钴 的合金材料广泛应用于航空航天、机械制造等领域。用乙醇燃料电池作为电源电解含
的合金材料广泛应用于航空航天、机械制造等领域。用乙醇燃料电池作为电源电解含 的水溶液制备金属钴的装置如图2、3所示。
的水溶液制备金属钴的装置如图2、3所示。 电极应连接乙醇燃料电池的
电极应连接乙醇燃料电池的_________ 极(填“a”或“b”)。
②电解过程中Ⅱ室溶液 变小,则离子交换膜2为
变小,则离子交换膜2为_________ (填“阴”或“阳”)离子交换膜。
 可用于玻璃和陶瓷的着色剂。由含钴可矿(
可用于玻璃和陶瓷的着色剂。由含钴可矿( 元素主要以
元素主要以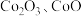 的形式存在,还含有
的形式存在,还含有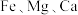 元素,碳及有机物等)制取氯化钴晶体的一种工艺流程如图所示:
元素,碳及有机物等)制取氯化钴晶体的一种工艺流程如图所示: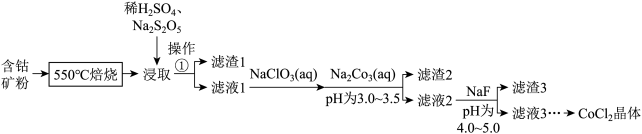
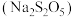 常用作食品抗氧化剂。
常用作食品抗氧化剂。②
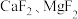 难溶于水。
难溶于水。③部分金属阳离子形成氢氧化物沉淀的
 如表所示:
如表所示:
|
|
|
|
| |
开始沉淀 | 0.3 | 2.7 | 7.2 | 7.6 | 9.6 |
完全沉淀 | 1.1 | 3.2 | 9.2 | 9.6 | 11.1 |
(1)“
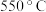 焙烧”的目的是
焙烧”的目的是(2)“浸取”的过程中,
 的主要作用是
的主要作用是 和
和 的混合液也能达到目的,从环保角度分析不采用盐酸的原因
的混合液也能达到目的,从环保角度分析不采用盐酸的原因(3)“滤液1”中加入
 溶液,反应过程中氧化剂与还原剂的物质的量之比为
溶液,反应过程中氧化剂与还原剂的物质的量之比为(4)“滤渣2”的主要成分为
(5)已知
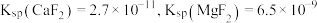 ,当
,当 恰好沉淀完全时(浓度为
恰好沉淀完全时(浓度为 ),溶液中
),溶液中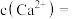
(6)钴
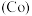 的合金材料广泛应用于航空航天、机械制造等领域。用乙醇燃料电池作为电源电解含
的合金材料广泛应用于航空航天、机械制造等领域。用乙醇燃料电池作为电源电解含 的水溶液制备金属钴的装置如图2、3所示。
的水溶液制备金属钴的装置如图2、3所示。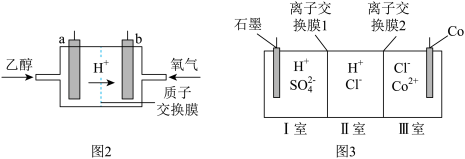
 电极应连接乙醇燃料电池的
电极应连接乙醇燃料电池的②电解过程中Ⅱ室溶液
 变小,则离子交换膜2为
变小,则离子交换膜2为
您最近一年使用:0次
名校
3 . 铊(Tl)广泛用于电子、军工、航天、化工、治金、通讯等方面,一种以红铊矿(主要成分是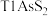 ,含少量
,含少量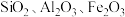 ,等杂质)为原料制备金属铊的流程如图所示。
,等杂质)为原料制备金属铊的流程如图所示。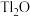 )膜,而失去金属光泽变得灰暗。
)膜,而失去金属光泽变得灰暗。
②TlCl难溶于水,而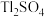 溶于水。
溶于水。
③溶液中金属离子开始沉淀和完全沉淀的 如下表所示:
如下表所示:
回答下列问题:
(1)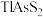 中三元素的基态原子含有未成对电子数最多的元素是
中三元素的基态原子含有未成对电子数最多的元素是_______ 。(填元素符号)
(2)“焙烧1”中,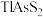 最终转化为
最终转化为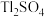 ﹔
﹔ 和
和 也转化为相应的硫酸盐。其中,
也转化为相应的硫酸盐。其中,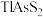 转化为
转化为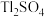 分如下两步完成。请写出第二步反应的化学方程式。
分如下两步完成。请写出第二步反应的化学方程式。
第一步(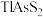 与
与 反应):
反应):
第二步:_______ 。
(3)滤渣的成分 属于共价晶体,晶体中每个最小环含有
属于共价晶体,晶体中每个最小环含有_______ 个原子。
(4)“沉铊”步骤中,需要加入过量 ,其原因是
,其原因是_______ 。(用化学用语和简要的文字解释)
(5)向“沉铊”后的滤液中加入生石灰至 时才能外排,此时滤液中的
时才能外排,此时滤液中的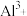 浓度为
浓度为_______  。(指数允许是小数)
。(指数允许是小数)
(6)“焙烧2”中发生的反应为 。则“置换”步骤中发生反应的离子方程式为
。则“置换”步骤中发生反应的离子方程式为_______ 。
(7)所得产品高纯铊应保存在_______ 中。
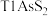 ,含少量
,含少量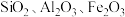 ,等杂质)为原料制备金属铊的流程如图所示。
,等杂质)为原料制备金属铊的流程如图所示。
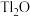 )膜,而失去金属光泽变得灰暗。
)膜,而失去金属光泽变得灰暗。②TlCl难溶于水,而
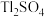 溶于水。
溶于水。③溶液中金属离子开始沉淀和完全沉淀的
 如下表所示:
如下表所示:| 金属离子 |  |  |
开始沉淀的 | 2.2 | 3.5 |
沉淀完全( )的 )的 | 3.2 | 4.7 |
(1)
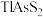 中三元素的基态原子含有未成对电子数最多的元素是
中三元素的基态原子含有未成对电子数最多的元素是(2)“焙烧1”中,
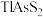 最终转化为
最终转化为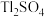 ﹔
﹔ 和
和 也转化为相应的硫酸盐。其中,
也转化为相应的硫酸盐。其中,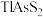 转化为
转化为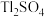 分如下两步完成。请写出第二步反应的化学方程式。
分如下两步完成。请写出第二步反应的化学方程式。第一步(
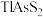 与
与 反应):
反应):
第二步:
(3)滤渣的成分
 属于共价晶体,晶体中每个最小环含有
属于共价晶体,晶体中每个最小环含有(4)“沉铊”步骤中,需要加入过量
 ,其原因是
,其原因是(5)向“沉铊”后的滤液中加入生石灰至
 时才能外排,此时滤液中的
时才能外排,此时滤液中的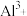 浓度为
浓度为 。(指数允许是小数)
。(指数允许是小数)(6)“焙烧2”中发生的反应为
 。则“置换”步骤中发生反应的离子方程式为
。则“置换”步骤中发生反应的离子方程式为(7)所得产品高纯铊应保存在
您最近一年使用:0次
名校
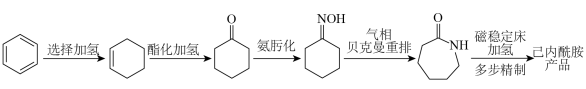
4 . 2023年12月具有完全知识产权、全球首套己内酰胺的绿色生产线正式在中国石化岳阳巴陵石化子公司投产。其生产流程如下:
(1)已知:①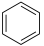
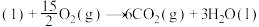
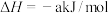
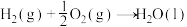

 的物质的量之比为1∶4,初始压强为5MPa的条件下,达平衡时,苯的转化率为20%,环己烷的选择性达90%,则反应②的
的物质的量之比为1∶4,初始压强为5MPa的条件下,达平衡时,苯的转化率为20%,环己烷的选择性达90%,则反应②的
___________ 。(填写计算式)
Ⅱ.苯选择加氢制环己烯是实现环己酮绿色合成新途径的关键,从热力学的角度来看极为不利,可选择更高效的催化剂,加快环己烯从催化剂的表面脱附,从而提高环己烯的选择性。采用的新型催化剂为:Ru-Zn纳米粒子@BZSS碱式复盐,通过调控BZSS滞水膜厚度进一步提高了环己烯选择性,使用该催化剂使苯的转化率达到70%以上,环己烯的选择性达到80%。已知:苯在水中的溶解度大于环己烯在水中的溶解度,新型负载型催化剂具有亲水性。
(3)请解释Ru-Zn纳米粒子@BZSS碱式复盐能提高环己烯选择性的原因(请从溶解性的角度解释):___________ 。
Ⅲ.中国石化环己酮氨肟化技术以微米级空心TS-1分子筛原粉为催化剂,并成功开发浆态床/膜分离组合新工艺,从而实现微米级催化剂的分离与连续循环使用。该环节中用蒽醌法生产过氧化氢的反应进程如下: 的分解温度为60℃,AQ的沸点377℃,AHQ的沸点390℃。
的分解温度为60℃,AQ的沸点377℃,AHQ的沸点390℃。
(4)有关该反应过程,说法不正确的是___________(填标号)。
(5)已知环己烯与羧酸发生加成反应的机理如下:
8S3SiIH催化的环烯烃与羧酸加成酯化反应结果
从表格中得出,环己烯与不同羧酸加成,其中与HCOOH反应的产率最高,最有可能的原因是___________ (从分子结构的角度解释)。而环己烯与环戊烯相比,在同样的催化剂条件下,相同温度下,环戊烯加成的产率更高的原因可能是___________ 。
(6)已知在标准状况下,AgCl的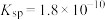 ,
, 的
的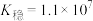 ,若把足量AgCl溶于10mol/L的氨水中,则形成的
,若把足量AgCl溶于10mol/L的氨水中,则形成的 的浓度为
的浓度为___________ mol/L(已知: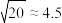 ,结果保留两位有效数字)。
,结果保留两位有效数字)。
(1)已知:①

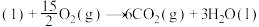
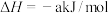
②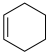
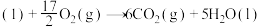
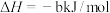
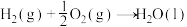

则:
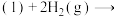

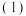

①
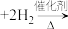
 、
、
②
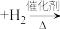
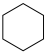 。
。
 的物质的量之比为1∶4,初始压强为5MPa的条件下,达平衡时,苯的转化率为20%,环己烷的选择性达90%,则反应②的
的物质的量之比为1∶4,初始压强为5MPa的条件下,达平衡时,苯的转化率为20%,环己烷的选择性达90%,则反应②的
Ⅱ.苯选择加氢制环己烯是实现环己酮绿色合成新途径的关键,从热力学的角度来看极为不利,可选择更高效的催化剂,加快环己烯从催化剂的表面脱附,从而提高环己烯的选择性。采用的新型催化剂为:Ru-Zn纳米粒子@BZSS碱式复盐,通过调控BZSS滞水膜厚度进一步提高了环己烯选择性,使用该催化剂使苯的转化率达到70%以上,环己烯的选择性达到80%。已知:苯在水中的溶解度大于环己烯在水中的溶解度,新型负载型催化剂具有亲水性。
(3)请解释Ru-Zn纳米粒子@BZSS碱式复盐能提高环己烯选择性的原因(请从溶解性的角度解释):
Ⅲ.中国石化环己酮氨肟化技术以微米级空心TS-1分子筛原粉为催化剂,并成功开发浆态床/膜分离组合新工艺,从而实现微米级催化剂的分离与连续循环使用。该环节中用蒽醌法生产过氧化氢的反应进程如下:
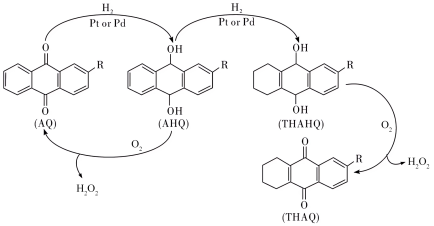
 的分解温度为60℃,AQ的沸点377℃,AHQ的沸点390℃。
的分解温度为60℃,AQ的沸点377℃,AHQ的沸点390℃。(4)有关该反应过程,说法不正确的是___________(填标号)。
A.从AQ到AHQ的反应中,发生变化的碳原子的杂化类型由 到 到 |
B.由THAHQ制备 的反应方程式为 的反应方程式为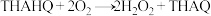 |
C.在AHQ的氧化过程中,生成的 和有机物AQ、AHQ的分离方法为蒸馏 和有机物AQ、AHQ的分离方法为蒸馏 |
| D.我国采用的浆态蒽醌氢化法,使用更高效的Pd基细颗粒催化剂,有利于提高催化的效率 |
(5)已知环己烯与羧酸发生加成反应的机理如下:

8S3SiIH催化的环烯烃与羧酸加成酯化反应结果
| 序号 | 羧酸 | 环烯烃 | 温度/℃ | 产物 | 产率/% |
| 1 | HCOOH |
| 95 |
| 90 |
| 2 |  |
| 110 |
| 82 |
| 3 | 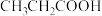 |
| 120 |
| 62 |
| 4 | 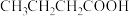 |
| 130 |
| 51 |
| 5 | HCOOH |
| 95 |
| 93 |
(6)已知在标准状况下,AgCl的
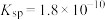 ,
, 的
的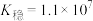 ,若把足量AgCl溶于10mol/L的氨水中,则形成的
,若把足量AgCl溶于10mol/L的氨水中,则形成的 的浓度为
的浓度为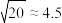 ,结果保留两位有效数字)。
,结果保留两位有效数字)。
您最近一年使用:0次
名校
5 . 湖南稀土资源丰富,其中红土钪矿富含钪元素。钪及其化合物具有许多优良的性能,在宇航、电子、超导等方面有着广泛的应用。从红土钪矿(含钪、钛、铁、锰等元素)中提取氧化钪(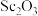 )的一种流程如下:
)的一种流程如下: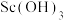 为两性氢氧化物,可与强碱反应生成
为两性氢氧化物,可与强碱反应生成 。
。
②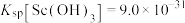 。
。
③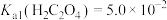 ,
,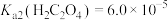 。
。
(1)为提高酸浸速率,可通过研磨、___________ 等措施(举2例)。请从原子结构的角度解释加入双氧水易将酸浸液中某种金属阳离子氧化的原因:___________ 。该步骤中选用足量的 ,理由是
,理由是___________ 。
(2)25℃时加入NaOH溶液调节 以除去
以除去 ,沉锰过程中钪也会经历沉淀的过程,
,沉锰过程中钪也会经历沉淀的过程,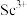 完全沉淀的
完全沉淀的
___________ (已知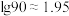 )。
)。
(3)向含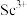 的溶液中加入草酸后可以将其沉淀,
的溶液中加入草酸后可以将其沉淀, 的草酸溶液中
的草酸溶液中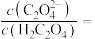
___________ 。
(4)草酸钪在空气中灼烧的化学方程式为___________ 。
(5)Y、Sc(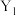 /NC,
/NC,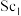 /NC)单原子催化剂可用于常温常压下的电化学催化氢气还原氮气的反应。反应历程与相对能量模拟计算结果如图所示(*表示稀土单原子催化剂)。使用
/NC)单原子催化剂可用于常温常压下的电化学催化氢气还原氮气的反应。反应历程与相对能量模拟计算结果如图所示(*表示稀土单原子催化剂)。使用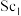 /NC单原子催化剂的反应历程中,决速步的方程式为
/NC单原子催化剂的反应历程中,决速步的方程式为___________ 。
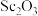 )的一种流程如下:
)的一种流程如下:
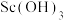 为两性氢氧化物,可与强碱反应生成
为两性氢氧化物,可与强碱反应生成 。
。②
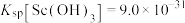 。
。③
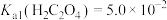 ,
,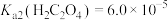 。
。(1)为提高酸浸速率,可通过研磨、
 ,理由是
,理由是(2)25℃时加入NaOH溶液调节
 以除去
以除去 ,沉锰过程中钪也会经历沉淀的过程,
,沉锰过程中钪也会经历沉淀的过程,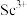 完全沉淀的
完全沉淀的
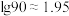 )。
)。(3)向含
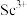 的溶液中加入草酸后可以将其沉淀,
的溶液中加入草酸后可以将其沉淀, 的草酸溶液中
的草酸溶液中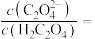
(4)草酸钪在空气中灼烧的化学方程式为
(5)Y、Sc(
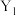 /NC,
/NC,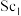 /NC)单原子催化剂可用于常温常压下的电化学催化氢气还原氮气的反应。反应历程与相对能量模拟计算结果如图所示(*表示稀土单原子催化剂)。使用
/NC)单原子催化剂可用于常温常压下的电化学催化氢气还原氮气的反应。反应历程与相对能量模拟计算结果如图所示(*表示稀土单原子催化剂)。使用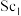 /NC单原子催化剂的反应历程中,决速步的方程式为
/NC单原子催化剂的反应历程中,决速步的方程式为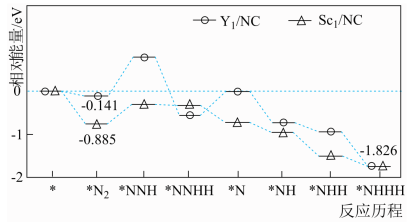
您最近一年使用:0次
名校
解题方法
6 . 高砷烟尘(主要成分有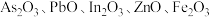 等)属于危险固体废弃物,对高砷烟尘进行综合处理回收
等)属于危险固体废弃物,对高砷烟尘进行综合处理回收 ,和金属铟的工业流程如下:
,和金属铟的工业流程如下: 在酸性溶液中以
在酸性溶液中以 或
或 形式存在,氧化性环境中主要存在
形式存在,氧化性环境中主要存在 ;
;
② 在
在 易分解为
易分解为 难溶于水;
难溶于水;
③ 。
。
回答下列问题:
(1)滤渣的主要成分为_______ (填化学式)。
(2)“高压酸浸”时, 的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过
的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过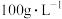 时,
时, 的浸出率随硫酸浓度增大而略微减小的原因可能为
的浸出率随硫酸浓度增大而略微减小的原因可能为_______ 。 ,发生反应的离子方程式为
,发生反应的离子方程式为_______ 。已知 在水溶液中电离的总反应式为
在水溶液中电离的总反应式为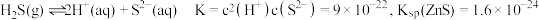 。当“硫化”操作后溶液中
。当“硫化”操作后溶液中 ,则此时溶液的
,则此时溶液的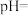
_______ 。
(4)“还原”后溶液酸性增强,主要原因是_______ (用离子方程式表示)。
(5)“结晶”操作为_______ 、过滤、洗涤、干燥。
(6)“萃余液”中含有的金属阳离子为_______ (填离子符号),将 溶液电解得到金属铟,阴极的电极反应式为
溶液电解得到金属铟,阴极的电极反应式为_______ 。
(7)硫化铟铜是一种新型的纳米材料,具有优异的光电性能和光催化性能。一种由S、 三种元素组成的化合物的晶胞如图所示。采用
三种元素组成的化合物的晶胞如图所示。采用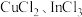 和
和 合成硫化铟铜薄膜,该反应的化学方程式是
合成硫化铟铜薄膜,该反应的化学方程式是_______ ,该晶胞的六个面均为矩形,上、下底面的晶胞参数为 ,高为
,高为 ,晶体密度为
,晶体密度为 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为_______ (用含a、b、d的式子表示)。
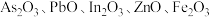 等)属于危险固体废弃物,对高砷烟尘进行综合处理回收
等)属于危险固体废弃物,对高砷烟尘进行综合处理回收 ,和金属铟的工业流程如下:
,和金属铟的工业流程如下: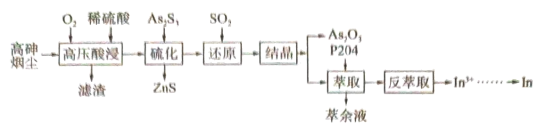
 在酸性溶液中以
在酸性溶液中以 或
或 形式存在,氧化性环境中主要存在
形式存在,氧化性环境中主要存在 ;
;②
 在
在 易分解为
易分解为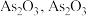 难溶于水;
难溶于水;③
 。
。回答下列问题:
(1)滤渣的主要成分为
(2)“高压酸浸”时,
 的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过
的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过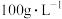 时,
时, 的浸出率随硫酸浓度增大而略微减小的原因可能为
的浸出率随硫酸浓度增大而略微减小的原因可能为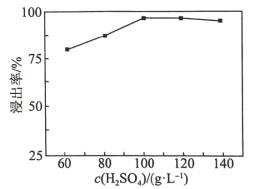
 ,发生反应的离子方程式为
,发生反应的离子方程式为 在水溶液中电离的总反应式为
在水溶液中电离的总反应式为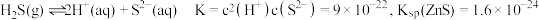 。当“硫化”操作后溶液中
。当“硫化”操作后溶液中 ,则此时溶液的
,则此时溶液的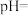
(4)“还原”后溶液酸性增强,主要原因是
(5)“结晶”操作为
(6)“萃余液”中含有的金属阳离子为
 溶液电解得到金属铟,阴极的电极反应式为
溶液电解得到金属铟,阴极的电极反应式为(7)硫化铟铜是一种新型的纳米材料,具有优异的光电性能和光催化性能。一种由S、
 三种元素组成的化合物的晶胞如图所示。采用
三种元素组成的化合物的晶胞如图所示。采用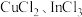 和
和 合成硫化铟铜薄膜,该反应的化学方程式是
合成硫化铟铜薄膜,该反应的化学方程式是 ,高为
,高为 ,晶体密度为
,晶体密度为 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为
您最近一年使用:0次
2024-05-14更新
|
122次组卷
|
3卷引用: 湖南省北师联盟2024届高三下学期模拟考试三模化学试题
名校
解题方法
7 . 新能源汽车工业飞速发展依赖于锂离子电池的新型电极材料的研究取得的重大成果。 可以实现海水中
可以实现海水中 的富集,对锂离子电池的研究作出重要贡献。以软锰矿(含
的富集,对锂离子电池的研究作出重要贡献。以软锰矿(含 及少量
及少量 和
和 )为原料生产高纯
)为原料生产高纯 的工艺流程如图甲。
的工艺流程如图甲。
(1)“浸锰”时, 生成
生成 的离子方程式为
的离子方程式为___________ 。
(2)步骤Ⅱ中, 的萃取率与
的萃取率与 的关系如图乙,当
的关系如图乙,当 后,随
后,随 增大,
增大, 萃取率下降的原因是
萃取率下降的原因是___________ 。 ,若
,若 ,常温下调节
,常温下调节 范围应为
范围应为___________ {已知该条件下,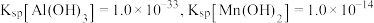 }。
}。
(4)海水中锂的总含量为陆地总含量的5000倍以上,但海水中锂的质量浓度仅为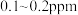 ,从海水中提取锂首先需要对低浓度的
,从海水中提取锂首先需要对低浓度的 进行选择性富集,而
进行选择性富集,而 能够嵌入高纯
能够嵌入高纯 并在一定条件下脱出,据此可以进行
并在一定条件下脱出,据此可以进行 的富集。
的富集。
①以 和高纯
和高纯 为原料,充分混合后在720℃下煅烧
为原料,充分混合后在720℃下煅烧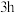 ,冷却至室温后即可得到复合氧化物
,冷却至室温后即可得到复合氧化物 。用
。用 的盐酸在60℃下处理
的盐酸在60℃下处理 ,将其中所有
,将其中所有 置换后得到
置换后得到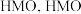 可以和
可以和 反应再生成
反应再生成 ,然后
,然后 与酸作用脱出
与酸作用脱出 从而实现
从而实现 的富集。如此循环处理。合成
的富集。如此循环处理。合成 的化学方程式为
的化学方程式为___________ ;
②用酸处理 时,除离子交换反应之外,也会发生一个副反应,该副反应导致固体中M的平均化合价有所提高,则副反应的生成物中含
时,除离子交换反应之外,也会发生一个副反应,该副反应导致固体中M的平均化合价有所提高,则副反应的生成物中含 元素的微粒是
元素的微粒是___________ 。这一副反应对再生后的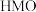 的锂富集性能的影响是
的锂富集性能的影响是___________ 。
(5)利用高纯 实施电化学富集锂是行之有效的方法。电化学系统(如图丙所示)的工作步骤如下:
实施电化学富集锂是行之有效的方法。电化学系统(如图丙所示)的工作步骤如下:
步骤1:向 所在的腔室通入海水,启动电源1,使海水中的
所在的腔室通入海水,启动电源1,使海水中的 进入
进入 结构而形成
结构而形成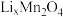 ;
;
步骤2:关闭电源1和海水通道,启动电源2,同时向电极2上通入空气,使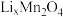 中的
中的 脱出进入腔室2。
脱出进入腔室2。 对
对 的富集效果,将
的富集效果,将 的
的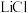 溶液通入
溶液通入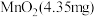 所在腔室,启动电源1,使电流恒定在
所在腔室,启动电源1,使电流恒定在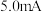 ,累计工作
,累计工作 后发现
后发现 的电极电势快速下降,则
的电极电势快速下降,则 中的
中的
___________ (已知 电子的电量为
电子的电量为 。电流效率为
。电流效率为 )。
)。
②电源2工作时, 电极上发生的电极反应为
电极上发生的电极反应为___________ 。
 可以实现海水中
可以实现海水中 的富集,对锂离子电池的研究作出重要贡献。以软锰矿(含
的富集,对锂离子电池的研究作出重要贡献。以软锰矿(含 及少量
及少量 和
和 )为原料生产高纯
)为原料生产高纯 的工艺流程如图甲。
的工艺流程如图甲。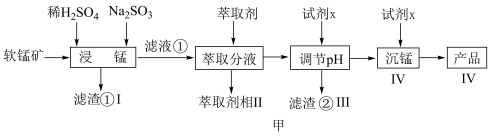
(1)“浸锰”时,
 生成
生成 的离子方程式为
的离子方程式为(2)步骤Ⅱ中,
 的萃取率与
的萃取率与 的关系如图乙,当
的关系如图乙,当 后,随
后,随 增大,
增大, 萃取率下降的原因是
萃取率下降的原因是
 ,若
,若 ,常温下调节
,常温下调节 范围应为
范围应为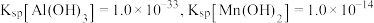 }。
}。(4)海水中锂的总含量为陆地总含量的5000倍以上,但海水中锂的质量浓度仅为
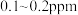 ,从海水中提取锂首先需要对低浓度的
,从海水中提取锂首先需要对低浓度的 进行选择性富集,而
进行选择性富集,而 能够嵌入高纯
能够嵌入高纯 并在一定条件下脱出,据此可以进行
并在一定条件下脱出,据此可以进行 的富集。
的富集。①以
 和高纯
和高纯 为原料,充分混合后在720℃下煅烧
为原料,充分混合后在720℃下煅烧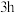 ,冷却至室温后即可得到复合氧化物
,冷却至室温后即可得到复合氧化物 。用
。用 的盐酸在60℃下处理
的盐酸在60℃下处理 ,将其中所有
,将其中所有 置换后得到
置换后得到 可以和
可以和 反应再生成
反应再生成 ,然后
,然后 与酸作用脱出
与酸作用脱出 从而实现
从而实现 的富集。如此循环处理。合成
的富集。如此循环处理。合成 的化学方程式为
的化学方程式为②用酸处理
 时,除离子交换反应之外,也会发生一个副反应,该副反应导致固体中M的平均化合价有所提高,则副反应的生成物中含
时,除离子交换反应之外,也会发生一个副反应,该副反应导致固体中M的平均化合价有所提高,则副反应的生成物中含 元素的微粒是
元素的微粒是 的锂富集性能的影响是
的锂富集性能的影响是(5)利用高纯
 实施电化学富集锂是行之有效的方法。电化学系统(如图丙所示)的工作步骤如下:
实施电化学富集锂是行之有效的方法。电化学系统(如图丙所示)的工作步骤如下:步骤1:向
 所在的腔室通入海水,启动电源1,使海水中的
所在的腔室通入海水,启动电源1,使海水中的 进入
进入 结构而形成
结构而形成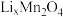 ;
;步骤2:关闭电源1和海水通道,启动电源2,同时向电极2上通入空气,使
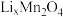 中的
中的 脱出进入腔室2。
脱出进入腔室2。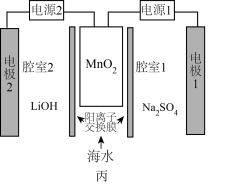
 对
对 的富集效果,将
的富集效果,将 的
的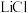 溶液通入
溶液通入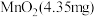 所在腔室,启动电源1,使电流恒定在
所在腔室,启动电源1,使电流恒定在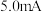 ,累计工作
,累计工作 后发现
后发现 的电极电势快速下降,则
的电极电势快速下降,则 中的
中的
 电子的电量为
电子的电量为 。电流效率为
。电流效率为 )。
)。②电源2工作时,
 电极上发生的电极反应为
电极上发生的电极反应为
您最近一年使用:0次
2024-05-14更新
|
165次组卷
|
2卷引用:湖南省长沙市一中2024届高三下学期高考适应性演练(三)化学试题
解题方法
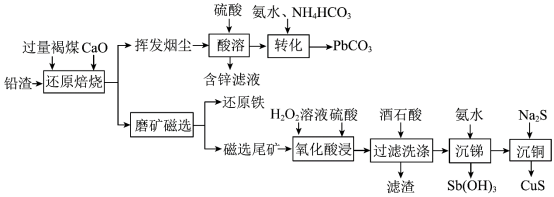
8 . 铅渣由多种氧化物及它们相互结合而形成的化合物、固溶体、共晶混合物所组成。对铅渣进行综合利用,回收其中的有价金属(Cu、Fe、Pb、Zn、Sb)的部分工艺流程如下: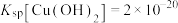 ,
, ,
, 。
。
②金属离子浓度等于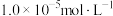 时,可认为其恰好沉淀完全。
时,可认为其恰好沉淀完全。
(1)Sb元素的原子序数为51,与氮元素同主族,其基态电子排布式为[Kr]___________ 。
(2)“还原焙烧”时, 发生反应的化学方程式为
发生反应的化学方程式为___________ 。
(3)挥发烟尘中的主要氧化物为 。“转化”过程中,发生反应的离子方程式为
。“转化”过程中,发生反应的离子方程式为___________ 。
(4)“氧化酸浸”过程中,若将物质的量为2mol的 合金(其中Cu与Sb物质的量之比为
合金(其中Cu与Sb物质的量之比为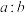 )氧化,至少需要
)氧化,至少需要 的物质的量为
的物质的量为___________ mol(用含a、b的式子表示)。
(5)“过滤洗涤”过程中,加入酒石酸(分子式为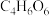 ,结构简式
,结构简式 )发生如下反应:
)发生如下反应: ;
;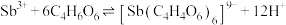 。
。
①上述两个配合物中,提供孤对电子的元素为___________ (填元素符号)。
②“过滤洗涤”时,用酒石酸稀溶液洗涤滤渣而不用水。用酒石酸稀溶液洗涤可减少金属离子的损失,原因为___________ 。
(6)“沉锑”过程中,锑恰好沉淀完全时,溶液中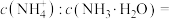
___________ 。
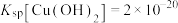 ,
, ,
, 。
。②金属离子浓度等于
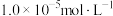 时,可认为其恰好沉淀完全。
时,可认为其恰好沉淀完全。(1)Sb元素的原子序数为51,与氮元素同主族,其基态电子排布式为[Kr]
(2)“还原焙烧”时,
 发生反应的化学方程式为
发生反应的化学方程式为(3)挥发烟尘中的主要氧化物为
 。“转化”过程中,发生反应的离子方程式为
。“转化”过程中,发生反应的离子方程式为(4)“氧化酸浸”过程中,若将物质的量为2mol的
 合金(其中Cu与Sb物质的量之比为
合金(其中Cu与Sb物质的量之比为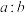 )氧化,至少需要
)氧化,至少需要 的物质的量为
的物质的量为(5)“过滤洗涤”过程中,加入酒石酸(分子式为
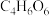 ,结构简式
,结构简式 )发生如下反应:
)发生如下反应: ;
;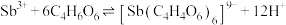 。
。①上述两个配合物中,提供孤对电子的元素为
②“过滤洗涤”时,用酒石酸稀溶液洗涤滤渣而不用水。用酒石酸稀溶液洗涤可减少金属离子的损失,原因为
(6)“沉锑”过程中,锑恰好沉淀完全时,溶液中
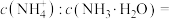
您最近一年使用:0次
名校
9 . 钒的用途十分广泛,有金属“维生素”之称。以含钒石煤(主要成分是V2O3、V2O4,含有的杂质有SiO2、FeS2及Mg、Al、Mn等的化合物)制备单质钒的工艺流程如图所示。
②Ksp(CaCO3)=2.8×10-9,Ksp(CaSiO3)=2.5×10-8,Ksp[Ca(VO3)2]远大于Ksp(CaCO3)。
回答下列问题:
(1)写出Cr3+的核外电子排布式为________ 。
(2)为了提高“焙烧”效率,可采取的措施有______ 。
(3)“焙烧”时,V2O3、V2O4都转化为Ca(VO3)2,写出V2O4转化为Ca(VO3)2的化学方程式:_____ 。
(4)“水浸”加入Na2CO3调节溶液的pH为8.5,可完全除去的金属离子有______ ;“水浸”加入过量Na2CO3不能使CaSiO3完全转化为CaCO3,原因是_______ 。(列式计算平衡常数分析该反应进行的趋势,一般认为,K>105时反应进行较完全,K<105时反应难以进行)
(5)“离子交换”与“洗脱”可表示为[RCl4]+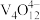
 [R-V4O12]+4Cl- ([RCl4]为强碱性阴离子交换树脂,
[R-V4O12]+4Cl- ([RCl4]为强碱性阴离子交换树脂,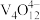 为
为 在水溶液中的实际存在形式),则“洗脱”过程中“淋洗液”最好选用
在水溶液中的实际存在形式),则“洗脱”过程中“淋洗液”最好选用_____ 。
(6)下列金属冶炼方法中,与本工艺流程中冶炼钒的方法相似的是____ (填字母)。
A.铝热反应制锰 B.电解熔融氯化钠制钠 C.氧化汞分解制汞

| 金属离子 | Fe3+ | Mg2+ | Al3+ | Mn2+ |
| 开始沉淀时的pH | 1.9 | 7.0 | 3.0 | 8.1 |
| 完全沉淀时的pH | 3.2 | 9.0 | 4.7 | 10.1 |
回答下列问题:
(1)写出Cr3+的核外电子排布式为
(2)为了提高“焙烧”效率,可采取的措施有
(3)“焙烧”时,V2O3、V2O4都转化为Ca(VO3)2,写出V2O4转化为Ca(VO3)2的化学方程式:
(4)“水浸”加入Na2CO3调节溶液的pH为8.5,可完全除去的金属离子有
(5)“离子交换”与“洗脱”可表示为[RCl4]+
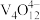
 [R-V4O12]+4Cl- ([RCl4]为强碱性阴离子交换树脂,
[R-V4O12]+4Cl- ([RCl4]为强碱性阴离子交换树脂,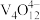 为
为 在水溶液中的实际存在形式),则“洗脱”过程中“淋洗液”最好选用
在水溶液中的实际存在形式),则“洗脱”过程中“淋洗液”最好选用(6)下列金属冶炼方法中,与本工艺流程中冶炼钒的方法相似的是
A.铝热反应制锰 B.电解熔融氯化钠制钠 C.氧化汞分解制汞
您最近一年使用:0次
解题方法
10 . GaN是研制高温大功率电子器件和高频微波器件的重要材料。以废旧太阳能电池(主要成分为 )为原料制备GaN的流程如图。请根据所学知识回答问题。
)为原料制备GaN的流程如图。请根据所学知识回答问题。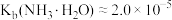 ,
, 。
。
(1) 在315℃开始凝华成有光泽的针状结晶,试推测该结晶的晶体类型:
在315℃开始凝华成有光泽的针状结晶,试推测该结晶的晶体类型:___________ 。
(2)“酸浸氧化”时,温度不宜超过50℃,原因为___________ 。
(3)加氨水调pH的目的是除铜,该步骤中分两步进行,第一步:
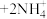 ,第二步是生成的
,第二步是生成的 溶解于氨水。
溶解于氨水。
①根据所给信息,计算第一步反应的平衡常数
___________ 。
②写出 溶解于氨水的离子方程式:
溶解于氨水的离子方程式:___________ 。
(4)“回流过滤”中, (一种液态化合物,遇水易发生水解)与
(一种液态化合物,遇水易发生水解)与 反应的化学方程式为
反应的化学方程式为___________ ;该工序分离 和
和 利用的原理是
利用的原理是___________ 。
(5) 气体在270℃左右以二聚物存在,请写出该二聚物的结构:
气体在270℃左右以二聚物存在,请写出该二聚物的结构:___________ 。
(6)“高温气相沉积”需要将蓝宝石基板(温度高达1000℃)放在沉积炉内,然后以很低的流速将氮化镓气体从上面吹入炉内。研究发现平放基板时氮化镓分子无法稳定沉积到基板上,而将基板按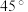 倾角斜放,却获得了非常均匀的氮化镓结晶,试分析其原因:
倾角斜放,却获得了非常均匀的氮化镓结晶,试分析其原因:___________ 。
 )为原料制备GaN的流程如图。请根据所学知识回答问题。
)为原料制备GaN的流程如图。请根据所学知识回答问题。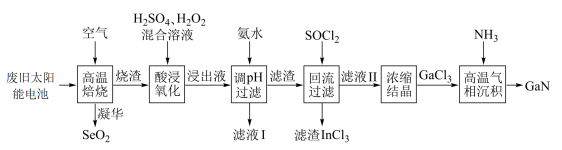
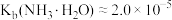 ,
, 。
。(1)
 在315℃开始凝华成有光泽的针状结晶,试推测该结晶的晶体类型:
在315℃开始凝华成有光泽的针状结晶,试推测该结晶的晶体类型:(2)“酸浸氧化”时,温度不宜超过50℃,原因为
(3)加氨水调pH的目的是除铜,该步骤中分两步进行,第一步:

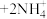 ,第二步是生成的
,第二步是生成的 溶解于氨水。
溶解于氨水。①根据所给信息,计算第一步反应的平衡常数

②写出
 溶解于氨水的离子方程式:
溶解于氨水的离子方程式:(4)“回流过滤”中,
 (一种液态化合物,遇水易发生水解)与
(一种液态化合物,遇水易发生水解)与 反应的化学方程式为
反应的化学方程式为 和
和 利用的原理是
利用的原理是(5)
 气体在270℃左右以二聚物存在,请写出该二聚物的结构:
气体在270℃左右以二聚物存在,请写出该二聚物的结构:(6)“高温气相沉积”需要将蓝宝石基板(温度高达1000℃)放在沉积炉内,然后以很低的流速将氮化镓气体从上面吹入炉内。研究发现平放基板时氮化镓分子无法稳定沉积到基板上,而将基板按
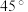 倾角斜放,却获得了非常均匀的氮化镓结晶,试分析其原因:
倾角斜放,却获得了非常均匀的氮化镓结晶,试分析其原因:
您最近一年使用:0次