解题方法
1 . 亚硝酰氯(NOCl)为红褐色液体或黄色气体,其熔点为-64.5℃,沸点为-5.5℃,具有刺鼻恶臭味,遇水剧烈水解,易溶于浓硫酸。常可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温、常压下合成。其制备装置如图所示。

(1)①用图甲中装置制备纯净干燥的原料气,试写出该装置制备氯气的离子方程式:_______ 。
②其中导管A的作用是_______ 。
(2)将制得的NO和Cl2通入图乙对应装置制备NOCl。
①装置连接顺序为a→_______ (按气流自左向右方向,用小写字母表示)。
②装置Ⅶ装无水CaCl2的仪器名称是_______ 。
③装置Ⅳ、Ⅴ的相同作用是(写两点)________ 、________ 。
(3)实验开始时,先通入氯气,再通入NO,原因是________ 。
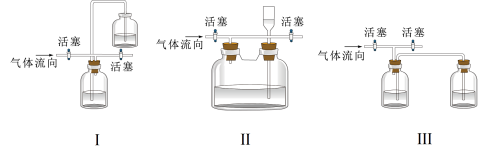
(4)有同学认为多余的氯气可以通过下列装置暂时储存然后再利用,下列可以用作氯气的储气装置的是________ (填序号)。
(5)制得的NOCl中可能含有少量N2O4杂质,为测定产品纯度进行如下实验:称取8.600g样品溶于NaOH配制成500.00mL溶液,用移液管取25.00mL溶液,加入几滴K2CrO4溶液作指示剂,用足量硝酸酸化的0.020mol/LAgNO3溶液进行滴定,消耗AgNO3溶液25.00mL。
已知:AgCl为白色沉淀溶解度1.34×10-6mol/L,Ksp(AgCl)=1.8×10-10;Ag2CrO4为砖红色沉淀溶解度6.5×10-5mol/L,Ksp(Ag2CrO4)=1.2×10-12。
①滴定终点的现象是________ 。
②样品的纯度为________ %(保留1位小数)。

(1)①用图甲中装置制备纯净干燥的原料气,试写出该装置制备氯气的离子方程式:
②其中导管A的作用是
(2)将制得的NO和Cl2通入图乙对应装置制备NOCl。
①装置连接顺序为a→
②装置Ⅶ装无水CaCl2的仪器名称是
③装置Ⅳ、Ⅴ的相同作用是(写两点)
(3)实验开始时,先通入氯气,再通入NO,原因是
(4)有同学认为多余的氯气可以通过下列装置暂时储存然后再利用,下列可以用作氯气的储气装置的是

(5)制得的NOCl中可能含有少量N2O4杂质,为测定产品纯度进行如下实验:称取8.600g样品溶于NaOH配制成500.00mL溶液,用移液管取25.00mL溶液,加入几滴K2CrO4溶液作指示剂,用足量硝酸酸化的0.020mol/LAgNO3溶液进行滴定,消耗AgNO3溶液25.00mL。
已知:AgCl为白色沉淀溶解度1.34×10-6mol/L,Ksp(AgCl)=1.8×10-10;Ag2CrO4为砖红色沉淀溶解度6.5×10-5mol/L,Ksp(Ag2CrO4)=1.2×10-12。
①滴定终点的现象是
②样品的纯度为
您最近一年使用:0次
2 . 一种废镍催化剂中含有Ni、Al、Cr、Cu、FeS及碳粉,以其为原料制备环烷酸镍[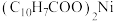 ,常温下为难溶于水的液体]的工艺流程如图所示:
,常温下为难溶于水的液体]的工艺流程如图所示:
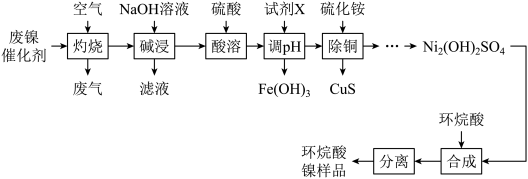
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
回答下列问题:
(1)“灼烧”后Cr转化为 ,已知
,已知 与
与 性质相似,则滤液中阴离子有
性质相似,则滤液中阴离子有 、
、___________ 。基态Cr原子的价层电子排布式为___________ 。
(2)“酸溶”时,先加入一定量的水,然后分次加入浓硫酸,与直接用稀硫酸溶解相比,其优点是___________ 。
(3)“调pH”时,溶液pH的范围为___________ 。
(4)常温下,CuS的 极小,用
极小,用 可将
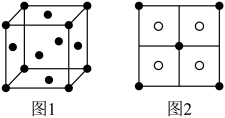
可将 完全沉淀。CuS晶胞中
完全沉淀。CuS晶胞中 的位置如图1所示,
的位置如图1所示, 位于
位于 所构成的四面体中心,晶胞侧视图如图2所示。
所构成的四面体中心,晶胞侧视图如图2所示。
①与 距离最近的
距离最近的 数目为
数目为___________ 。
②CuS的晶胞参数为apm,阿伏加德罗常数的值为 ,则CuS晶体的密度为
,则CuS晶体的密度为___________  。
。
(5)环烷酸的化学式为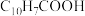 ,写出“合成”反应的化学方程式:
,写出“合成”反应的化学方程式:___________ 。
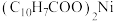 ,常温下为难溶于水的液体]的工艺流程如图所示:
,常温下为难溶于水的液体]的工艺流程如图所示:
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
| 金属离子 |  |  |  |  |
| 开始沉淀的pH | 1.9 | 7.0 | 6.4 | 5.4 |
| 完全沉淀的pH | 3.2 | 9.0 | 8.4 | 6.7 |
(1)“灼烧”后Cr转化为
 ,已知
,已知 与
与 性质相似,则滤液中阴离子有
性质相似,则滤液中阴离子有 、
、(2)“酸溶”时,先加入一定量的水,然后分次加入浓硫酸,与直接用稀硫酸溶解相比,其优点是
(3)“调pH”时,溶液pH的范围为
(4)常温下,CuS的
 极小,用
极小,用 可将
可将 完全沉淀。CuS晶胞中
完全沉淀。CuS晶胞中 的位置如图1所示,
的位置如图1所示, 位于
位于 所构成的四面体中心,晶胞侧视图如图2所示。
所构成的四面体中心,晶胞侧视图如图2所示。
①与
 距离最近的
距离最近的 数目为
数目为②CuS的晶胞参数为apm,阿伏加德罗常数的值为
 ,则CuS晶体的密度为
,则CuS晶体的密度为 。
。(5)环烷酸的化学式为
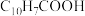 ,写出“合成”反应的化学方程式:
,写出“合成”反应的化学方程式:
您最近一年使用:0次
2023-10-16更新
|
244次组卷
|
2卷引用:湖南省长沙市第一中学2023-2024学年高三上学期月考卷(三)化学试题
名校
解题方法
3 . 一种制备Cu2O的工艺路线如图所示,反应Ⅱ所得溶液的pH为3~4,反应Ⅲ需要及时补加NaOH以保持反应在pH=5条件下进行。
已知常温下,H2SO3的电离平衡常数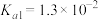 ,
,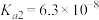 。
。

(1)反应Ⅰ中浓硫酸体现的性质是___________ 。
(2)写出反应Ⅱ的离子方程式:___________ 。
(3)低温真空蒸发的主要目的是___________ 。
(4)“固液分离”的操作名称是___________ ,指出下图操作中不规范之处:___________ 。

(5)写出反应Ⅲ的化学方程式:___________ 。在整个流程中可循环利用的物质有___________ 。
(6)若Cu2O产量不变,参与反应Ⅲ的X与CuSO4的物质的量之比 增大时,可
增大时,可___________ (填“增大”或“减少”)NaOH的量。
已知常温下,H2SO3的电离平衡常数
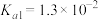 ,
,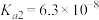 。
。
(1)反应Ⅰ中浓硫酸体现的性质是
(2)写出反应Ⅱ的离子方程式:
(3)低温真空蒸发的主要目的是
(4)“固液分离”的操作名称是

(5)写出反应Ⅲ的化学方程式:
(6)若Cu2O产量不变,参与反应Ⅲ的X与CuSO4的物质的量之比
 增大时,可
增大时,可
您最近一年使用:0次
2023-10-13更新
|
166次组卷
|
7卷引用:湖南省百校联盟2023-2024学年高三上学期9月一轮复习联考化学试题
名校
解题方法
4 . 烟道灰中含有 等,分离回收其中的金属资源可有效缓解矿藏资源不足的问题。分离回收时的流程如下:
等,分离回收其中的金属资源可有效缓解矿藏资源不足的问题。分离回收时的流程如下:

已知:
①该工艺条件下,溶液中金属离子开始沉淀和完全沉淀时的pH如下表所示。
② 的化学性质与
的化学性质与 相似。常温下,水溶液中不同形式含锌微粒物质的量浓度的对数(lgc)与pH的关系如图所示。
相似。常温下,水溶液中不同形式含锌微粒物质的量浓度的对数(lgc)与pH的关系如图所示。

回答下列问题:
(1)基态Fe原子、Mn原子核外未成对电子数之比为___________ 。
(2)试剂X可能为___________。
(3)步骤M的目的是___________ ;
(4)步骤M后应调节 的范围为
的范围为___________ ;不同 ,含
,含 微粒在体系中的存在形式不同,依据图a数据,求该温度下
微粒在体系中的存在形式不同,依据图a数据,求该温度下 的
的 为
为___________ 。
(5) 在空气中易被氧化为
在空气中易被氧化为 ,反应的化学方程式为
,反应的化学方程式为___________ 。
(6)某实验室设计了如图b所示装置,通过通入 来制备
来制备 。双极膜是阴、阳复合膜,层间的
。双极膜是阴、阳复合膜,层间的 解离成
解离成 和
和 并可分别通过阴、阳膜定向移动。石墨电极反应式为
并可分别通过阴、阳膜定向移动。石墨电极反应式为___________ 。

 等,分离回收其中的金属资源可有效缓解矿藏资源不足的问题。分离回收时的流程如下:
等,分离回收其中的金属资源可有效缓解矿藏资源不足的问题。分离回收时的流程如下:
已知:
①该工艺条件下,溶液中金属离子开始沉淀和完全沉淀时的pH如下表所示。
| 金属离子 |  |  |  |
| 开始沉淀的pH | 7.0 | 1.9 | 8.1 |
| 完全沉淀的pH | 9.0 | 3.2 | 10.1 |
 的化学性质与
的化学性质与 相似。常温下,水溶液中不同形式含锌微粒物质的量浓度的对数(lgc)与pH的关系如图所示。
相似。常温下,水溶液中不同形式含锌微粒物质的量浓度的对数(lgc)与pH的关系如图所示。
回答下列问题:
(1)基态Fe原子、Mn原子核外未成对电子数之比为
(2)试剂X可能为___________。
A. 溶液 溶液 | B.氨水 | C. 溶液 溶液 | D.稀 |
(3)步骤M的目的是
(4)步骤M后应调节
 的范围为
的范围为 ,含
,含 微粒在体系中的存在形式不同,依据图a数据,求该温度下
微粒在体系中的存在形式不同,依据图a数据,求该温度下 的
的 为
为(5)
 在空气中易被氧化为
在空气中易被氧化为 ,反应的化学方程式为
,反应的化学方程式为(6)某实验室设计了如图b所示装置,通过通入
 来制备
来制备 。双极膜是阴、阳复合膜,层间的
。双极膜是阴、阳复合膜,层间的 解离成
解离成 和
和 并可分别通过阴、阳膜定向移动。石墨电极反应式为
并可分别通过阴、阳膜定向移动。石墨电极反应式为
您最近一年使用:0次
名校
解题方法
5 . 通过绿柱石(xBeO•yAl2O3•zSiO2)获取BeO的常用方法有酸浸法和氟化法两种,其操作流程如图:
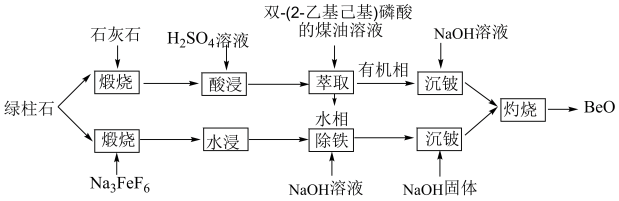
I.酸浸法:
(1)根据元素周期表“对角线原则”,Be与_______ 元素(填元素符号)性质相似。
(2)已知Be在有机相和水相中分配比(即萃取的浓度比)约为2:1,为了使Be2+的萃取率达到99%以上,可采用的有效措施有_______ 。
Ⅱ.氟化法:
(3)加Na3FeF6“煅烧”时,有Na2BeF4生成,其中[BeF4]2-的中心原子杂化方式为________ 。
(4)加入NaOH“除铁”,是为了除去过量的Na3FeF6,则发生反应的离子方程式为_______ 。
(5)常温下,加入NaOH“沉铍”,当pH=12时,沉铍率为________ (计算结果保留三位有效数字){已知:沉铍前,溶液中c(BeF )=0.2mol/L,沉铍后,溶液中c(F-)=0.2mol/L;Be2++4F-
)=0.2mol/L,沉铍后,溶液中c(F-)=0.2mol/L;Be2++4F- BeF
BeF ,K=2.5×1010;Ksp[Be(OH)2]=5.0×10-16}。若“沉铍”时pH过大,会导致沉铍率下降,原因是
,K=2.5×1010;Ksp[Be(OH)2]=5.0×10-16}。若“沉铍”时pH过大,会导致沉铍率下降,原因是________ 。
(6)绿柱石属于硅酸盐材料,其晶体结构中含有[Si6P18]环状硅酸盐单元;z轴方向上,相邻两层[Si6P18]环投影图如图甲,晶胞结构如图乙。
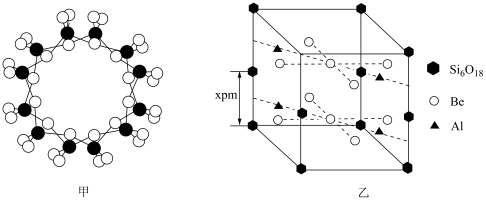

①z轴方向上,晶胞参数 为2xpm,而不是xpm的原因是
为2xpm,而不是xpm的原因是_______ 。
②已知:晶体中,Be、Al、Si均和氧配位,Be和Si的配位数(一个微粒周围最邻近的微粒的数目)均为4,氧的配位数有两种,分别为2和3,两种氧的个数比为1:2。通过计算可确定Al的配位数为________ 。

I.酸浸法:
(1)根据元素周期表“对角线原则”,Be与
(2)已知Be在有机相和水相中分配比(即萃取的浓度比)约为2:1,为了使Be2+的萃取率达到99%以上,可采用的有效措施有
Ⅱ.氟化法:
(3)加Na3FeF6“煅烧”时,有Na2BeF4生成,其中[BeF4]2-的中心原子杂化方式为
(4)加入NaOH“除铁”,是为了除去过量的Na3FeF6,则发生反应的离子方程式为
(5)常温下,加入NaOH“沉铍”,当pH=12时,沉铍率为
 )=0.2mol/L,沉铍后,溶液中c(F-)=0.2mol/L;Be2++4F-
)=0.2mol/L,沉铍后,溶液中c(F-)=0.2mol/L;Be2++4F- BeF
BeF ,K=2.5×1010;Ksp[Be(OH)2]=5.0×10-16}。若“沉铍”时pH过大,会导致沉铍率下降,原因是
,K=2.5×1010;Ksp[Be(OH)2]=5.0×10-16}。若“沉铍”时pH过大,会导致沉铍率下降,原因是(6)绿柱石属于硅酸盐材料,其晶体结构中含有[Si6P18]环状硅酸盐单元;z轴方向上,相邻两层[Si6P18]环投影图如图甲,晶胞结构如图乙。


①z轴方向上,晶胞参数
 为2xpm,而不是xpm的原因是
为2xpm,而不是xpm的原因是②已知:晶体中,Be、Al、Si均和氧配位,Be和Si的配位数(一个微粒周围最邻近的微粒的数目)均为4,氧的配位数有两种,分别为2和3,两种氧的个数比为1:2。通过计算可确定Al的配位数为
您最近一年使用:0次
解题方法
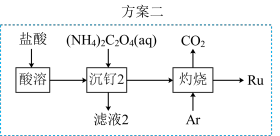
6 .  (钉)被广泛用于制笔。某小组以某含
(钉)被广泛用于制笔。某小组以某含 废料[主要成分是
废料[主要成分是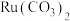 ,含
,含 (其中
(其中 为+6价)、
为+6价)、 、
、 、
、 和
和 等]为原料制备
等]为原料制备 的流程如图所示:
的流程如图所示:
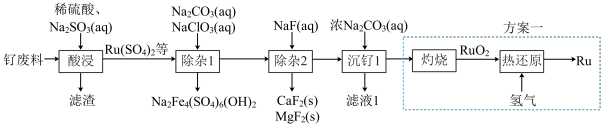
已知:常温下, ,
, ;离子浓度小于或等于
;离子浓度小于或等于 时认为该离子已被完全除去。
时认为该离子已被完全除去。
回答下列问题:
(1)滤渣主要成分是___________ (填化学式)。
(2)“酸浸”中 转化成
转化成 的离子方程式为
的离子方程式为___________ 。
(3)“除杂1”中氯元素被还原成最低价态,若只氧化 ,生成
,生成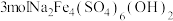 理论上需要
理论上需要___________ 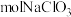 。
。
(4)“除杂1”之后,若滤液中 ,则“除杂2”中先生成的沉淀是
,则“除杂2”中先生成的沉淀是___________ (填化学式)。“除杂2”的滤液中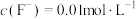 ,则
,则 和
和 是否除尽?
是否除尽?___________ (填“是”或“否”)。
(5)“除杂2”宜选择的容器有___________(填标号)。
(6)该小组设计方案2优化方案1,从安全角度分析,方案2优于方案1,其理由是___________ 。
(7) 晶胞如图所示,晶胞中,钙离子将晶胞切割成8个小空隙,
晶胞如图所示,晶胞中,钙离子将晶胞切割成8个小空隙, 可以看成是填充在
可以看成是填充在 割切的空隙中,则
割切的空隙中,则 填充在
填充在 构成的
构成的___________ (填“正八面体形”“正方形”或“正四面体形”)空隙中,其填充率为___________ 。
 (钉)被广泛用于制笔。某小组以某含
(钉)被广泛用于制笔。某小组以某含 废料[主要成分是
废料[主要成分是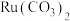 ,含
,含 (其中
(其中 为+6价)、
为+6价)、 、
、 、
、 和
和 等]为原料制备
等]为原料制备 的流程如图所示:
的流程如图所示:
已知:常温下,
 ,
, ;离子浓度小于或等于
;离子浓度小于或等于 时认为该离子已被完全除去。
时认为该离子已被完全除去。回答下列问题:
(1)滤渣主要成分是
(2)“酸浸”中
 转化成
转化成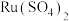 的离子方程式为
的离子方程式为(3)“除杂1”中氯元素被还原成最低价态,若只氧化
 ,生成
,生成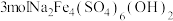 理论上需要
理论上需要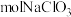 。
。(4)“除杂1”之后,若滤液中
 ,则“除杂2”中先生成的沉淀是
,则“除杂2”中先生成的沉淀是 ,则
,则 和
和 是否除尽?
是否除尽?(5)“除杂2”宜选择的容器有___________(填标号)。
| A.陶瓷 | B.铁质 | C.石英 | D.氧化铝 |
(6)该小组设计方案2优化方案1,从安全角度分析,方案2优于方案1,其理由是

(7)
 晶胞如图所示,晶胞中,钙离子将晶胞切割成8个小空隙,
晶胞如图所示,晶胞中,钙离子将晶胞切割成8个小空隙, 可以看成是填充在
可以看成是填充在 割切的空隙中,则
割切的空隙中,则 填充在
填充在 构成的
构成的
您最近一年使用:0次
7 . 以湿法炼锌厂所产的钴锰渣(主要成分为 Co2O3、CoO、NiO、MnO2,含少量 Fe2O3、ZnO、CuO、CaO 等)为原料回收制备 CoC2O4 的工艺如下:

已知:“酸浸”后溶液中含有 Co2+、Mn2+、Ni2+、Fe2+、Zn2+、Ca2+、Cu2+。常温下, Ka1(H2S)=1.0×10-7,Ka2(H2S)=7.0×10-15;Ksp(CuS)=1.3×10-36,Ksp[Cu(OH)2]=2.2×10-20, Ksp(ZnS)=1.3×10-24。回答下列问题:
(1)“酸浸”时可能产生有毒气体_______ ,说出该气体的一种用途_______ 。
(2)“氧化调 pH”过程中得到KFe3(SO4)2(OH)6的离子方程式为_______ 。
(3)试分析Cu2+主要以_______ [填“CuS”或“Cu(OH)2”]形式除去。
(4)“滤渣 3”中含有 a mol S、b mol MnO2,则理论上需要Co(OH)3的物质的量为_______ mol (用含 a、b 的式子表示)。
(5)采用双萃取剂 P204、P507 分离钴镍。P204、P507 对金属离子的萃取率与 pH 的关系如下图所示。
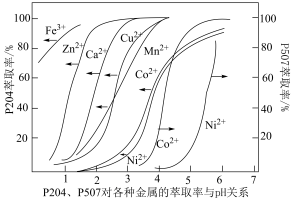
①直接用于分离钴镍的萃取剂是_______ 。
②指出分离钴镍的合适pH范围为_______ (填标号)。
A.3~4 B.4~5 C.5~6 D.6~7

已知:“酸浸”后溶液中含有 Co2+、Mn2+、Ni2+、Fe2+、Zn2+、Ca2+、Cu2+。常温下, Ka1(H2S)=1.0×10-7,Ka2(H2S)=7.0×10-15;Ksp(CuS)=1.3×10-36,Ksp[Cu(OH)2]=2.2×10-20, Ksp(ZnS)=1.3×10-24。回答下列问题:
(1)“酸浸”时可能产生有毒气体
(2)“氧化调 pH”过程中得到KFe3(SO4)2(OH)6的离子方程式为
(3)试分析Cu2+主要以
(4)“滤渣 3”中含有 a mol S、b mol MnO2,则理论上需要Co(OH)3的物质的量为
(5)采用双萃取剂 P204、P507 分离钴镍。P204、P507 对金属离子的萃取率与 pH 的关系如下图所示。

①直接用于分离钴镍的萃取剂是
②指出分离钴镍的合适pH范围为
A.3~4 B.4~5 C.5~6 D.6~7
您最近一年使用:0次
8 .  三氧化二钴(Co2O3)主要用作颜料、釉料、磁性材料、催化剂和氧化剂等。用某工业含钴废料(主要成分为Co2O3,含有少量PbO、NiO、FeO、SiO2)制备Co2O3和Ni(OH)2的流程如下:
三氧化二钴(Co2O3)主要用作颜料、釉料、磁性材料、催化剂和氧化剂等。用某工业含钴废料(主要成分为Co2O3,含有少量PbO、NiO、FeO、SiO2)制备Co2O3和Ni(OH)2的流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH范围如下表:
回答下列问题:
(1)滤渣1的主要成分是___________ (填物质名称);检验滤渣2中阳离子可选用的化学试剂为___________ (填化学式)。
(2)“调pH”时,调节pH的范围是___________ ;“高温煅烧”时,如果是在实验室中进行该项操作,装Co2(OH)2CO3的仪器名称是___________ 。
(3)“酸浸”时H2O2的作用是___________ 。
(4)“沉镍”时发生反应的离子方程式为___________ ;此步骤需加热,温度不能太高也不能太低,原因是___________ 。
 三氧化二钴(Co2O3)主要用作颜料、釉料、磁性材料、催化剂和氧化剂等。用某工业含钴废料(主要成分为Co2O3,含有少量PbO、NiO、FeO、SiO2)制备Co2O3和Ni(OH)2的流程如下:
三氧化二钴(Co2O3)主要用作颜料、釉料、磁性材料、催化剂和氧化剂等。用某工业含钴废料(主要成分为Co2O3,含有少量PbO、NiO、FeO、SiO2)制备Co2O3和Ni(OH)2的流程如下:已知:部分阳离子以氢氧化物形式沉淀时溶液的pH范围如下表:
| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Co(OH)2 | Ni(OH)2 |
| 开始沉淀时的pH | 7.5 | 2.7 | 7.6 | 6.9 |
| 完全沉淀时的pH | 9.7 | 3.7 | 9.0 | 9.2 |
(1)滤渣1的主要成分是
(2)“调pH”时,调节pH的范围是
(3)“酸浸”时H2O2的作用是
(4)“沉镍”时发生反应的离子方程式为
您最近一年使用:0次
名校
解题方法
9 . 钪(Sc)元素在国防、航天、激光、核能、医疗等方面有广泛应用。我国某地的矿山富含铜多金属矿(主要含Cu2S、Sc2S3、FeS、CaS和SiO2),科研人员从矿石中综合回收金属钪的工艺流程设计如下:

已知:①"萃取"时发生反应有: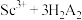 (有机液)
(有机液) Sc(HA2)3(有机相)+3H+;Fe3++3H2A2(有机液)
Sc(HA2)3(有机相)+3H+;Fe3++3H2A2(有机液) Fe(HA2)3+3H+
Fe(HA2)3+3H+
②常温下,“萃取”前溶液中 c(Sc3+)=0.60 ,Ksp[Sc(OH)3]=6.0
,Ksp[Sc(OH)3]=6.0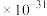 ;
;
请回答下列问题:
(1)“加热酸溶”时需要搅拌,目的是___________ ,产生的气体是___________ (写化学式)。
(2)滤渣Ⅱ的主要成分为___________ 。
(3)“萃取”过程中需控制好“萃取”前溶液pH,过大或者过小都会影响有机试剂的Sc3+萃取率,计算Sc3+萃取率最大时的pH=___________ 。
(4)已知25℃时,Ka1(H2C2O4)=a,Ka2(H2C2O4)=b,Ksp[Sc2(C2O4)3]=c。“沉钪”时,发生反应:2Sc3++3H2C2O4=Sc2(C2O4)3 +6H+,该反应的平衡常数K=
+6H+,该反应的平衡常数K=___________ (用含a、b、c的代数式表示)。
(5)在空气中煅烧生成Sc2O3的化学方程式为___________ 。
(6)“电解”过程中,用石墨和液态锌作电极,KCl、LiCl、ScCl3熔融物作电解液,液态锌是___________ (填“阳极”或“阴极”),阳极反应式为___________ 。

已知:①"萃取"时发生反应有:
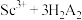 (有机液)
(有机液) Sc(HA2)3(有机相)+3H+;Fe3++3H2A2(有机液)
Sc(HA2)3(有机相)+3H+;Fe3++3H2A2(有机液) Fe(HA2)3+3H+
Fe(HA2)3+3H+②常温下,“萃取”前溶液中 c(Sc3+)=0.60
 ,Ksp[Sc(OH)3]=6.0
,Ksp[Sc(OH)3]=6.0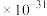 ;
;请回答下列问题:
(1)“加热酸溶”时需要搅拌,目的是
(2)滤渣Ⅱ的主要成分为
(3)“萃取”过程中需控制好“萃取”前溶液pH,过大或者过小都会影响有机试剂的Sc3+萃取率,计算Sc3+萃取率最大时的pH=
(4)已知25℃时,Ka1(H2C2O4)=a,Ka2(H2C2O4)=b,Ksp[Sc2(C2O4)3]=c。“沉钪”时,发生反应:2Sc3++3H2C2O4=Sc2(C2O4)3
 +6H+,该反应的平衡常数K=
+6H+,该反应的平衡常数K=(5)在空气中煅烧生成Sc2O3的化学方程式为
(6)“电解”过程中,用石墨和液态锌作电极,KCl、LiCl、ScCl3熔融物作电解液,液态锌是
您最近一年使用:0次
名校
解题方法
10 . 一种废旧三元( )锂电池负极材料主要为石墨,有价金属(Li、Ni、Co、Mn),还含有少量的钙元素。某研究小组从报废该三元锂离子电池负极活性材料中回收石墨和碳酸锂,工艺路线如图。
)锂电池负极材料主要为石墨,有价金属(Li、Ni、Co、Mn),还含有少量的钙元素。某研究小组从报废该三元锂离子电池负极活性材料中回收石墨和碳酸锂,工艺路线如图。

已知:①溶液中金属离子开始沉淀和完全沉淀的pH如表所示;
②LiOH易溶于水,Li2CO3难溶于水。
回答下列问题:
(1)提高酸浸速率的措施有___________ (答出一条即可)。
(2)“调pH”步骤中,pH最小达到___________ ;“除杂”步骤后,主要杂质离子的沉淀形式为___________ 。
(3)稀硫酸的浓度、反应固液比对锂的浸出率的影响如图,代表反应固液比(每升液体所含的固体质量)对锂浸出率影响的曲线是___________ (填“Ⅰ”或“Ⅱ”),选择的最佳工艺条件:稀硫酸的浓度是___________ ,反应固液比是___________ 。

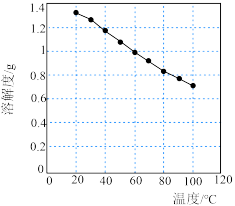
(4)碳酸锂的溶解度随温度变化如图所示。向“除杂”后的溶液中加入Na2CO3溶液,将温度升至90℃是为了提高沉淀反应速率和___________ 。得到碳酸锂沉淀的操作为___________ (填字母)。
a.静置,过滤 b.加热后,趁热过滤 c蒸发浓缩、冷却结晶 d蒸发结晶
(5)取100 mL“除杂”后的溶液,其中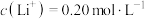 ,为使锂元素的回收率不低于70%,则至少应加入Na2CO3固体的质量为
,为使锂元素的回收率不低于70%,则至少应加入Na2CO3固体的质量为___________ g[已知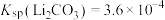 ]。
]。
 )锂电池负极材料主要为石墨,有价金属(Li、Ni、Co、Mn),还含有少量的钙元素。某研究小组从报废该三元锂离子电池负极活性材料中回收石墨和碳酸锂,工艺路线如图。
)锂电池负极材料主要为石墨,有价金属(Li、Ni、Co、Mn),还含有少量的钙元素。某研究小组从报废该三元锂离子电池负极活性材料中回收石墨和碳酸锂,工艺路线如图。
已知:①溶液中金属离子开始沉淀和完全沉淀的pH如表所示;
| 金属离子 | Co2+ | Ni2+ | Mn2+ |
| 开始沉淀的pH | 7.15 | 7.2 | 8.1 |
| 沉淀完全的pH | 9.25 | 9.2 | 10.1 |
回答下列问题:
(1)提高酸浸速率的措施有
(2)“调pH”步骤中,pH最小达到
(3)稀硫酸的浓度、反应固液比对锂的浸出率的影响如图,代表反应固液比(每升液体所含的固体质量)对锂浸出率影响的曲线是

(4)碳酸锂的溶解度随温度变化如图所示。向“除杂”后的溶液中加入Na2CO3溶液,将温度升至90℃是为了提高沉淀反应速率和

a.静置,过滤 b.加热后,趁热过滤 c蒸发浓缩、冷却结晶 d蒸发结晶
(5)取100 mL“除杂”后的溶液,其中
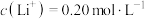 ,为使锂元素的回收率不低于70%,则至少应加入Na2CO3固体的质量为
,为使锂元素的回收率不低于70%,则至少应加入Na2CO3固体的质量为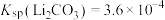 ]。
]。
您最近一年使用:0次
2023-09-23更新
|
255次组卷
|
7卷引用:湖南省百校联盟2023-2024学年高三上学期9月一轮复习联考化学试题



