1 . 碳酸锰可用作脱硫的催化剂,是合成二氧化锰和制造其他锰盐的原料。工业上从锰泥(主要含 和少量
和少量 、
、 、
、 等)中回收
等)中回收 的流程如图所示:
的流程如图所示:

回答下列问题:
(1)滤渣1中的主要成分为 ,其中Pb元素的化合价是
,其中Pb元素的化合价是__________ 。
(2) 能将
能将 还原为
还原为 ,写出该反应的离子方程式:
,写出该反应的离子方程式:__________ 。为检验 是否被氧化,可往滤液1中加入
是否被氧化,可往滤液1中加入__________ 溶液(填化学式)。
(3)常温下,已知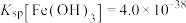 ,通入
,通入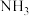 调
调 时,溶液中
时,溶液中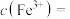
__________ 。
(4)写出加入氨水和过量 生成
生成 沉淀的离子方程式:
沉淀的离子方程式:__________ 。
(5)处理锰泥时, 、
、 混合溶液中
混合溶液中 比值不宜过大,请从节约药品的角度分析,原因是
比值不宜过大,请从节约药品的角度分析,原因是__________ 。
 和少量
和少量 、
、 、
、 等)中回收
等)中回收 的流程如图所示:
的流程如图所示:
回答下列问题:
(1)滤渣1中的主要成分为
 ,其中Pb元素的化合价是
,其中Pb元素的化合价是(2)
 能将
能将 还原为
还原为 ,写出该反应的离子方程式:
,写出该反应的离子方程式: 是否被氧化,可往滤液1中加入
是否被氧化,可往滤液1中加入(3)常温下,已知
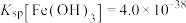 ,通入
,通入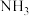 调
调 时,溶液中
时,溶液中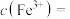
(4)写出加入氨水和过量
 生成
生成 沉淀的离子方程式:
沉淀的离子方程式:(5)处理锰泥时,
 、
、 混合溶液中
混合溶液中 比值不宜过大,请从节约药品的角度分析,原因是
比值不宜过大,请从节约药品的角度分析,原因是
您最近一年使用:0次
名校
解题方法
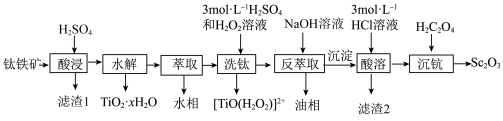
2 . 氧化钪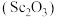 可用作半导体镀层的蒸镀材料,也可制成可变波长的固体激光器和高清晰度的电视电子枪、金属卤化物灯等。从钛铁矿(主要成分为
可用作半导体镀层的蒸镀材料,也可制成可变波长的固体激光器和高清晰度的电视电子枪、金属卤化物灯等。从钛铁矿(主要成分为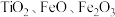 ,还含有
,还含有 等元素)中提取
等元素)中提取 的流程如下图。
的流程如下图。
已知:
①当离子浓度减小至 时可认为沉淀完全。
时可认为沉淀完全。
②室温下 完全沉淀的
完全沉淀的 为1.05。
为1.05。
③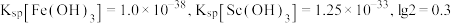 。
。
回答下列问题:
(1)“酸浸”后 元素转化为
元素转化为 ,其水解反应的离子方程式是
,其水解反应的离子方程式是_______ 。
(2) 既有氧化性又有还原性,还有弱酸性,请写出它的电离方程式
既有氧化性又有还原性,还有弱酸性,请写出它的电离方程式_______ 。
(3)萃取剂萃取 的反应原理为阳离子交换:
的反应原理为阳离子交换: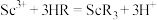 (
( 代表萃取剂)。在“反萃取”中反应生成含
代表萃取剂)。在“反萃取”中反应生成含 化合物的化学方程式是
化合物的化学方程式是_______ 。
(4)“酸溶”后滤液中存在的金属阳离子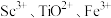 浓度均小于
浓度均小于 ,再用氨水调节溶液
,再用氨水调节溶液 使
使 、
、 沉淀完全而
沉淀完全而 不沉淀,则调
不沉淀,则调 应控制的范围是
应控制的范围是_______ 。
(5)由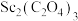 在空气中煅烧生成
在空气中煅烧生成 的化学反应方程式
的化学反应方程式_______ 。
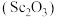 可用作半导体镀层的蒸镀材料,也可制成可变波长的固体激光器和高清晰度的电视电子枪、金属卤化物灯等。从钛铁矿(主要成分为
可用作半导体镀层的蒸镀材料,也可制成可变波长的固体激光器和高清晰度的电视电子枪、金属卤化物灯等。从钛铁矿(主要成分为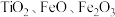 ,还含有
,还含有 等元素)中提取
等元素)中提取 的流程如下图。
的流程如下图。
已知:
①当离子浓度减小至
 时可认为沉淀完全。
时可认为沉淀完全。②室温下
 完全沉淀的
完全沉淀的 为1.05。
为1.05。③
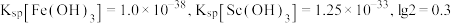 。
。回答下列问题:
(1)“酸浸”后
 元素转化为
元素转化为 ,其水解反应的离子方程式是
,其水解反应的离子方程式是(2)
 既有氧化性又有还原性,还有弱酸性,请写出它的电离方程式
既有氧化性又有还原性,还有弱酸性,请写出它的电离方程式(3)萃取剂萃取
 的反应原理为阳离子交换:
的反应原理为阳离子交换: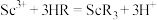 (
( 代表萃取剂)。在“反萃取”中反应生成含
代表萃取剂)。在“反萃取”中反应生成含 化合物的化学方程式是
化合物的化学方程式是(4)“酸溶”后滤液中存在的金属阳离子
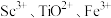 浓度均小于
浓度均小于 ,再用氨水调节溶液
,再用氨水调节溶液 使
使 、
、 沉淀完全而
沉淀完全而 不沉淀,则调
不沉淀,则调 应控制的范围是
应控制的范围是(5)由
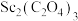 在空气中煅烧生成
在空气中煅烧生成 的化学反应方程式
的化学反应方程式
您最近一年使用:0次
2023-12-19更新
|
302次组卷
|
2卷引用:湖南省雅礼教育集团2023-2024学年高二上学期期中考试化学试题
3 . I.实验室由普通锌锰电池的锌皮[主要成分是Zn,还含有少量杂质Fe和粘附的Zn(NH3)2Cl2]为原料制取纳米氧化锌和鸟粪石(MgNH4PO4),其主要实验流程如下:
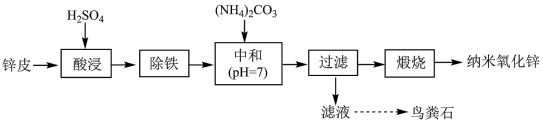
(1)“除铁”包括氧化和沉铁。“氧化”时,向“酸浸”后的溶液中加入过量的双氧水,反应的离子方程式为___________ ;检验“除铁”完全的实验操作是___________ 。
(2)将“过滤”后的滤液与MgSO4、Na2HPO4溶液反应,生成鸟粪石沉淀。
已知常温下:Ksp(MgNH4PO4)=2.5×10-13,Ksp[Mg3(PO4)2]=9.8×10-25,Ksp[Mg(OH)2]=1.8×10-11
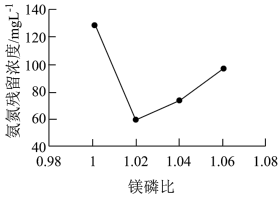
①镁磷比[ ]与氨氮残留浓度的关系如图所示。当镁磷比小于1.02时,随镁磷比的增大,氨氮残留浓度减小的原因是
]与氨氮残留浓度的关系如图所示。当镁磷比小于1.02时,随镁磷比的增大,氨氮残留浓度减小的原因是___________ 。
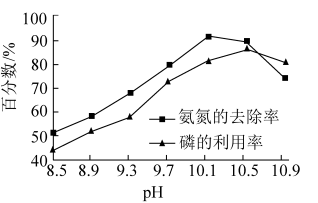
②镁磷比一定,氨氮的去除率和磷的利用率与溶液pH的关系如图所示。当pH为10.1~10.5时,除了生成鸟粪石外,还会生成___________ (填化学式);当pH>10.5时,氨氮去除率和磷的利用率均减小的原因是___________ 。
Ⅱ.室温下,向体积为2L的恒容密闭容器中通入4molH2和1molCO2发生Sabatier反应:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)(不考虑副反应);若反应时保持温度恒定,测得反应过程中压强随时间的变化如下表所示:
(3)①0~10min内,v(CO2)=___________
②Sabatier反应的速率方程:v正=k正c(CO2)c4(H2),v逆=k逆c(CH4)c2(H2O)(k是速率常数,只与温度有关)。20min时,
___________ 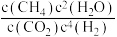 ;反应达平衡时,升高温度,k正增大的倍数
;反应达平衡时,升高温度,k正增大的倍数___________ k逆增大的倍数。(填“>”“<”或“=”)。

(1)“除铁”包括氧化和沉铁。“氧化”时,向“酸浸”后的溶液中加入过量的双氧水,反应的离子方程式为
(2)将“过滤”后的滤液与MgSO4、Na2HPO4溶液反应,生成鸟粪石沉淀。
已知常温下:Ksp(MgNH4PO4)=2.5×10-13,Ksp[Mg3(PO4)2]=9.8×10-25,Ksp[Mg(OH)2]=1.8×10-11
①镁磷比[
 ]与氨氮残留浓度的关系如图所示。当镁磷比小于1.02时,随镁磷比的增大,氨氮残留浓度减小的原因是
]与氨氮残留浓度的关系如图所示。当镁磷比小于1.02时,随镁磷比的增大,氨氮残留浓度减小的原因是
②镁磷比一定,氨氮的去除率和磷的利用率与溶液pH的关系如图所示。当pH为10.1~10.5时,除了生成鸟粪石外,还会生成

Ⅱ.室温下,向体积为2L的恒容密闭容器中通入4molH2和1molCO2发生Sabatier反应:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)(不考虑副反应);若反应时保持温度恒定,测得反应过程中压强随时间的变化如下表所示:
| 时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 压强 | 5.00p | 4.60p | 4.30p | 4.15p | 4.06p | 4.00p | 4.00p |
(3)①0~10min内,v(CO2)=
②Sabatier反应的速率方程:v正=k正c(CO2)c4(H2),v逆=k逆c(CH4)c2(H2O)(k是速率常数,只与温度有关)。20min时,

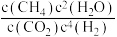 ;反应达平衡时,升高温度,k正增大的倍数
;反应达平衡时,升高温度,k正增大的倍数
您最近一年使用:0次
解题方法
4 . 磷酸亚铁锂( )为近来新开发的锂离子电池电极材料,主要用于动力锂离子电池,
)为近来新开发的锂离子电池电极材料,主要用于动力锂离子电池, 废料中(含Al、石墨),其中磷、铁、锂的综合回收工艺流程图如下:
废料中(含Al、石墨),其中磷、铁、锂的综合回收工艺流程图如下: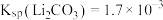
②LiOH、 的溶解度与温度的关系如下表:
的溶解度与温度的关系如下表:
(1)过程I“碱浸”的目的是___________ 。
(2)若浸出液中存在大量 离子,则反应的离子方程式为
离子,则反应的离子方程式为___________ 。
(3)①过程III得到“沉淀Y”的离子方程式为___________ 。
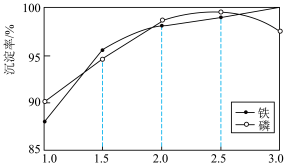
②一定条件下,探究了pH对磷酸铁沉淀的影响,结果如下图所示。由图可知,过程III应选取的最佳沉淀时的pH为___________ 。随pH的增加,磷的沉淀率开始下降,而铁沉淀率未下降,分析原因为___________ 。___________ 。
A.NaOH20-40℃ B.NaOH80-100℃
C. 20-40℃ D.
20-40℃ D. 60-80℃
60-80℃
②常温下,测得滤液1中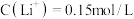 ,某同学取该100ml滤液进行“沉锂”反应。加入50mlX溶液却未见沉淀,若不考虑液体混合时的体积变化,则该同学加入的X溶液最大浓度为
,某同学取该100ml滤液进行“沉锂”反应。加入50mlX溶液却未见沉淀,若不考虑液体混合时的体积变化,则该同学加入的X溶液最大浓度为
___________  。
。
 )为近来新开发的锂离子电池电极材料,主要用于动力锂离子电池,
)为近来新开发的锂离子电池电极材料,主要用于动力锂离子电池, 废料中(含Al、石墨),其中磷、铁、锂的综合回收工艺流程图如下:
废料中(含Al、石墨),其中磷、铁、锂的综合回收工艺流程图如下: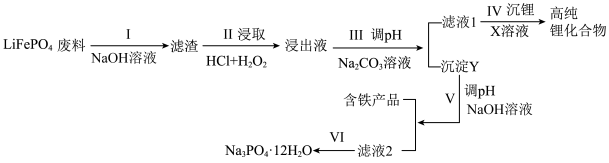
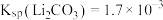
②LiOH、
 的溶解度与温度的关系如下表:
的溶解度与温度的关系如下表:| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度/g | LiOH | 11.9 | 12.4 | 13.2 | 14.6 | 16.6 | 19.1 |
 | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 | |
(1)过程I“碱浸”的目的是
(2)若浸出液中存在大量
 离子,则反应的离子方程式为
离子,则反应的离子方程式为(3)①过程III得到“沉淀Y”的离子方程式为
②一定条件下,探究了pH对磷酸铁沉淀的影响,结果如下图所示。由图可知,过程III应选取的最佳沉淀时的pH为
A.NaOH20-40℃ B.NaOH80-100℃
C.
 20-40℃ D.
20-40℃ D. 60-80℃
60-80℃②常温下,测得滤液1中
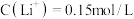 ,某同学取该100ml滤液进行“沉锂”反应。加入50mlX溶液却未见沉淀,若不考虑液体混合时的体积变化,则该同学加入的X溶液最大浓度为
,某同学取该100ml滤液进行“沉锂”反应。加入50mlX溶液却未见沉淀,若不考虑液体混合时的体积变化,则该同学加入的X溶液最大浓度为
 。
。
您最近一年使用:0次
2023-12-05更新
|
401次组卷
|
3卷引用:湖南省湘西州吉首市2024届高三上学期第二届中小学生教师解题大赛化学试题
湖南省湘西州吉首市2024届高三上学期第二届中小学生教师解题大赛化学试题山西运城新康国际中学2023-2024学年高三上学期一轮复习检测化学试卷(已下线)大题01 化工流程综合题(逐空突破)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)
名校
解题方法
5 . 某废钒渣(主要成分为V2O3,含有少量Al2O3、CaO)为原料生产V2O5的工艺流程如图:
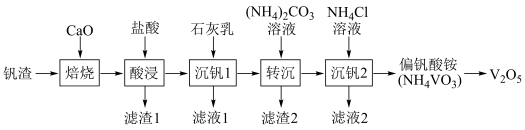
已知:钒酸(H3VO4)是强酸,NH4VO3难溶于水;+5价钒在溶液中的主要存在形式与溶液pH的关系如表。
(1)向钒渣中加入生石灰焙烧,将V2O3转化为Ca(VO3)2的化学方程式为_______ 。
(2)已知Ca(VO3)2难溶于水,可溶于盐酸。若“酸浸”时溶液的pH=4,则Ca(VO3)2溶于盐酸的离子方程式为_______ 。
(3)已知加入石灰乳后生成Ca3(VO4)2沉淀,则加入石灰乳的作用是_______ 。
(4)反应Ca3(VO4)2(s)+3 (aq)⇌2VO
(aq)⇌2VO (aq)+3CaCO3(s)的平衡常数为
(aq)+3CaCO3(s)的平衡常数为_______ (用含m,n的代数式表示),已知:Ksp(CaCO3)=m,Ksp[Ca3(VO4)2]=n。
(5)沉钒2过程中加入氯化铵溶液,控制溶液的pH=7.5,当pH>8时,NH4VO3的产量明显降低,原因是_______ 。
(6)测定产品中V2O5的纯度:取ag产品用硫酸溶解得(VO2)2SO4溶液,加入b1mLclmol·L-1(NH4)2Fe(SO4)2溶液(VO +2H++Fe2+=VO2++Fe3++H2O),再用c2mol·L-1KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。已知
+2H++Fe2+=VO2++Fe3++H2O),再用c2mol·L-1KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。已知 被还原为Mn2+,假设杂质不参与反应。
被还原为Mn2+,假设杂质不参与反应。
①滴定时装KMnO4溶液为_______ 滴定管(填“酸式”或“碱式”)
②则产品中V2O5的质量分数是_______ (V2O5的摩尔质量为Mg·mol-1)。
(7)下列操作会导致测定的纯度偏高的是_______。

已知:钒酸(H3VO4)是强酸,NH4VO3难溶于水;+5价钒在溶液中的主要存在形式与溶液pH的关系如表。
| pH | 4~6 | 6~8 | 8~10 | 10~12 |
| 主要离子 | VO |  | V2O | VO |
(1)向钒渣中加入生石灰焙烧,将V2O3转化为Ca(VO3)2的化学方程式为
(2)已知Ca(VO3)2难溶于水,可溶于盐酸。若“酸浸”时溶液的pH=4,则Ca(VO3)2溶于盐酸的离子方程式为
(3)已知加入石灰乳后生成Ca3(VO4)2沉淀,则加入石灰乳的作用是
(4)反应Ca3(VO4)2(s)+3
 (aq)⇌2VO
(aq)⇌2VO (aq)+3CaCO3(s)的平衡常数为
(aq)+3CaCO3(s)的平衡常数为(5)沉钒2过程中加入氯化铵溶液,控制溶液的pH=7.5,当pH>8时,NH4VO3的产量明显降低,原因是
(6)测定产品中V2O5的纯度:取ag产品用硫酸溶解得(VO2)2SO4溶液,加入b1mLclmol·L-1(NH4)2Fe(SO4)2溶液(VO
 +2H++Fe2+=VO2++Fe3++H2O),再用c2mol·L-1KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。已知
+2H++Fe2+=VO2++Fe3++H2O),再用c2mol·L-1KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。已知 被还原为Mn2+,假设杂质不参与反应。
被还原为Mn2+,假设杂质不参与反应。①滴定时装KMnO4溶液为
②则产品中V2O5的质量分数是
(7)下列操作会导致测定的纯度偏高的是_______。
| A.锥形瓶水洗后未干燥 |
| B.滴定前滴定管尖嘴有气泡,滴定结束无气泡 |
| C.滴定终点时俯视读数 |
| D.滴定管用蒸馏水洗净后未用标准溶液润洗 |
您最近一年使用:0次
名校
解题方法
6 . 钛(Ti)的性质稳定,有良好的耐高温、抗酸碱、高强度、低密度等特性,工业上常用钛铁矿(主要含FeTiO3和少量SiO2、MgO、Al2O3、Fe2O3等)通过如图所示工艺流程制取钛,并回收镁、铝、铁等。

已知:①TiO2+易水解,只能存在于强酸性溶液中;
②常温下,相关金属离子开始沉淀和沉淀完全的pH如表所示。
(1)为了提高“酸溶”的速率,可采取的措施有_____ (任写一点)
(2)“酸溶”后,钛主要以TiO2+形式存在,写出相应反应的离子方程式:_____ 。
(3)“分步沉淀”时用氨水逐步调节pH至11.1,依次析出的金属离子是_____ (填离子符号);当Mg2+沉淀完全时,“母液”中Al3+的浓度为_____ mol·L-1。
(4)“水浸”后,过滤、洗涤得水浸渣(TiO2·xH2O),检验TiO2·xH2O已洗涤干净的方法为_____ 。
(5)“氯化”过程在高温下会生成一种有毒气体,写出“氯化”过程的化学方程式_____ 。
(6)“还原”在800~900℃及惰性气体的保护下进行,要在惰性气体的保护下进行的原因是_____ 。

已知:①TiO2+易水解,只能存在于强酸性溶液中;
②常温下,相关金属离子开始沉淀和沉淀完全的pH如表所示。
| 金属离子 | Fe3+ | Fe2+ | Al3+ | Mg2+ |
| 开始沉淀的pH | 2.2 | 6.5 | 3.5 | 9.5 |
| 沉淀完全(c=1.0×10-5mol/L)的pH | 3.2 | 9.7 | 4.7 | 11.1 |
(1)为了提高“酸溶”的速率,可采取的措施有
(2)“酸溶”后,钛主要以TiO2+形式存在,写出相应反应的离子方程式:
(3)“分步沉淀”时用氨水逐步调节pH至11.1,依次析出的金属离子是
(4)“水浸”后,过滤、洗涤得水浸渣(TiO2·xH2O),检验TiO2·xH2O已洗涤干净的方法为
(5)“氯化”过程在高温下会生成一种有毒气体,写出“氯化”过程的化学方程式
(6)“还原”在800~900℃及惰性气体的保护下进行,要在惰性气体的保护下进行的原因是
您最近一年使用:0次
2023-11-20更新
|
558次组卷
|
2卷引用:湖南省部分校联考2023-2024学年高二上学期期中考试化学试题
名校
7 . 活性氧化锰( )和硫酸铅(
)和硫酸铅( )均为重要的电极材料,利用下列流程可实现二者的联合生产。回答下列问题:
)均为重要的电极材料,利用下列流程可实现二者的联合生产。回答下列问题: ,铅闪矿的主要成分是PbS和铁的硫化物。
,铅闪矿的主要成分是PbS和铁的硫化物。
(1)为了提高“热浸出”的速率,除了升温、搅拌、粉碎之外,还可采用___________ ,“热浸出”时温度不超过80℃,其主要原因是___________ 。
(2) 在冷水中溶解度不大,易沉积在矿石表面阻碍矿石的溶解,为了避免此种情况的出现,生产过程的“热浸出”步骤中采用了两种措施:
在冷水中溶解度不大,易沉积在矿石表面阻碍矿石的溶解,为了避免此种情况的出现,生产过程的“热浸出”步骤中采用了两种措施:
①采用“热浸出”,增大 的溶解度;
的溶解度;
②加入NaCl,将 转化为可溶的
转化为可溶的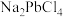 。[
。[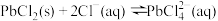
 ]。
]。
写出“热浸出”步骤中PbS转化为 的化学方程式
的化学方程式___________ ,“分铅”步骤中有利于从溶液中析出 的措施有
的措施有___________ 、___________ (从平衡移动角度作答)。
(3)“除杂”步骤中加入 的作用是
的作用是___________ 。
(4)“沉锰”步骤需要在加热条件下进行,写出反应的离子方程式___________ 。
(5)“转化”步骤完成后溶液中的 浓度为
浓度为 ,则此时溶液中的
,则此时溶液中的 浓度为
浓度为___________ mol/L。(已知: 、
、 的溶度积分别为
的溶度积分别为 、
、 )
)
 )和硫酸铅(
)和硫酸铅( )均为重要的电极材料,利用下列流程可实现二者的联合生产。回答下列问题:
)均为重要的电极材料,利用下列流程可实现二者的联合生产。回答下列问题:
 ,铅闪矿的主要成分是PbS和铁的硫化物。
,铅闪矿的主要成分是PbS和铁的硫化物。(1)为了提高“热浸出”的速率,除了升温、搅拌、粉碎之外,还可采用
(2)
 在冷水中溶解度不大,易沉积在矿石表面阻碍矿石的溶解,为了避免此种情况的出现,生产过程的“热浸出”步骤中采用了两种措施:
在冷水中溶解度不大,易沉积在矿石表面阻碍矿石的溶解,为了避免此种情况的出现,生产过程的“热浸出”步骤中采用了两种措施:①采用“热浸出”,增大
 的溶解度;
的溶解度;②加入NaCl,将
 转化为可溶的
转化为可溶的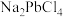 。[
。[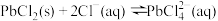
 ]。
]。写出“热浸出”步骤中PbS转化为
 的化学方程式
的化学方程式 的措施有
的措施有(3)“除杂”步骤中加入
 的作用是
的作用是(4)“沉锰”步骤需要在加热条件下进行,写出反应的离子方程式
(5)“转化”步骤完成后溶液中的
 浓度为
浓度为 ,则此时溶液中的
,则此时溶液中的 浓度为
浓度为 、
、 的溶度积分别为
的溶度积分别为 、
、 )
)
您最近一年使用:0次
2023-11-15更新
|
408次组卷
|
5卷引用:湖南省邵阳市第二中学2023-2024学年高三下学期2月月考化学试题
8 . 我国钛资源丰富,但钛矿品位低,且有一半的钛资源是以类质同象形式赋存于钒钛磁铁矿中,难以利用,因此需通过冶炼形成钛渣后再用于提取二氧化钛。利用钛渣(主要成分为 ,含少量铁的氧化物等)采用混合硫酸法制备
,含少量铁的氧化物等)采用混合硫酸法制备 ,该工艺适用于高品钛。具体流程如下:
,该工艺适用于高品钛。具体流程如下:

已知:①六氯钛酸钾是一种无机物,化学式 ,可溶于热水,微溶于冷水。
,可溶于热水,微溶于冷水。
②
③当离子浓度小于10⁻⁵mol/L时视为沉淀完全。
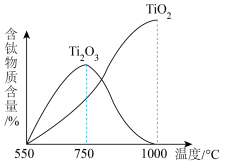
 与氧气反应产物含钛物质含量随温度变化如图所示。
与氧气反应产物含钛物质含量随温度变化如图所示。
请回答:
(1)为提高酸解率,可以采用的措施有___________ 。(任写一点)
(2)向 溶液中加入KCl、HCl充分反应后,通过一系列操作可以获得
溶液中加入KCl、HCl充分反应后,通过一系列操作可以获得 晶体,请写出具体操作
晶体,请写出具体操作___________ 、过滤、洗涤、干燥。
(3) 晶体进行加热分解生成
晶体进行加热分解生成 和“残渣”,“残渣”是
和“残渣”,“残渣”是___________ 。
(4)室温下,若 的
的 为
为 ,若要使得
,若要使得 中的
中的 完全沉淀,需调节pH到
完全沉淀,需调节pH到___________ 。
(5)为获取更为纯净的 ,应控制反应温度T高于
,应控制反应温度T高于___________ 。
(6)某小组为测定绿矾产品的纯度,取12 g绿矾产品溶于稀硫酸配成100 mL溶液,取25.00 mL用0.1000 mol/L ;溶液滴定,平行滴定三组数据如下:
;溶液滴定,平行滴定三组数据如下:
①达到滴定终点时的实验现象是___________ 。
②绿矾产品的纯度为___________ %(保留小数点后2位)。
 ,含少量铁的氧化物等)采用混合硫酸法制备
,含少量铁的氧化物等)采用混合硫酸法制备 ,该工艺适用于高品钛。具体流程如下:
,该工艺适用于高品钛。具体流程如下:
已知:①六氯钛酸钾是一种无机物,化学式
 ,可溶于热水,微溶于冷水。
,可溶于热水,微溶于冷水。②

③当离子浓度小于10⁻⁵mol/L时视为沉淀完全。
 与氧气反应产物含钛物质含量随温度变化如图所示。
与氧气反应产物含钛物质含量随温度变化如图所示。
请回答:
(1)为提高酸解率,可以采用的措施有
(2)向
 溶液中加入KCl、HCl充分反应后,通过一系列操作可以获得
溶液中加入KCl、HCl充分反应后,通过一系列操作可以获得 晶体,请写出具体操作
晶体,请写出具体操作(3)
 晶体进行加热分解生成
晶体进行加热分解生成 和“残渣”,“残渣”是
和“残渣”,“残渣”是(4)室温下,若
 的
的 为
为 ,若要使得
,若要使得 中的
中的 完全沉淀,需调节pH到
完全沉淀,需调节pH到(5)为获取更为纯净的
 ,应控制反应温度T高于
,应控制反应温度T高于(6)某小组为测定绿矾产品的纯度,取12 g绿矾产品溶于稀硫酸配成100 mL溶液,取25.00 mL用0.1000 mol/L
 ;溶液滴定,平行滴定三组数据如下:
;溶液滴定,平行滴定三组数据如下:| 滴定次数 | 1 | 2 | 3 |
 /mL(初读数) /mL(初读数) | 0.10 | 0.33 | 3.20 |
 /mL(终读数) /mL(终读数) | 20.08 | 20.35 | 20.22 |
②绿矾产品的纯度为
您最近一年使用:0次
名校
9 . 研究一个化学反应时,往往需要关注反应进行的方向、快慢,反应的限度以及反应的能量变化。下面是Na2CO3等常见物质所涉及的性质和反应,请按要求填空:
(1)已知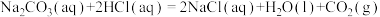
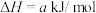
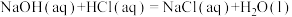
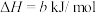
二氧化碳气体通入足量氢氧化钠溶液发生的反应为___________ 反应(填“放热”或“吸热”),其热化学方程式为___________ ( 用含a和b的代数式表示)。
用含a和b的代数式表示)。
(2)Na2CO3和盐酸反应生成CO2的速率非常大,其根本原因是___________ ,为降低反应速率,可采取的措施是___________ 。(任写两点)
(3)向滴有酚酞的Na2CO3溶液中,逐滴滴加盐酸,当溶液恰好为无色时,溶液呈___________ (填“酸性”“碱性”或“中性”),该无色溶液的电荷守恒式可表示为___________ 。(忽略酚酞对溶液中离子的影响)
(4)向Na2CO3溶液中加少量BaSO4固体,发生的离子反应方程式为___________ 。已知: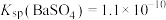 ,
,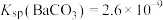 。
。
(1)已知
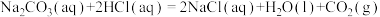
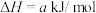
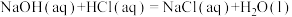
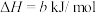
二氧化碳气体通入足量氢氧化钠溶液发生的反应为
 用含a和b的代数式表示)。
用含a和b的代数式表示)。(2)Na2CO3和盐酸反应生成CO2的速率非常大,其根本原因是
(3)向滴有酚酞的Na2CO3溶液中,逐滴滴加盐酸,当溶液恰好为无色时,溶液呈
(4)向Na2CO3溶液中加少量BaSO4固体,发生的离子反应方程式为
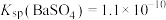 ,
,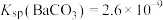 。
。
您最近一年使用:0次
2023-11-09更新
|
128次组卷
|
2卷引用:湖南省长沙市长郡中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
10 . 银作为一种战略金属,在电子、化工、医药等行业广泛使用。某铅锌矿(含有PbCO3、ZnCO3、ZnO等)中含有低品位的辉银矿(Ag2S与自然Ag共生),可以采用NaCN溶液氰化法提取出银,能耗低,生产工艺简便。其炼制工艺简介如图:
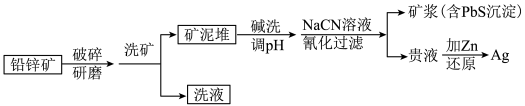
已知:①HCN是一种弱酸,易挥发,有毒性,Ka=6.2×10-10。
②ZnCO3、ZnO易溶解于NaCN溶液中,且NaCN对游离态和化合态的银均能以[Ag(CN)2]-形式浸出。
③调pH过程中,PbCO3已经溶解为Pb(OH) 。
。
(1)NaCN的电子式为_______ 。
(2)铅锌矿破碎研磨的目的是_______ 。
(3)“碱洗”后需调pH,使pH>12,方可进行NaCN溶液喷淋,其目的是_______ 。
(4)“氰化”过程中Ag2S与NaCN溶液反应的化学方程式为_______ ,调pH后不经过“过滤”操作直接加NaCN溶液“氰化”的理由是_______ 。
(5)矿泥堆要有良好的渗透性和孔隙度,其原因是_______ 。
(6)“氰化法”中最终矿浆需要用NaClO溶液消毒处理,发生的离子反应方程式为_______ ,处理100m3含NaCN10.3mg/L的废水,实际至少需NaClO_______ g(实际用量应为理论值的4倍),才能使NaCN含量低于0.5mg/L,达到排放标准。

已知:①HCN是一种弱酸,易挥发,有毒性,Ka=6.2×10-10。
②ZnCO3、ZnO易溶解于NaCN溶液中,且NaCN对游离态和化合态的银均能以[Ag(CN)2]-形式浸出。
③调pH过程中,PbCO3已经溶解为Pb(OH)
 。
。(1)NaCN的电子式为
(2)铅锌矿破碎研磨的目的是
(3)“碱洗”后需调pH,使pH>12,方可进行NaCN溶液喷淋,其目的是
(4)“氰化”过程中Ag2S与NaCN溶液反应的化学方程式为
(5)矿泥堆要有良好的渗透性和孔隙度,其原因是
(6)“氰化法”中最终矿浆需要用NaClO溶液消毒处理,发生的离子反应方程式为
您最近一年使用:0次



