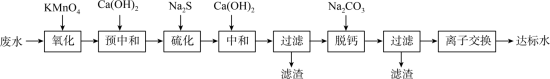
1 . 湿法炼锌工业废水中主要阳离子有 。废水除铊的工艺流程如下。
。废水除铊的工艺流程如下。
已知:① 能够在pH为0~14的范围内以离子态稳定存在,不易与OH-形成沉淀
能够在pH为0~14的范围内以离子态稳定存在,不易与OH-形成沉淀
② 易与废水中的有机物分子形成稳定的配合物,为了简便,通常用
易与废水中的有机物分子形成稳定的配合物,为了简便,通常用 表示
表示
③部分物质的
④排放标准:Tl的含量低于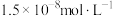
(1)已知“氧化”步骤中 被还原为
被还原为 且
且 氧化不彻底,请写出该反应的离子方程式:
氧化不彻底,请写出该反应的离子方程式:_______ 。
(2)“预中和”步骤,加 至溶液的
至溶液的 约为7,可减少“硫化”步骤中
约为7,可减少“硫化”步骤中 的使用量,还能减少
的使用量,还能减少_______ (填化学式)污染物的生成。
(3)“硫化”步骤的主要目的是除去_______ (填离子符号)。
(4)根据 计算,若使溶液中
计算,若使溶液中 的含量低于排放标准,溶液的
的含量低于排放标准,溶液的 应大于
应大于_______ ,但是实际工艺流程需在“中和”步骤加 至溶液的
至溶液的 约为9,此时仍只有
约为9,此时仍只有 左右的铊离子能得到去除,其可能原因是
左右的铊离子能得到去除,其可能原因是_______ 。
(5)“离子交换”步骤中可用普鲁士蓝{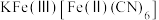 }(其摩尔质量为
}(其摩尔质量为 )中的
)中的 与残余铊离子进行离子交换,进一步实现废水中铊的去除。普鲁士蓝晶胞的
与残余铊离子进行离子交换,进一步实现废水中铊的去除。普鲁士蓝晶胞的 如下[
如下[ 未标出,占据四个互不相邻的小立方体(晶胞的
未标出,占据四个互不相邻的小立方体(晶胞的 部分)的体心]。
部分)的体心]。
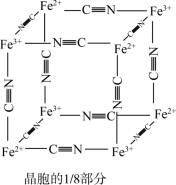
①普鲁士蓝晶胞中,Fe2+的配位数为_______ 。
②若该晶体的密度为 ,则
,则 和
和 的最短距离为
的最短距离为_______  (设
(设 为阿伏伽德罗常数的值)。
为阿伏伽德罗常数的值)。
 。废水除铊的工艺流程如下。
。废水除铊的工艺流程如下。
已知:①
 能够在pH为0~14的范围内以离子态稳定存在,不易与OH-形成沉淀
能够在pH为0~14的范围内以离子态稳定存在,不易与OH-形成沉淀②
 易与废水中的有机物分子形成稳定的配合物,为了简便,通常用
易与废水中的有机物分子形成稳定的配合物,为了简便,通常用 表示
表示③部分物质的

| 物质 |  |  |  |  |
 | 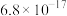 |  |  |  |
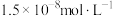
(1)已知“氧化”步骤中
 被还原为
被还原为 且
且 氧化不彻底,请写出该反应的离子方程式:
氧化不彻底,请写出该反应的离子方程式:(2)“预中和”步骤,加
 至溶液的
至溶液的 约为7,可减少“硫化”步骤中
约为7,可减少“硫化”步骤中 的使用量,还能减少
的使用量,还能减少(3)“硫化”步骤的主要目的是除去
(4)根据
 计算,若使溶液中
计算,若使溶液中 的含量低于排放标准,溶液的
的含量低于排放标准,溶液的 应大于
应大于 至溶液的
至溶液的 约为9,此时仍只有
约为9,此时仍只有 左右的铊离子能得到去除,其可能原因是
左右的铊离子能得到去除,其可能原因是(5)“离子交换”步骤中可用普鲁士蓝{
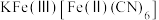 }(其摩尔质量为
}(其摩尔质量为 )中的
)中的 与残余铊离子进行离子交换,进一步实现废水中铊的去除。普鲁士蓝晶胞的
与残余铊离子进行离子交换,进一步实现废水中铊的去除。普鲁士蓝晶胞的 如下[
如下[ 未标出,占据四个互不相邻的小立方体(晶胞的
未标出,占据四个互不相邻的小立方体(晶胞的 部分)的体心]。
部分)的体心]。
①普鲁士蓝晶胞中,Fe2+的配位数为
②若该晶体的密度为
 ,则
,则 和
和 的最短距离为
的最短距离为 (设
(设 为阿伏伽德罗常数的值)。
为阿伏伽德罗常数的值)。
您最近一年使用:0次
2 . 铍的氧化物广泛应用于原子能、航天、电子、陶瓷等领域,是重要的战略物资。利用绿柱石(主要化学成分为(Be3Al2Si6O18,还含有一定量的FeO和Fe2O3)生产BeO的一种工艺流程如下。
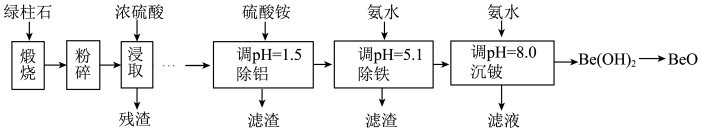
回答问题:
(1)Be3Al2Si6O18中Be的化合价为______ 。Si原子价层电子排布式为_______ 。元素Al与Si中,第一电离能较大的是_______ ,氮原子和氧原子电负性较大的是______ 。
(2)浓硫酸浸取后残渣主要成分是_______ (填化学式)。
(3)该流程中能循环使用的物质是______ (填化学式)。
(4)无水BeCl2可用作聚合反应的催化剂。BeO、Cl2与足量C在600~800℃制备BeCl2的化学方程式为______ 。
(5)沉铍时,将pH从8.0提高到9.0,则铍的损失降低至原来的______ %。

回答问题:
(1)Be3Al2Si6O18中Be的化合价为
(2)浓硫酸浸取后残渣主要成分是
(3)该流程中能循环使用的物质是
(4)无水BeCl2可用作聚合反应的催化剂。BeO、Cl2与足量C在600~800℃制备BeCl2的化学方程式为
(5)沉铍时,将pH从8.0提高到9.0,则铍的损失降低至原来的
您最近一年使用:0次
3 . 钪(Sc)是地壳中含量极少的稀土元素,在照明、合金和催化剂等领域有重要应用。钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),还含有少量SiO2、Sc2O3等氧化物,从钛铁矿中提取Sc2O3的流程如下:
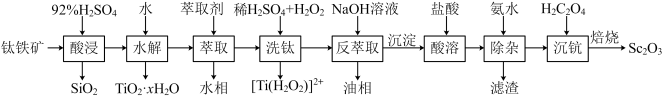
已知:①当离子浓度减小至10-5mol·L-1时可认为沉淀完全
②室温下,溶液中离子沉淀完全的pH如下表所示:
③lg2=0.3,Ksp[Sc(OH)3]=1.25×10-33。回答下列问题:
(1)“酸浸”后Ti元素转化为TiOSO4,其水解反应的化学方程式是___________ 。
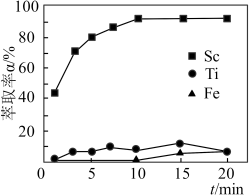
(2)“萃取”时,使用10%P2O4+5%TBP+煤油作为萃取剂,一定条件下萃取率α受振荡时间的影响如图,萃取时选择最佳的振荡时间为___________ min。
(3)若“酸溶”后滤液中Sc3+的浓度为0.01mol·L-1,则“除杂”过程中应控制的pH范围是___________ 。
(4)“沉钪”后得到五水草酸钪,焙烧生成四种氧化物。其反应的化学方程式为___________ 。

已知:①当离子浓度减小至10-5mol·L-1时可认为沉淀完全
②室温下,溶液中离子沉淀完全的pH如下表所示:
| 离子 | Fe3+ | Fe2+ | TiO2+ |
| 沉淀完全的pH | 3.2 | 9.0 | 1.05 |
(1)“酸浸”后Ti元素转化为TiOSO4,其水解反应的化学方程式是
(2)“萃取”时,使用10%P2O4+5%TBP+煤油作为萃取剂,一定条件下萃取率α受振荡时间的影响如图,萃取时选择最佳的振荡时间为

(3)若“酸溶”后滤液中Sc3+的浓度为0.01mol·L-1,则“除杂”过程中应控制的pH范围是
(4)“沉钪”后得到五水草酸钪,焙烧生成四种氧化物。其反应的化学方程式为
您最近一年使用:0次
名校
解题方法
4 . 水钴矿主要成分为CoOOH,同时含有少量Fe、Al、Mn、Mg、Ca、Ni的氧化物及其他杂质。用水钴矿制取Co的工艺流程如图甲所示:
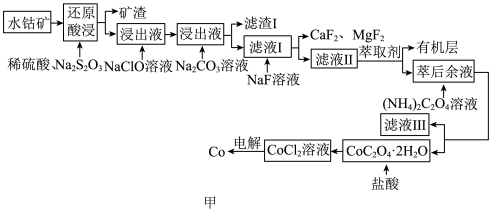
已知部分阳离子形成氢氧化物沉淀时,溶液pH见下表:
请回答下列问题:
(1)基态Co原子的价层电子排布式为___________ 。
(2)“还原酸浸”中发生的氧化还原反应的化学方程式是___________ 。浸出液中加入NaClO溶液的目的:___________ (用离子方程式表示)。
(3)浸出过程中加入Na2CO3调pH的范围是___________ 。
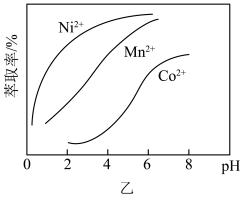
(4)如图乙所示,萃取剂可以把滤液Ⅱ中部分阳离子选择性分离。萃取剂合适的pH为___________(填标号)。
(5)Co能与强酸反应产生H2,工业上采用惰性电极电解CoCl2溶液制取钴,不能用CoSO4溶液代替CoCl2溶液的理由是___________ 。
(6)已知:Ksp(MgF2)=7.5×10-11,Ksp(CaF2)=1.5×10-10,加入NaF后,所得“滤液Ⅱ”中 =
=___________ 。

已知部分阳离子形成氢氧化物沉淀时,溶液pH见下表:
| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Co(OH)2 | Mn(OH)2 | Al(OH)3 |
| 开始沉淀时的pH | 7.0 | 2.7 | 7.6 | 7.7 | 4.0 |
| 沉淀完全时的pH | 9.6 | 3.7 | 9.2 | 9.8 | 5.2 |
(1)基态Co原子的价层电子排布式为
(2)“还原酸浸”中发生的氧化还原反应的化学方程式是
(3)浸出过程中加入Na2CO3调pH的范围是
(4)如图乙所示,萃取剂可以把滤液Ⅱ中部分阳离子选择性分离。萃取剂合适的pH为___________(填标号)。

| A.2~3 | B.3~4 | C.6~7 | D.7~8 |
(5)Co能与强酸反应产生H2,工业上采用惰性电极电解CoCl2溶液制取钴,不能用CoSO4溶液代替CoCl2溶液的理由是
(6)已知:Ksp(MgF2)=7.5×10-11,Ksp(CaF2)=1.5×10-10,加入NaF后,所得“滤液Ⅱ”中
 =
=
您最近一年使用:0次
名校
解题方法
5 . 某油脂厂废弃的油脂加氢镍催化剂主要含金属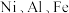 及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体
及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体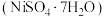 ;
;
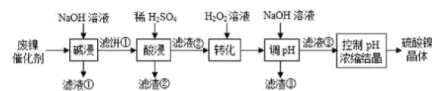
溶液中金属离子开始沉淀和完全沉淀的 如下表所示:
如下表所示:
回答下列问题:
(1)基态 原子的价电子中,两种自旋状态的电子数之比为
原子的价电子中,两种自旋状态的电子数之比为___________ ,基态 原子价层电子排布式
原子价层电子排布式___________ 。
(2)“碱浸”中 有两个作用:除去
有两个作用:除去___________ 和溶解铝及其氧化物,写出 溶液溶解
溶液溶解 的离子方程式
的离子方程式___________ 。
(3)“转化”中可替代 的物质是
的物质是___________ 。若工艺流程改为先“调 ”后“转化”,即
”后“转化”,即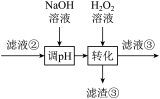 “滤液③”中可能含有的杂质离子为
“滤液③”中可能含有的杂质离子为___________ 。
(4)如果“转化”后的溶液中 浓度为
浓度为 ,则“调
,则“调 ”应控制的
”应控制的 范围是
范围是___________ 。
(5)硫酸镍在强碱溶液中用 氧化,可沉淀出能用作镍镉电池正极材料的
氧化,可沉淀出能用作镍镉电池正极材料的 。写出该反应的离子方程式
。写出该反应的离子方程式___________ 。
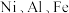 及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体
及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体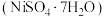 ;
;
溶液中金属离子开始沉淀和完全沉淀的
 如下表所示:
如下表所示:| 金属离子 |  |  |  |  |
开始沉淀时 的 的 | 7.2 | 3.7 | 2.2 | 7.5 |
沉淀完全时 的 的 | 8.7 | 4.7 | 3.2 | 9.0 |
(1)基态
 原子的价电子中,两种自旋状态的电子数之比为
原子的价电子中,两种自旋状态的电子数之比为 原子价层电子排布式
原子价层电子排布式(2)“碱浸”中
 有两个作用:除去
有两个作用:除去 溶液溶解
溶液溶解 的离子方程式
的离子方程式(3)“转化”中可替代
 的物质是
的物质是 ”后“转化”,即
”后“转化”,即 “滤液③”中可能含有的杂质离子为
“滤液③”中可能含有的杂质离子为(4)如果“转化”后的溶液中
 浓度为
浓度为 ,则“调
,则“调 ”应控制的
”应控制的 范围是
范围是(5)硫酸镍在强碱溶液中用
 氧化,可沉淀出能用作镍镉电池正极材料的
氧化,可沉淀出能用作镍镉电池正极材料的 。写出该反应的离子方程式
。写出该反应的离子方程式
您最近一年使用:0次
6 . 从某废液(含有Fe3+、Fe2+、Cu2+、Cl-)中回收铜并制得纯净的FeCl3溶液。现以制得的纯净的FeCl3溶液为原料制取优良的水处理剂高铁酸钾(K2FeO4),其流程如图:
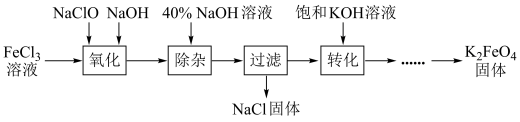
已知:高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定;具有强氧化性;与水作用产生Fe(OH)3。
(1)高铁酸钾(K2FeO4)在处理水过程中的作用是_________ 和_________ 。
(2)检验废液中含有Fe2+选用的试剂是__________ (填化学式)。
(3)“氧化”过程反应的离子方程式为__________ 。
(4)上述工艺得到的高铁酸钾常含有杂质,可用重结晶法提纯,操作是将粗产品用______ 溶解,然后______ ,过滤。
(5)用回收的铜为原料可制得粗CuSO4·5H2O晶体(含有少量的FeSO4·7H2O),除去CuSO4·5H2O晶体中杂质的方法是将该晶体溶于水,向溶液中加入H2O2,再调节溶液pH。过滤即可制得纯净的CuSO4溶液,进而可制得纯净的CuSO4·5H2O晶体。
已知:室温时一些物质的Ksp如表所示:
已知溶液中的某离子浓度小于1×10-5 mol/L时就认为该离子沉淀完全。加双氧水的目的是_________ ;若溶液中CuSO4的浓度为3.0mol/L,通过计算说明此方法可除去粗CuSO4·5H2O晶体中FeSO4·7H2O的理由:___________ 。

已知:高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定;具有强氧化性;与水作用产生Fe(OH)3。
(1)高铁酸钾(K2FeO4)在处理水过程中的作用是
(2)检验废液中含有Fe2+选用的试剂是
(3)“氧化”过程反应的离子方程式为
(4)上述工艺得到的高铁酸钾常含有杂质,可用重结晶法提纯,操作是将粗产品用
(5)用回收的铜为原料可制得粗CuSO4·5H2O晶体(含有少量的FeSO4·7H2O),除去CuSO4·5H2O晶体中杂质的方法是将该晶体溶于水,向溶液中加入H2O2,再调节溶液pH。过滤即可制得纯净的CuSO4溶液,进而可制得纯净的CuSO4·5H2O晶体。
已知:室温时一些物质的Ksp如表所示:
| 化学式 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 |
| Ksp | 8.0×10-16 | 8.0×10-38 | 3×10-20 |
您最近一年使用:0次
名校
解题方法
7 . 随着新能源汽车销量的猛增,动力电池退役高峰将至,磷酸铁锂(LFP)是目前使用最多的动力电池材料,因此回收磷酸铁锂具有重要意义。一种从废旧磷酸铁锂正极片( 、导电石墨、铝箔)中回收锂的工艺流程如下:
、导电石墨、铝箔)中回收锂的工艺流程如下:
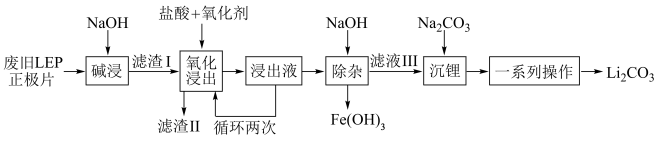
已知: 在水中的溶解度随温度升高而降低。
在水中的溶解度随温度升高而降低。
回答下列问题:
(1)旧电池拆解前进行放电处理有利于锂在正极的回收,其原因是___________ 。
(2)“碱浸”时,为加快浸出速率,可采取的措施是___________ (答出一点即可)。
(3)“氧化浸出”时,实际生产中氧化剂选用 ,不选用
,不选用 的原因是
的原因是___________ 。“氧化浸出”时生成了难溶的 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
(4)“沉锂”过程中使用水浴加热保持温度在95℃,“一系列操作”具体包括___________ 、___________ 、干燥。
(5)滤液Ⅲ中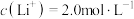 ,“沉锂”结束时溶液中
,“沉锂”结束时溶液中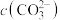 为
为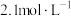 ,则“沉锂”过程中,锂的沉降率为
,则“沉锂”过程中,锂的沉降率为___________ %[已知:浸出液在沉锂过程中溶液体积不变,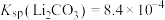 ]。
]。
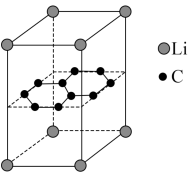
(6)某锂电池的负极材料晶体是锂原子嵌入石墨烯层间形成的,晶胞结构(底面为平行四边形)如图所示。该晶体的化学式为___________ ,该晶体中最近的两个碳原子核间距离为apm,石墨烯层间距离为bpm,则该晶体的密度为___________  (列出计算式,用
(列出计算式,用 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。
 、导电石墨、铝箔)中回收锂的工艺流程如下:
、导电石墨、铝箔)中回收锂的工艺流程如下:
已知:
 在水中的溶解度随温度升高而降低。
在水中的溶解度随温度升高而降低。回答下列问题:
(1)旧电池拆解前进行放电处理有利于锂在正极的回收,其原因是
(2)“碱浸”时,为加快浸出速率,可采取的措施是
(3)“氧化浸出”时,实际生产中氧化剂选用
 ,不选用
,不选用 的原因是
的原因是 ,该反应的离子方程式为
,该反应的离子方程式为(4)“沉锂”过程中使用水浴加热保持温度在95℃,“一系列操作”具体包括
(5)滤液Ⅲ中
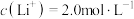 ,“沉锂”结束时溶液中
,“沉锂”结束时溶液中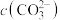 为
为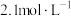 ,则“沉锂”过程中,锂的沉降率为
,则“沉锂”过程中,锂的沉降率为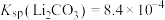 ]。
]。(6)某锂电池的负极材料晶体是锂原子嵌入石墨烯层间形成的,晶胞结构(底面为平行四边形)如图所示。该晶体的化学式为
 (列出计算式,用
(列出计算式,用 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。
您最近一年使用:0次
8 . 钒具有广泛用途。黏土钒矿中,钒以 、
、 、
、 价的化合物存在,还包括钾、镁的铝硅酸盐,以及
价的化合物存在,还包括钾、镁的铝硅酸盐,以及 、
、 。采用以下工艺流程可由黏土钒矿制备
。采用以下工艺流程可由黏土钒矿制备 。
。
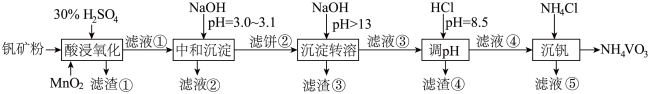
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)“酸浸氧化”中, 和
和 被氧化成
被氧化成 ,同时还有
,同时还有_______ 离子被氧化。写出 转化为
转化为 反应的离子方程式
反应的离子方程式_______ 。
(2)“中和沉淀”中,钒水解并沉淀为 ,随滤液②可除去金属离子
,随滤液②可除去金属离子 、
、 、
、 、
、_______ ,以及部分的_______ 。
(3)“沉淀转溶”中, 转化为钒酸盐溶解。滤渣③的主要成分是
转化为钒酸盐溶解。滤渣③的主要成分是_______ 。
(4)利用上述表格数据,计算 的
的
_______ ( 完全沉淀后其浓度应小于
完全沉淀后其浓度应小于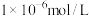 )。
)。
(5)“沉钒”中析出 晶体时,需要加入过量
晶体时,需要加入过量 ,其原因是
,其原因是_______ 。
 、
、 、
、 价的化合物存在,还包括钾、镁的铝硅酸盐,以及
价的化合物存在,还包括钾、镁的铝硅酸盐,以及 、
、 。采用以下工艺流程可由黏土钒矿制备
。采用以下工艺流程可由黏土钒矿制备 。
。
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 |  |  |  |  |
| 开始沉淀pH | 1.9 | 7.0 | 3.0 | 8.1 |
| 完全沉淀pH | 3.0 | 9.0 | 4.7 | 10.1 |
(1)“酸浸氧化”中,
 和
和 被氧化成
被氧化成 ,同时还有
,同时还有 转化为
转化为 反应的离子方程式
反应的离子方程式(2)“中和沉淀”中,钒水解并沉淀为
 ,随滤液②可除去金属离子
,随滤液②可除去金属离子 、
、 、
、 、
、(3)“沉淀转溶”中,
 转化为钒酸盐溶解。滤渣③的主要成分是
转化为钒酸盐溶解。滤渣③的主要成分是(4)利用上述表格数据,计算
 的
的
 完全沉淀后其浓度应小于
完全沉淀后其浓度应小于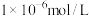 )。
)。(5)“沉钒”中析出
 晶体时,需要加入过量
晶体时,需要加入过量 ,其原因是
,其原因是
您最近一年使用:0次
名校
解题方法
9 . 《开宝本草》记载“取钢煅作叶,如笏或团,平面磨错令光净,以盐水洒之,于醋瓮中,阴处埋之百日,铁上衣生,铁华成矣”。铁华粉[主要成分为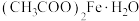 ],主要功效是养血安神,平肝镇惊,解毒消肿。某小组以硫铁矿(主要成分为
],主要功效是养血安神,平肝镇惊,解毒消肿。某小组以硫铁矿(主要成分为 ,含少量
,含少量 等)为原料制备铁华粉的流程如下:
等)为原料制备铁华粉的流程如下:
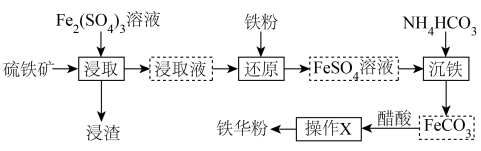
已知:浸渣含有附加值高的非金属单质,浸取液含 和
和 。
。
回答下列问题:
(1)为了提高“浸取”速率,宜采用的措施有___________ (答两条)。
(2)“浸取”中 反应的离子方程式为
反应的离子方程式为___________ 。
(3)若将“还原”中发生的化合反应设计成原电池,则正极反应式为___________ 。
(4)操作X包括蒸发浓缩、___________ 、过滤、洗涤、干燥。“蒸发浓缩”宜在 或
或 保护气氛中进行,其目的是
保护气氛中进行,其目的是___________ 。
(5)已知:常温下, ,
, 的电离常数
的电离常数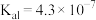 ,
, 。“沉铁”中
。“沉铁”中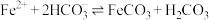 的平衡常数
的平衡常数 为
为________ (结果保留两位有效数字)。
(6)常温下,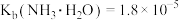 。
。 溶液呈弱碱性,其原因是
溶液呈弱碱性,其原因是________ 。
(7)设计实验证明铁华粉中含 ,宜选择的试剂是___________(填标号)。
,宜选择的试剂是___________(填标号)。
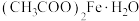 ],主要功效是养血安神,平肝镇惊,解毒消肿。某小组以硫铁矿(主要成分为
],主要功效是养血安神,平肝镇惊,解毒消肿。某小组以硫铁矿(主要成分为 ,含少量
,含少量 等)为原料制备铁华粉的流程如下:
等)为原料制备铁华粉的流程如下:
已知:浸渣含有附加值高的非金属单质,浸取液含
 和
和 。
。回答下列问题:
(1)为了提高“浸取”速率,宜采用的措施有
(2)“浸取”中
 反应的离子方程式为
反应的离子方程式为(3)若将“还原”中发生的化合反应设计成原电池,则正极反应式为
(4)操作X包括蒸发浓缩、
 或
或 保护气氛中进行,其目的是
保护气氛中进行,其目的是(5)已知:常温下,
 ,
, 的电离常数
的电离常数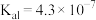 ,
, 。“沉铁”中
。“沉铁”中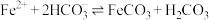 的平衡常数
的平衡常数 为
为(6)常温下,
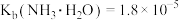 。
。 溶液呈弱碱性,其原因是
溶液呈弱碱性,其原因是(7)设计实验证明铁华粉中含
 ,宜选择的试剂是___________(填标号)。
,宜选择的试剂是___________(填标号)。A. 溶液 溶液 | B.酸性 溶液 溶液 |
C. 溶液 溶液 | D. 溶液 溶液 |
您最近一年使用:0次
名校
解题方法
10 . 稀土(RE)包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(可能含FeO、Fe2O3、Al2O3等物质)中提取稀土的工艺如下:
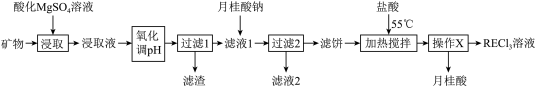
已知:月桂酸(C11H23COOH)熔点为44℃;月桂酸和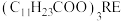 均难溶于水。该工艺条件下,稀土离子保持+3价不变;
均难溶于水。该工艺条件下,稀土离子保持+3价不变;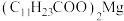 的
的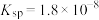 ,
, 开始溶解时的pH为8.8;有关金属离子沉淀的相关pH见下表。
开始溶解时的pH为8.8;有关金属离子沉淀的相关pH见下表。
(1)“氧化调pH”中,化合价有变化的金属离子是_______ 。
(2)“过滤1”前,用NaOH溶液调pH至_______ 的范围内,该过程中Al3+发生反应的离子方程式为_______ 。
(3)“过滤2”后,滤饼中检测不到Mg元素,滤液2中Mg2+浓度为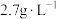 。为尽可能多地提取RE3+,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中
。为尽可能多地提取RE3+,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中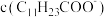 低于
低于_______  。
。
(4)“加热搅拌”有利于加快RE3+溶出、提高产率,其原因是_______ 。
(5)操作X的过程为:先_______ 、再固液分离。
(6)稀土元素钇(Y)可用于制备高活性的合金类催化剂Pt3Y。
①用电解YCl3和PtCl4熔融盐的方法可以制备Pt3Y,则生成1molPt3Y合金转移_______ mol电子。
② 用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化O2的还原,发生的电极反应为
用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化O2的还原,发生的电极反应为_______ 。

已知:月桂酸(C11H23COOH)熔点为44℃;月桂酸和
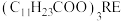 均难溶于水。该工艺条件下,稀土离子保持+3价不变;
均难溶于水。该工艺条件下,稀土离子保持+3价不变;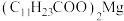 的
的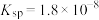 ,
, 开始溶解时的pH为8.8;有关金属离子沉淀的相关pH见下表。
开始溶解时的pH为8.8;有关金属离子沉淀的相关pH见下表。| 离子 | Mg2+ | Fe3+ | Fe2+ | Al3+ | RE3+ |
| 开始沉淀时的pH | 8.8 | 1.4 | 6.9 | 3.6 | 6.2~7.4 |
| 沉淀完全时的pH | / | 3.2 | 8.9 | 4.7 | / |
(1)“氧化调pH”中,化合价有变化的金属离子是
(2)“过滤1”前,用NaOH溶液调pH至
(3)“过滤2”后,滤饼中检测不到Mg元素,滤液2中Mg2+浓度为
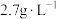 。为尽可能多地提取RE3+,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中
。为尽可能多地提取RE3+,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中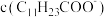 低于
低于 。
。(4)“加热搅拌”有利于加快RE3+溶出、提高产率,其原因是
(5)操作X的过程为:先
(6)稀土元素钇(Y)可用于制备高活性的合金类催化剂Pt3Y。
①用电解YCl3和PtCl4熔融盐的方法可以制备Pt3Y,则生成1molPt3Y合金转移
②
 用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化O2的还原,发生的电极反应为
用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化O2的还原,发生的电极反应为
您最近一年使用:0次



