1 . 回答下列问题:
(1)某温度下,向含有AgCl固体的AgCl饱和溶液中加入少量稀盐酸,则AgCl的溶解度______ (填增大,减小或不变,下同),Ksp______ ,c(Ag+)______ 。
(2)现有25℃0.1mol/L的氨水。请回答以下问题:
①若向氨水中加入氯化铵固体,此时溶液中NH3•H2O电离程度_______ (填“增大”、“减小”或“不变”);此时溶液中水的离子积约等于_______ 。
②若向氨水中加入稀硫酸,使其恰好中和,写出离子方程式:______ 所得溶液的pH______ 7(填“>”“=”或“<”),用离子方程式表示其原因:______ 。
(1)某温度下,向含有AgCl固体的AgCl饱和溶液中加入少量稀盐酸,则AgCl的溶解度
(2)现有25℃0.1mol/L的氨水。请回答以下问题:
①若向氨水中加入氯化铵固体,此时溶液中NH3•H2O电离程度
②若向氨水中加入稀硫酸,使其恰好中和,写出离子方程式:
您最近一年使用:0次
解题方法
2 . 回答下列问题
(1)已知 (次磷酸)的水溶液中存在
(次磷酸)的水溶液中存在 分子。
分子。 与足量
与足量 溶液充分反应,消耗的酸和碱的物质的量相等,则生成盐的化学式为
溶液充分反应,消耗的酸和碱的物质的量相等,则生成盐的化学式为___________ 。
(2)常温下,用 溶液吸收
溶液吸收 得到
得到 的
的 溶液,吸收过程中水的电离平衡
溶液,吸收过程中水的电离平衡___________ (填“向左”、“向右”或“不”)移动。试计算该溶液中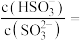
___________ (常温下 的电离平衡常数
的电离平衡常数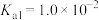 ,
, )。
)。
(3)保险粉样品中 的纯度(质量分数)可通过氧化还原滴定法来测定,反应的离子方程式为
的纯度(质量分数)可通过氧化还原滴定法来测定,反应的离子方程式为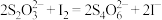 。准确称取
。准确称取 样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂。用
样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂。用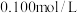 碘的标准溶液进行滴定,判断达到滴定终点的操作和现象是
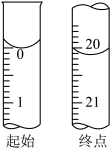
碘的标准溶液进行滴定,判断达到滴定终点的操作和现象是___________ 。滴定起始和终点的液面位置如图所示。则样品的纯度为___________ 。(设 的摩尔质量为
的摩尔质量为 )
)
(4)化工生产中常用 作沉淀剂除去工业废水中的
作沉淀剂除去工业废水中的 ,其反应原理为
,其反应原理为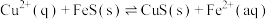 。下列有关叙述正确的是
。下列有关叙述正确的是___________ 。
a、
b、达到平衡时
c、该反应平衡常数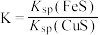
(1)已知
 (次磷酸)的水溶液中存在
(次磷酸)的水溶液中存在 分子。
分子。 与足量
与足量 溶液充分反应,消耗的酸和碱的物质的量相等,则生成盐的化学式为
溶液充分反应,消耗的酸和碱的物质的量相等,则生成盐的化学式为(2)常温下,用
 溶液吸收
溶液吸收 得到
得到 的
的 溶液,吸收过程中水的电离平衡
溶液,吸收过程中水的电离平衡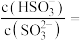
 的电离平衡常数
的电离平衡常数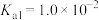 ,
, )。
)。(3)保险粉样品中
 的纯度(质量分数)可通过氧化还原滴定法来测定,反应的离子方程式为
的纯度(质量分数)可通过氧化还原滴定法来测定,反应的离子方程式为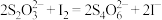 。准确称取
。准确称取 样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂。用
样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂。用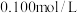 碘的标准溶液进行滴定,判断达到滴定终点的操作和现象是
碘的标准溶液进行滴定,判断达到滴定终点的操作和现象是 的摩尔质量为
的摩尔质量为 )
)
(4)化工生产中常用
 作沉淀剂除去工业废水中的
作沉淀剂除去工业废水中的 ,其反应原理为
,其反应原理为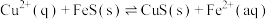 。下列有关叙述正确的是
。下列有关叙述正确的是a、

b、达到平衡时

c、该反应平衡常数
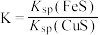
您最近一年使用:0次
解题方法
3 . 水溶液广泛存在于生命体及其赖以生存的环境中。弱电解质的电离平衡、盐类的水解平衡和难溶电解质的沉淀溶解平衡都与日常生活、工农业生产等息息相关。回答下列问题:
(1)25℃时,将 的醋酸溶液与
的醋酸溶液与 的氢氧化钠溶液等体积混合,反应后溶液中
的氢氧化钠溶液等体积混合,反应后溶液中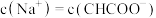 ,则a
,则a___________ 0.01(填“>”、“<”或“=”)。
(2)25℃时,某 溶液的
溶液的 。关于此溶液中的微粒浓度,下列说法正确的是
。关于此溶液中的微粒浓度,下列说法正确的是_______ 。
A.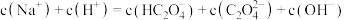
B.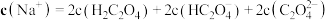
C.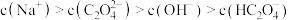
(3)人体内草酸累积过多容易导致结石,其主要成分是草酸钙 ,草酸钻在水中的沉淀溶解平衡可用离子方程式表示为
,草酸钻在水中的沉淀溶解平衡可用离子方程式表示为___________ 。
(4)25℃时,已知 的
的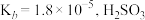 的
的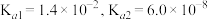 ,则
,则 被氨水捕获所得的
被氨水捕获所得的 溶液呈
溶液呈___________ (填“酸”、“碱”或“中”)性; 也可以被
也可以被 溶液捕获,所得溶液中
溶液捕获,所得溶液中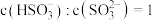 时,该溶液的
时,该溶液的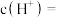
___________ 。
(5) 是水垢成分之一,室温下
是水垢成分之一,室温下 的
的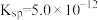 ,向
,向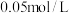 的
的 溶液中通入
溶液中通入 至刚好出现沉淀时,溶液的
至刚好出现沉淀时,溶液的 为
为___________ 。
(6)向 溶液中加入少量水,溶液中
溶液中加入少量水,溶液中
___________ (填“增大”、“减小”或“不变”)。
(1)25℃时,将
 的醋酸溶液与
的醋酸溶液与 的氢氧化钠溶液等体积混合,反应后溶液中
的氢氧化钠溶液等体积混合,反应后溶液中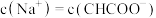 ,则a
,则a(2)25℃时,某
 溶液的
溶液的 。关于此溶液中的微粒浓度,下列说法正确的是
。关于此溶液中的微粒浓度,下列说法正确的是A.
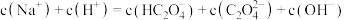
B.
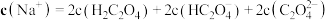
C.
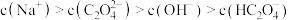
(3)人体内草酸累积过多容易导致结石,其主要成分是草酸钙
 ,草酸钻在水中的沉淀溶解平衡可用离子方程式表示为
,草酸钻在水中的沉淀溶解平衡可用离子方程式表示为(4)25℃时,已知
 的
的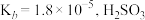 的
的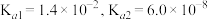 ,则
,则 被氨水捕获所得的
被氨水捕获所得的 溶液呈
溶液呈 也可以被
也可以被 溶液捕获,所得溶液中
溶液捕获,所得溶液中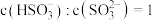 时,该溶液的
时,该溶液的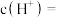
(5)
 是水垢成分之一,室温下
是水垢成分之一,室温下 的
的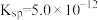 ,向
,向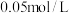 的
的 溶液中通入
溶液中通入 至刚好出现沉淀时,溶液的
至刚好出现沉淀时,溶液的 为
为(6)向
 溶液中加入少量水,溶液中
溶液中加入少量水,溶液中
您最近一年使用:0次
4 . 工业燃煤、石油等化石燃料烧释放出大量 等气体,严重污染空气。对废气进行处理可实现绿色环保、废物利用。目前,在常温下处理
等气体,严重污染空气。对废气进行处理可实现绿色环保、废物利用。目前,在常温下处理 主要采用碱液吸收法。
主要采用碱液吸收法。
(1)用过量的烧碱溶液吸收 ,发生反应
,发生反应 ,若向所得的
,若向所得的 溶液滴入过氧化氢溶液,发生反应的离子方程式为
溶液滴入过氧化氢溶液,发生反应的离子方程式为_______ 。
(2)研究发现, 溶液也可以用来处理废气中的
溶液也可以用来处理废气中的 ,发生反应
,发生反应 ,查阅资料可知,常温下,
,查阅资料可知,常温下, 电离平衡常数:
电离平衡常数: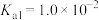 ,
, 。
。
①写出 发生水解反应的离子方程式:
发生水解反应的离子方程式:_______ ;常温下,该反应的
_______ 。
② 溶液中
溶液中
_______ (填“>”、“<”或“=”) 。
。
(3)常温下,若向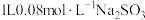 溶液中缓慢通入
溶液中缓慢通入 ,整个过程无气体逸出,忽略溶液体积的变化,测得溶液的pH与通入
,整个过程无气体逸出,忽略溶液体积的变化,测得溶液的pH与通入 物质的量之间的变化曲线如图所示:
物质的量之间的变化曲线如图所示:
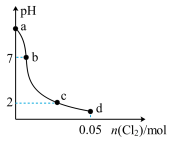
①a点
_______ (精确到小数点后一位)。
②下列说法错误的是_______ (填标号)。
A.c点溶液中存在
B.b点
C.d点溶液中溶质只有 、
、 和
和
D.a点溶液中存在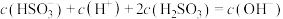
(4)还可以采用多步法来处理废气中的 :
:
第1步:用过理的浓氨水吸收 ,并在空气中氧化;
,并在空气中氧化;
第2步:加入石灰水,发生反应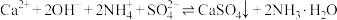 K。
K。
则
_______ [已知: ,
,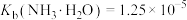 ]。
]。
 等气体,严重污染空气。对废气进行处理可实现绿色环保、废物利用。目前,在常温下处理
等气体,严重污染空气。对废气进行处理可实现绿色环保、废物利用。目前,在常温下处理 主要采用碱液吸收法。
主要采用碱液吸收法。(1)用过量的烧碱溶液吸收
 ,发生反应
,发生反应 ,若向所得的
,若向所得的 溶液滴入过氧化氢溶液,发生反应的离子方程式为
溶液滴入过氧化氢溶液,发生反应的离子方程式为(2)研究发现,
 溶液也可以用来处理废气中的
溶液也可以用来处理废气中的 ,发生反应
,发生反应 ,查阅资料可知,常温下,
,查阅资料可知,常温下, 电离平衡常数:
电离平衡常数: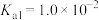 ,
, 。
。①写出
 发生水解反应的离子方程式:
发生水解反应的离子方程式:
②
 溶液中
溶液中
 。
。(3)常温下,若向
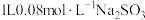 溶液中缓慢通入
溶液中缓慢通入 ,整个过程无气体逸出,忽略溶液体积的变化,测得溶液的pH与通入
,整个过程无气体逸出,忽略溶液体积的变化,测得溶液的pH与通入 物质的量之间的变化曲线如图所示:
物质的量之间的变化曲线如图所示:
①a点

②下列说法错误的是
A.c点溶液中存在

B.b点

C.d点溶液中溶质只有
 、
、 和
和
D.a点溶液中存在
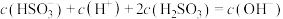
(4)还可以采用多步法来处理废气中的
 :
:第1步:用过理的浓氨水吸收
 ,并在空气中氧化;
,并在空气中氧化;第2步:加入石灰水,发生反应
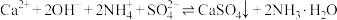 K。
K。则

 ,
,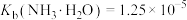 ]。
]。
您最近一年使用:0次
名校
5 . 运用化学反应原理,研究硫、磷化合物的反应具有重要意义。
(1)已知H3PO2(次磷酸)的水溶液中存在H3PO2分子。H3PO2与足量NaOH溶液充分反应,消耗的酸和碱的物质的量相等,则生成盐的化学式为_____ ,该盐属于_____ (填“正盐”或“酸式盐”)。H3PO2易被氧化为H3PO4,已知常温下,H3PO4的电离常数为Ka1=6.9×10-3,Ka2=6.2×10-8,Ka3=4.8×10-13,请利用以上数据计算推测Na2HPO4溶液呈_____ 性。
(2)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离平衡_____ (填“向左”“向右”或“不”)移动。试计算该溶液中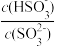 =
=_____ (常温下,H2SO3的电离平衡常数Ka1=1.0×10-2,Ka2=6.0×10-8)。
(3)化工生产中常用FeS作沉淀剂除去工业废水中的Cu2+,其反应原理为Cu2+(aq)+FeS(s) CuS(s)+Fe2+(aq)。下列有关叙述正确的是
CuS(s)+Fe2+(aq)。下列有关叙述正确的是_____ 。
a.Ksp(FeS)<Ksp(CuS)
b.达到平衡时c(Fe2+)=c(Cu2+)
c.溶液中加入少量Na2S固体后,溶液中c(Fe2+)、c(Cu2+)都减小
d.该反应平衡常数K= 。
。
(1)已知H3PO2(次磷酸)的水溶液中存在H3PO2分子。H3PO2与足量NaOH溶液充分反应,消耗的酸和碱的物质的量相等,则生成盐的化学式为
(2)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离平衡
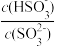 =
=(3)化工生产中常用FeS作沉淀剂除去工业废水中的Cu2+,其反应原理为Cu2+(aq)+FeS(s)
 CuS(s)+Fe2+(aq)。下列有关叙述正确的是
CuS(s)+Fe2+(aq)。下列有关叙述正确的是a.Ksp(FeS)<Ksp(CuS)
b.达到平衡时c(Fe2+)=c(Cu2+)
c.溶液中加入少量Na2S固体后,溶液中c(Fe2+)、c(Cu2+)都减小
d.该反应平衡常数K=
 。
。
您最近一年使用:0次
2024-01-21更新
|
104次组卷
|
2卷引用:湖南省邵阳市新邵县2023-2024学年高二上学期期末考试化学试题
名校
6 . 回答下列问题
(1)常温下,0.05mol/L硫酸溶液中,pH值为_____ ,水电离的
_____ mol/L。
(2)氨水和稀盐酸反应后的溶液呈中性,所得溶液中的离子浓度大小关系是_____ 。
(3)某温度(t℃)时,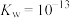 ,将此温度下pH=11的NaOH溶液aL与pH=l的
,将此温度下pH=11的NaOH溶液aL与pH=l的 溶液bL混合,若所得混合溶液为中性,则
溶液bL混合,若所得混合溶液为中性,则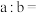
_____ ;
(4)已知 的
的 。则
。则
①某 溶液里
溶液里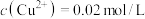 ,如要生成
,如要生成 沉淀,应调整溶液的pH大于
沉淀,应调整溶液的pH大于_____ 。
②要使0.2
 溶液中
溶液中 沉淀完全,则应向溶液里加入NaOH溶液,使溶液的pH为
沉淀完全,则应向溶液里加入NaOH溶液,使溶液的pH为_____ 。
(5)按要求写出下列基态粒子的表示式
Ti的简化电子排布式_____ ,第24号元素的价层电子的轨道表示式_____ 。
(1)常温下,0.05mol/L硫酸溶液中,pH值为

(2)氨水和稀盐酸反应后的溶液呈中性,所得溶液中的离子浓度大小关系是
(3)某温度(t℃)时,
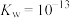 ,将此温度下pH=11的NaOH溶液aL与pH=l的
,将此温度下pH=11的NaOH溶液aL与pH=l的 溶液bL混合,若所得混合溶液为中性,则
溶液bL混合,若所得混合溶液为中性,则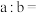
(4)已知
 的
的 。则
。则①某
 溶液里
溶液里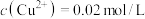 ,如要生成
,如要生成 沉淀,应调整溶液的pH大于
沉淀,应调整溶液的pH大于②要使0.2

 溶液中
溶液中 沉淀完全,则应向溶液里加入NaOH溶液,使溶液的pH为
沉淀完全,则应向溶液里加入NaOH溶液,使溶液的pH为(5)按要求写出下列基态粒子的表示式
Ti的简化电子排布式
您最近一年使用:0次
2023-12-05更新
|
97次组卷
|
2卷引用:湖南省张家界市民族中学2023-2024学年高二上学期第二次月考化学试题
名校
7 . 根据要求回答下列问题。
(1)常温下, 的CH3COONa溶液中水电离出来的
的CH3COONa溶液中水电离出来的
___________  。
。
(2)pH相同的①NaCN,②NaClO,③Na2S三种溶液,其物质的量浓度由大到小的顺序为___________ (填序号)。已知:弱酸的电离平衡常数HCN: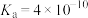 ;H2S:
;H2S: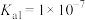 ,
,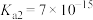 ;HClO;
;HClO;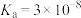 。
。
(3)能够利用氯化铵溶液的酸性作金属除锈剂,试用离子方程式表示氯化铵溶液呈酸性的原因:___________ 。
(4)将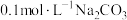 溶液与
溶液与 盐酸等体积混合,所得溶液中
盐酸等体积混合,所得溶液中
___________  (填“<”“=”或“>”)。
(填“<”“=”或“>”)。
(5)常温下,将某一元酸HA(甲、乙代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
①从甲组实验结果分析,该混合溶液中离子浓度由大到小的顺序是___________ 。
②分析乙组实验数据,写出该混合溶液中下列算式的精确结果(列式即可):
___________  。
。
(6)分析化学中,以AgNO3标准溶液滴定溶液中的 时,采用K2CrO4作指示剂,利用Ag+与
时,采用K2CrO4作指示剂,利用Ag+与 反应生成砖红色沉淀指示滴定终点。当溶液中的
反应生成砖红色沉淀指示滴定终点。当溶液中的 恰好沉淀完全(浓度等于
恰好沉淀完全(浓度等于 )时,溶液中
)时,溶液中
___________  。(结果保留两位有效数字,已知常温时Ag2CrO4、AgCl的
。(结果保留两位有效数字,已知常温时Ag2CrO4、AgCl的 分别为
分别为 和
和 )
)
(1)常温下,
 的CH3COONa溶液中水电离出来的
的CH3COONa溶液中水电离出来的
 。
。(2)pH相同的①NaCN,②NaClO,③Na2S三种溶液,其物质的量浓度由大到小的顺序为
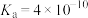 ;H2S:
;H2S: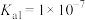 ,
,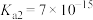 ;HClO;
;HClO;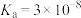 。
。(3)能够利用氯化铵溶液的酸性作金属除锈剂,试用离子方程式表示氯化铵溶液呈酸性的原因:
(4)将
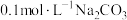 溶液与
溶液与 盐酸等体积混合,所得溶液中
盐酸等体积混合,所得溶液中
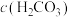 (填“<”“=”或“>”)。
(填“<”“=”或“>”)。(5)常温下,将某一元酸HA(甲、乙代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
| 实验编号 | 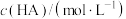 | 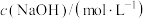 | 混合溶液的pH |
| 甲 | 0.2 | 0.1 | >7 |
| 乙 | 0.1 | 0.1 | =10 |
②分析乙组实验数据,写出该混合溶液中下列算式的精确结果(列式即可):

 。
。(6)分析化学中,以AgNO3标准溶液滴定溶液中的
 时,采用K2CrO4作指示剂,利用Ag+与
时,采用K2CrO4作指示剂,利用Ag+与 反应生成砖红色沉淀指示滴定终点。当溶液中的
反应生成砖红色沉淀指示滴定终点。当溶液中的 恰好沉淀完全(浓度等于
恰好沉淀完全(浓度等于 )时,溶液中
)时,溶液中
 。(结果保留两位有效数字,已知常温时Ag2CrO4、AgCl的
。(结果保留两位有效数字,已知常温时Ag2CrO4、AgCl的 分别为
分别为 和
和 )
)
您最近一年使用:0次
名校
解题方法
8 . 完成下列问题
(1)已知某温度下有如下三个反应:
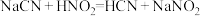


①则该温度下HF、HCN和 三种弱酸的电离常数由大到小的顺序是
三种弱酸的电离常数由大到小的顺序是___________
②已知:乙二酸( ,可简写为
,可简写为 ),俗称草酸;25℃
),俗称草酸;25℃
 ,
,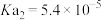 ,25℃
,25℃ ,请写出少量草酸(
,请写出少量草酸( )与NaF溶液反应的化学方程式:
)与NaF溶液反应的化学方程式:___________ 。
(2)常温下,向某浓度的草酸溶液中逐滴加入一定物质的量浓度的KOH溶液,所得溶液中 、
、 、
、 三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,回答下列问题:
三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,回答下列问题:
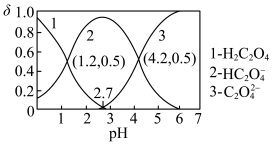
①如果所得溶液溶质为 ,则该溶液显
,则该溶液显___________ (填“酸性”、“碱性”或“中性”),其电离方程式为___________ ;
②如果所得溶液溶质为 ,则该溶液中各离子浓度由大到小顺序为
,则该溶液中各离子浓度由大到小顺序为___________ ;
③当所得溶液 时,溶液中
时,溶液中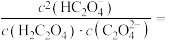
___________ ;
(3)已知25℃草酸钙的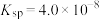 ,碳酸钙的
,碳酸钙的 。回答下列问题:25℃时向10mL碳酸钙的饱和溶液中逐滴加入
。回答下列问题:25℃时向10mL碳酸钙的饱和溶液中逐滴加入 的草酸钾溶液10mL,
的草酸钾溶液10mL,___________ 产生草酸钙沉淀(填“能”或“否”)。
(1)已知某温度下有如下三个反应:
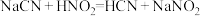


①则该温度下HF、HCN和
 三种弱酸的电离常数由大到小的顺序是
三种弱酸的电离常数由大到小的顺序是②已知:乙二酸(
 ,可简写为
,可简写为 ),俗称草酸;25℃
),俗称草酸;25℃
 ,
,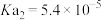 ,25℃
,25℃ ,请写出少量草酸(
,请写出少量草酸( )与NaF溶液反应的化学方程式:
)与NaF溶液反应的化学方程式:(2)常温下,向某浓度的草酸溶液中逐滴加入一定物质的量浓度的KOH溶液,所得溶液中
 、
、 、
、 三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,回答下列问题:
三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,回答下列问题:
①如果所得溶液溶质为
 ,则该溶液显
,则该溶液显②如果所得溶液溶质为
 ,则该溶液中各离子浓度由大到小顺序为
,则该溶液中各离子浓度由大到小顺序为③当所得溶液
 时,溶液中
时,溶液中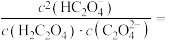
(3)已知25℃草酸钙的
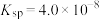 ,碳酸钙的
,碳酸钙的 。回答下列问题:25℃时向10mL碳酸钙的饱和溶液中逐滴加入
。回答下列问题:25℃时向10mL碳酸钙的饱和溶液中逐滴加入 的草酸钾溶液10mL,
的草酸钾溶液10mL,
您最近一年使用:0次
2023-11-09更新
|
409次组卷
|
2卷引用:湖南省邵阳市第二中学2023-2024学年高二上学期基础知识竞赛化学试题
名校
9 . 某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A=H++HA-,HA- H++A2-。据此回答下列问题。
H++A2-。据此回答下列问题。
(1)Na2A溶液显______ (选填“酸性”、“碱性”、“中性”或“无法确定”)。
(2)在0.1mol/L的Na2A溶液中,下列粒子浓度关系式正确的是______ 。
(3)室温下,pH=10的氨水与pH=4的NH4C1溶液中,由水电离出的c(H+)之比为______ 。
(4)①NH4Al(SO4)2可作净水剂,其理由是______ 。(用必要的化学用语和相关文字说明)。
②相同条件下,0.1mol·L-1NH4Al(SO4)2溶液中c(NH )
)______ (填“等于”“大于”或“小于”)0.1mol·L-1NH4HSO4溶液中c(NH )。
)。
(5)已知Ksp(BaCO3)=2.6×l0-9,Ksp(BaSO4)=1.1×10-10。
①现将浓度为2×10-4mol/LNa2CO3溶液与BaCl2溶液等体积混合,则生成BaCO3沉淀所需BaCl2溶液的最小浓度为____ mol/L。
②向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液中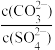 =
=______ (保留三位有效数字)。
 H++A2-。据此回答下列问题。
H++A2-。据此回答下列问题。(1)Na2A溶液显
(2)在0.1mol/L的Na2A溶液中,下列粒子浓度关系式正确的是
| A.0.1mol/L=c(HA-)+c(A2-)+c(H2A) |
| B.c(Na+)+c(OH-)=c(HA-)+c(H+) |
| C.c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-) |
| D.c(Na+)=2c(HA-)+2c(A2-) |
(4)①NH4Al(SO4)2可作净水剂,其理由是
②相同条件下,0.1mol·L-1NH4Al(SO4)2溶液中c(NH
 )
) )。
)。(5)已知Ksp(BaCO3)=2.6×l0-9,Ksp(BaSO4)=1.1×10-10。
①现将浓度为2×10-4mol/LNa2CO3溶液与BaCl2溶液等体积混合,则生成BaCO3沉淀所需BaCl2溶液的最小浓度为
②向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液中
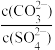 =
=
您最近一年使用:0次
10 . 回答下列问题
(1)常温下,浓度均为0.1 的五种钠盐溶液的
的五种钠盐溶液的 如下表所示:
如下表所示:
①上述几种钠盐的阴离子,结合氢离子能力最强的是____________ (填离子符号)。
②根据表中数据判断,将浓度均为0.01 的下列四种酸的溶液分别稀释至原体积的100倍,
的下列四种酸的溶液分别稀释至原体积的100倍, 变化最大的是
变化最大的是____________ 。
a. B.
B. C.
C. D.
D.
(2)实验室中常用氢氧化钠溶液进行洗气和提纯。
已知:几种离子开始沉淀时溶液的 如下表所示:
如下表所示:
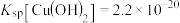 ,
, 。
。
①用150 1
1
 溶液吸收标准状况下的2.24L
溶液吸收标准状况下的2.24L ,所得溶液中各离子的浓度由大到小的顺序为
,所得溶液中各离子的浓度由大到小的顺序为____________ 。
②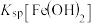
___________ (填“>”“=”或“<”)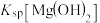 。
。
③当向含有相同浓度的 、
、 、
、 的溶液中滴加
的溶液中滴加 溶液时,
溶液时,_________ (填离子符号)先沉淀。
④要使0.2
 溶液中
溶液中 沉淀完全,则应向溶液中加入
沉淀完全,则应向溶液中加入 溶液使溶液的
溶液使溶液的 不低于
不低于_________ (保留1位小数)。
(1)常温下,浓度均为0.1
 的五种钠盐溶液的
的五种钠盐溶液的 如下表所示:
如下表所示:溶质 |
|
|
|
|
|
| 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①上述几种钠盐的阴离子,结合氢离子能力最强的是
②根据表中数据判断,将浓度均为0.01
 的下列四种酸的溶液分别稀释至原体积的100倍,
的下列四种酸的溶液分别稀释至原体积的100倍, 变化最大的是
变化最大的是a.
 B.
B. C.
C. D.
D.
(2)实验室中常用氢氧化钠溶液进行洗气和提纯。
已知:几种离子开始沉淀时溶液的
 如下表所示:
如下表所示:离子 |
|
|
|
| 7.6 | 5.2 | 10.1 |
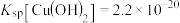 ,
, 。
。①用150
 1
1
 溶液吸收标准状况下的2.24L
溶液吸收标准状况下的2.24L ,所得溶液中各离子的浓度由大到小的顺序为
,所得溶液中各离子的浓度由大到小的顺序为②
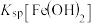
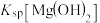 。
。③当向含有相同浓度的
 、
、 、
、 的溶液中滴加
的溶液中滴加 溶液时,
溶液时,④要使0.2

 溶液中
溶液中 沉淀完全,则应向溶液中加入
沉淀完全,则应向溶液中加入 溶液使溶液的
溶液使溶液的 不低于
不低于
您最近一年使用:0次
2023-03-01更新
|
100次组卷
|
2卷引用:湖南省邵阳市新邵县第八中学2022-2023学年高二上学期期末质量检测化学试题








