名校
1 . 磷的含氧酸有磷酸(H3PO4)、亚磷酸(H3PO3)次磷酸(H3PO2)等多种,它们在工业上都是重要的化工原料。
(1)亚磷酸(H3PO3)是一种二元弱酸,写出H3PO3与过量NaOH溶液反应的化学方程式:_______ 。某温度下,0.1 mol H3PO3溶液的pH为3.3,该温度下,H3PO3的一级电离常数_______ 。(已知:lg 2 = 0.3,lg 3 = 0.5,lg 5 = 0.7,H3PO3的第二步电离忽略不计)
(2)实验小组用NaOH溶液处理含H3PO3的废水,当溶液中c(Na+)=c(H2PO )+2c(HPO
)+2c(HPO )时,溶液呈
)时,溶液呈_______ 性(填“酸”“碱”或“中”)。
(3)已知:常温下,磷酸(H3PO4)的Ka1=7.11×10-3、Ka2=6.23×10-8、Ka3=4.5×10-13,则常温下,Na2HPO4溶液中 、
、 和
和 的浓度由大到小的顺序为
的浓度由大到小的顺序为_______ ,
(4)某浓度的磷酸溶液中滴加NaOH溶液,其pH与溶液中H3PO4、 、
、 和
和 的物质的量分数为δ(平衡时某物种的浓度与整个物种浓度之和的比值)的关系如图所示。以酚酞为指示剂,当溶液由无色变为浅红色时,发生主要反应的离子方程式是
的物质的量分数为δ(平衡时某物种的浓度与整个物种浓度之和的比值)的关系如图所示。以酚酞为指示剂,当溶液由无色变为浅红色时,发生主要反应的离子方程式是_______ 。

(5)已知:常温下,Ksp(FePO4)=1.3×10-22、Ksp(AlPO4)=5.2×10-19.常温下,向含Fe3+、A13+的混合溶液中滴加Na3PO4溶液,当FePO4、AlPO4同时生成时,溶液中c(Fe3+):c(Al3+)=_______ 。
(1)亚磷酸(H3PO3)是一种二元弱酸,写出H3PO3与过量NaOH溶液反应的化学方程式:
(2)实验小组用NaOH溶液处理含H3PO3的废水,当溶液中c(Na+)=c(H2PO
 )+2c(HPO
)+2c(HPO )时,溶液呈
)时,溶液呈(3)已知:常温下,磷酸(H3PO4)的Ka1=7.11×10-3、Ka2=6.23×10-8、Ka3=4.5×10-13,则常温下,Na2HPO4溶液中
 、
、 和
和 的浓度由大到小的顺序为
的浓度由大到小的顺序为(4)某浓度的磷酸溶液中滴加NaOH溶液,其pH与溶液中H3PO4、
 、
、 和
和 的物质的量分数为δ(平衡时某物种的浓度与整个物种浓度之和的比值)的关系如图所示。以酚酞为指示剂,当溶液由无色变为浅红色时,发生主要反应的离子方程式是
的物质的量分数为δ(平衡时某物种的浓度与整个物种浓度之和的比值)的关系如图所示。以酚酞为指示剂,当溶液由无色变为浅红色时,发生主要反应的离子方程式是
(5)已知:常温下,Ksp(FePO4)=1.3×10-22、Ksp(AlPO4)=5.2×10-19.常温下,向含Fe3+、A13+的混合溶液中滴加Na3PO4溶液,当FePO4、AlPO4同时生成时,溶液中c(Fe3+):c(Al3+)=
您最近一年使用:0次
名校
解题方法
2 . 已知:25 ℃时,Ka1(H2SO3)=1.5×10-2,Ka2(H2SO3)=6×10‑8,Ka1 (H2A)=1.3×10-7, Ka2 (H2A)=7.1×10-10,Ksp(CaSO3)=3.1 × 10-7。
(1)H2SO3溶液和NaHA溶液反应的主要离子方程式为_______ (不考虑H2SO3与HA-发生氧化还原反应)。
(2)0.1mol/L Na2SO3溶液中离子浓度由大到小的顺序为____ 。
(3)25℃时.将10mL0.20mol·L-1的HCOOH溶液和10mL0.20mol·L-1的CH3COOH溶液分别与10mL0.20mol·L-1的NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示:

①HCO 的电离平衡常数表达式K=
的电离平衡常数表达式K=____ 。
②反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是______ ,反应结束后所得两溶液中,c(HCOO- )_________ c(CH3COO-)(填“>”“<”或“=”)。
(4)25℃ 时,某溶液中含有0.001 mol/LCa2+、0.010 mol/L H2SO3,加入KOH固体以调节溶液pH(忽略溶液体积的变化、忽略H2SO3的挥发和分解)。当pH为7时,能否有CaSO3沉淀生成_______ (填“能”或“否”)。
(1)H2SO3溶液和NaHA溶液反应的主要离子方程式为
(2)0.1mol/L Na2SO3溶液中离子浓度由大到小的顺序为
(3)25℃时.将10mL0.20mol·L-1的HCOOH溶液和10mL0.20mol·L-1的CH3COOH溶液分别与10mL0.20mol·L-1的NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示:

①HCO
 的电离平衡常数表达式K=
的电离平衡常数表达式K=②反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是
(4)25℃ 时,某溶液中含有0.001 mol/LCa2+、0.010 mol/L H2SO3,加入KOH固体以调节溶液pH(忽略溶液体积的变化、忽略H2SO3的挥发和分解)。当pH为7时,能否有CaSO3沉淀生成
您最近一年使用:0次
2020-08-24更新
|
589次组卷
|
8卷引用:湖南省长沙市第一中学2020届高三上学期第四次月考化学试题
解题方法
3 . 电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离平衡常数如下表:
①HCOONa、NaCN、NaHCO3、Na2CO3这四种溶液的阴离子结合质子能力最强的是______ 。
②体积相同、c(H+)相同的三种酸溶液a.HCOOH;b.HCN;c.H2SO4分别与浓度相等的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填序号)_____ 。
③向NaCN溶液通入少量CO2反应的化学方程式是_______ 。
(2)一定浓度的NaCN溶液pH=9,用离子方程式表示呈碱性的原因是____ ,此时, =
=_____ 。
(3)常温下,向20 mL 0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/L HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
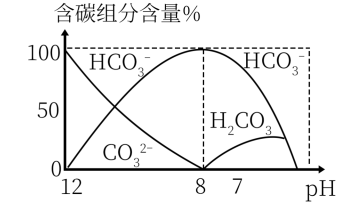
回答下列问题:
在同一溶液中H2CO3、 、
、
______ (填“能”或“不能”)大量共存。
②当pH=7时,溶液中含碳元素的主要微粒为_____ ,溶液中各种离子( 除外)的物质的量浓度的大小关系为
除外)的物质的量浓度的大小关系为______ 。
③已知在25℃时, 水解反应的平衡常数即水解常数Kh=
水解反应的平衡常数即水解常数Kh=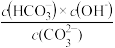 =2.0×10-4,当溶液中c(
=2.0×10-4,当溶液中c( ):c(
):c( )=2:1时,溶液pH=
)=2:1时,溶液pH=______ 。
(4)已知CaCO3的Ksp=2.8×10-9,现将浓度为2×10-4 mol/L Na2CO3溶液与CaCl2溶液等体积混合,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为________ mol/L。
(1)已知部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
①HCOONa、NaCN、NaHCO3、Na2CO3这四种溶液的阴离子结合质子能力最强的是
②体积相同、c(H+)相同的三种酸溶液a.HCOOH;b.HCN;c.H2SO4分别与浓度相等的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填序号)
③向NaCN溶液通入少量CO2反应的化学方程式是
(2)一定浓度的NaCN溶液pH=9,用离子方程式表示呈碱性的原因是
 =
=(3)常温下,向20 mL 0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/L HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。

回答下列问题:
在同一溶液中H2CO3、
 、
、
②当pH=7时,溶液中含碳元素的主要微粒为
 除外)的物质的量浓度的大小关系为
除外)的物质的量浓度的大小关系为③已知在25℃时,
 水解反应的平衡常数即水解常数Kh=
水解反应的平衡常数即水解常数Kh=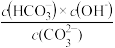 =2.0×10-4,当溶液中c(
=2.0×10-4,当溶液中c( ):c(
):c( )=2:1时,溶液pH=
)=2:1时,溶液pH=(4)已知CaCO3的Ksp=2.8×10-9,现将浓度为2×10-4 mol/L Na2CO3溶液与CaCl2溶液等体积混合,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为
您最近一年使用:0次
2020-07-13更新
|
258次组卷
|
3卷引用:湖南省衡阳县第四中学 2022-2023学年高二下学期开学摸底考试(平行班)化学试题
解题方法
4 . (1)泡沫灭火剂中装有Al2(SO4)3溶液、NaHCO3溶液及起泡剂,写出使用时发生反应的离子方程式 ________________________ 。
(2)写出难溶电解质的溶度积表达式,Mg(OH)2:____________ ;在Mg(OH)2悬浊液中加入MgCl2固体,平衡________ 移动(填“正向”“逆向”或“不”),Ksp________ (填“增大”“减小”或“不变”)。
(3)1 g固体炭与水蒸气反应生成CO气体和H2气体,需吸收a kJ热量,此反应的热化学方程式为____ 。
(2)写出难溶电解质的溶度积表达式,Mg(OH)2:
(3)1 g固体炭与水蒸气反应生成CO气体和H2气体,需吸收a kJ热量,此反应的热化学方程式为
您最近一年使用:0次
10-11高二·河南洛阳·阶段练习
名校
5 . 工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大危害,必须进行处理。常用的处理方法有以下两种:
方法1:还原沉淀法
该法的工艺流程为:
CrO42- Cr2O72-
Cr2O72-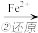 Cr3+
Cr3+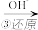 Cr(OH)3
Cr(OH)3
其中第①步存在平衡2CrO42-(黄色)+2H+ Cr2O32-(橙色)+H2O
Cr2O32-(橙色)+H2O
(1)若平衡体系的pH=2,该溶液显______ 色。
(2)能说明第①步反应达平衡状态的是_____ (填序号)
A.Cr2O72-和CrO42-的浓度相同
B.2v(Cr2O72-)=v(CrO42-)
C.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72-离子,需要______ mol的FeSO4·7H2O。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) Cr3+(aq)+3OH−(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH−)=10−32,要使c(Cr3+)降至10−5mol/L,溶液的pH应调至
Cr3+(aq)+3OH−(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH−)=10−32,要使c(Cr3+)降至10−5mol/L,溶液的pH应调至______ 。
方法2:电解法
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为______ (用电极反应式解释)。
(6)在阴极附近溶液pH升高,溶液中同时生成的沉淀还有______ 。
方法1:还原沉淀法
该法的工艺流程为:
CrO42-
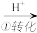 Cr2O72-
Cr2O72-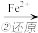 Cr3+
Cr3+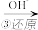 Cr(OH)3
Cr(OH)3 其中第①步存在平衡2CrO42-(黄色)+2H+
 Cr2O32-(橙色)+H2O
Cr2O32-(橙色)+H2O(1)若平衡体系的pH=2,该溶液显
(2)能说明第①步反应达平衡状态的是
A.Cr2O72-和CrO42-的浓度相同
B.2v(Cr2O72-)=v(CrO42-)
C.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72-离子,需要
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)
 Cr3+(aq)+3OH−(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH−)=10−32,要使c(Cr3+)降至10−5mol/L,溶液的pH应调至
Cr3+(aq)+3OH−(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH−)=10−32,要使c(Cr3+)降至10−5mol/L,溶液的pH应调至方法2:电解法
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为
(6)在阴极附近溶液pH升高,溶液中同时生成的沉淀还有
您最近一年使用:0次
2020-03-20更新
|
324次组卷
|
12卷引用:湖南省怀化市中方一中2020届高三下学期第一次模拟测试理综化学试题
湖南省怀化市中方一中2020届高三下学期第一次模拟测试理综化学试题(已下线)2011-2012学年河南省偃师市高级中学高二第二次月考化学试卷(已下线)2011-2012学年度江西省临川十中上学期高三期末考试化学试卷(已下线)2012-2013学年云南省玉溪一中高二第二次月考(6月)化学试卷(已下线)2014年高中化学苏教版选修四模块综合检测练习卷四川省雅安中学2016-2017学年高二下学期半期考试化学试题陕西省西安市交通大学附属中学2017-2018学年高二第二次月考期末选修四测试化学试题福建省福州市第三中学2017-2018学年高二下学期期末考试化学试题【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高二(理)上学期期中考试化学试题(已下线)广西柳州铁路第一中学2017届高三第二次理科综合测试化学试题陕西省西安市周至县第五中学2020届高三第二次模拟考试化学试题广东省化州市第一中学2019-2020学年高二4月线上统一测试化学试题
2014高二·湖南·学业考试
解题方法
6 . 水溶液中的离子平衡是化学反应原理的重要内容。请回答下列问题:
(1)常温下,0.1mol/LCH3COONa溶液呈_________ (填“酸”、“碱”或“中”)性,溶液中c(Na+)______ c(CH3COO-)(填“>”、“<”或“=”);
(2)常温下,在浓度均为0.1mol/L的盐酸和NH4Cl溶液中,水的电离程度大小关系是:0.1mol/L盐酸______ 0.1mol/LNH4Cl溶液(填“>”、“<”或“=”);
(3)已知:20℃时,Ksp(AgCl)=1.1×10-10,Ksp(AgBr)=2.0×10-13。将AgCl和AgBr的饱和溶液等体积混合,再逐滴加入足量浓AgNO3溶液,充分反应后,生成沉淀量的关系是:m(AgCl)_______ m(AgBr)(填“>”、“<”或“=”)。
(1)常温下,0.1mol/LCH3COONa溶液呈
(2)常温下,在浓度均为0.1mol/L的盐酸和NH4Cl溶液中,水的电离程度大小关系是:0.1mol/L盐酸
(3)已知:20℃时,Ksp(AgCl)=1.1×10-10,Ksp(AgBr)=2.0×10-13。将AgCl和AgBr的饱和溶液等体积混合,再逐滴加入足量浓AgNO3溶液,充分反应后,生成沉淀量的关系是:m(AgCl)
您最近一年使用:0次
7 . 金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶性金属氢氧化物在不同pH下的溶解度[S(mol·L-1)]如图所示。

(1)pH=6时溶液中铜元素的主要存在形式是________ 。
(2)若要除去CuCl2溶液中的少量Fe3+,下列最适宜的pH 范围是_____ (选填序号)。
A.<2 B. 3.5〜4.2 C. >6.3
(3)在Ni(OH)2溶液中含有少量的Co2+杂质,_______ (填“能”或“不能”)通过调节溶液pH的方法来除去,理由是______ .
(4)可用加入氨水的方法使Cu(OH)2沉淀溶解,生成的产物之一为[Cu(NH3)4]2+。该反应的离子方程式为______ .
已知一些难溶物的溶度积常数如下表:
(5)某工业废水中含有Cu2+、Pb2+、Hg2+,为除去这些离子,最适宜向此工业废水中加入过量的______ (选填序号)。
A.NaOH B.FeS C.Na2S

(1)pH=6时溶液中铜元素的主要存在形式是
(2)若要除去CuCl2溶液中的少量Fe3+,下列最适宜的pH 范围是
A.<2 B. 3.5〜4.2 C. >6.3
(3)在Ni(OH)2溶液中含有少量的Co2+杂质,
(4)可用加入氨水的方法使Cu(OH)2沉淀溶解,生成的产物之一为[Cu(NH3)4]2+。该反应的离子方程式为
已知一些难溶物的溶度积常数如下表:
| 物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
| Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-36 | 3.4×10-28 | 6.4×10-53 | 1.6×10-24 |
(5)某工业废水中含有Cu2+、Pb2+、Hg2+,为除去这些离子,最适宜向此工业废水中加入过量的
A.NaOH B.FeS C.Na2S
您最近一年使用:0次
名校
解题方法
8 . I.已知25℃时,醋酸、碳酸、氢氰酸的电离平衡常数如下表:(单位省略)
(1)写出碳酸的第一步电离方程式__________________________________ 。
(2)25℃时,等浓度的三种溶液①NaCN 溶液、②Na2CO3溶液、③CH3COONa 溶液,pH由大到小的顺序为_____________________ (填序号)。
(3)25℃时,向NaCN溶液中通入少量CO2,反应的离子方程式为_______________ 。
(4)将浓度为0.02mol/L的HCN 与0.01mol/LNaOH 溶液等体积混合,测得混合溶液中c(Na+)>c(CN ),下列关系正确的是
),下列关系正确的是_______ 。
a.c(H+)>c(OH ) b.c(H+)+c(HCN)=c(OH
) b.c(H+)+c(HCN)=c(OH ) c.c(HCN)+c(CN
) c.c(HCN)+c(CN )=0.01mol/L
)=0.01mol/L
II.请用有关电解质溶液的知识回答下列问题:
(1)某温度下纯水的c(H+)=4.0×10 mol/L,若温度不变,滴入稀盐酸,使c(H+)=2.0×10
mol/L,若温度不变,滴入稀盐酸,使c(H+)=2.0×10 mol/L,则此溶液中由水电离产生的c(H+)=
mol/L,则此溶液中由水电离产生的c(H+)=_________ 。
(2)氢氧化铜悬浊液中存在如下平衡:Cu(OH)2(s) ⇌Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)·c2(OH-)=2×10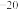 。某硫酸铜溶液里c(Cu2+)=0.02 mol·L
。某硫酸铜溶液里c(Cu2+)=0.02 mol·L ,如要生成Cu(OH)2沉淀,应调整溶液使之pH>
,如要生成Cu(OH)2沉淀,应调整溶液使之pH>________
(3)向含有相同浓度Fe2+、Hg2+的溶液中滴加Na2S溶液,先生成______ 沉淀(填化学式)。在工业废水处理过程中,依据沉淀转化原理,可用FeS作为沉淀剂除去废水中的Hg2+,写出相应的离子方程式______________________ 。(Ksp(FeS)=6.3×10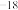 ,Ksp(HgS)=6.4×10
,Ksp(HgS)=6.4×10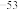 )
)
| 醋酸 | 碳酸 | 氢氰酸 |
Ka=1.7×10 | Ka1=4.2×10 Ka2=5.6×10 Ka2=5.6×10 | Ka=6.2×10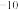 |
(1)写出碳酸的第一步电离方程式
(2)25℃时,等浓度的三种溶液①NaCN 溶液、②Na2CO3溶液、③CH3COONa 溶液,pH由大到小的顺序为
(3)25℃时,向NaCN溶液中通入少量CO2,反应的离子方程式为
(4)将浓度为0.02mol/L的HCN 与0.01mol/LNaOH 溶液等体积混合,测得混合溶液中c(Na+)>c(CN
 ),下列关系正确的是
),下列关系正确的是a.c(H+)>c(OH
 ) b.c(H+)+c(HCN)=c(OH
) b.c(H+)+c(HCN)=c(OH ) c.c(HCN)+c(CN
) c.c(HCN)+c(CN )=0.01mol/L
)=0.01mol/LII.请用有关电解质溶液的知识回答下列问题:
(1)某温度下纯水的c(H+)=4.0×10
 mol/L,若温度不变,滴入稀盐酸,使c(H+)=2.0×10
mol/L,若温度不变,滴入稀盐酸,使c(H+)=2.0×10 mol/L,则此溶液中由水电离产生的c(H+)=
mol/L,则此溶液中由水电离产生的c(H+)=(2)氢氧化铜悬浊液中存在如下平衡:Cu(OH)2(s) ⇌Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)·c2(OH-)=2×10
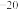 。某硫酸铜溶液里c(Cu2+)=0.02 mol·L
。某硫酸铜溶液里c(Cu2+)=0.02 mol·L ,如要生成Cu(OH)2沉淀,应调整溶液使之pH>
,如要生成Cu(OH)2沉淀,应调整溶液使之pH>(3)向含有相同浓度Fe2+、Hg2+的溶液中滴加Na2S溶液,先生成
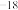 ,Ksp(HgS)=6.4×10
,Ksp(HgS)=6.4×10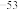 )
)
您最近一年使用:0次
2020-01-14更新
|
416次组卷
|
3卷引用:湖南省张家界市2019-2020学年高二上学期期末考试化学试题
名校
9 . 描述弱电解质电离情况可以用电离度和电离平衡常数表示,常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),几种难(微)溶物的溶度积常数(Ksp)
请回答下列问题
(1)下列能使醋酸溶液中CH3COOH的电离程度增大,电离常数不变_____ (填字母序号)
A.升高温度B.加水稀释C.加少量的CH3COONa固体D.加少量冰醋酸
(2)CH3COONH4的水溶液呈_______ (选填“酸性”、“中性”或“碱性”),该溶液中存在的各离子浓度大小关系是____________________________ 。
(3)物质的量之比为1:1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子浓度从大到小的列排列为___________________________________________ 。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如BaCl2),具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3,现有足量BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度不小于0.01mol·L-1,则溶液中CO32-物质的量浓度应≥________________
| 酸或碱 | 电离平衡常数(Ka或Kb) | 难(微)溶物 | 溶度积常数(Ksp) |
| CH3COOH | 1.8×10-5 | BaSO4 | 1×10-10 |
| HNO2 | 4.6×10-4 | BaCO3 | 2.6×10-9 |
| HCN | 5×10-10 | CaSO4 | 7×10-5 |
| NH3·H2O | 1.8×10-5 | CaCO3 | 5×10-9 |
(1)下列能使醋酸溶液中CH3COOH的电离程度增大,电离常数不变
A.升高温度B.加水稀释C.加少量的CH3COONa固体D.加少量冰醋酸
(2)CH3COONH4的水溶液呈
(3)物质的量之比为1:1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子浓度从大到小的列排列为
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如BaCl2),具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3,现有足量BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度不小于0.01mol·L-1,则溶液中CO32-物质的量浓度应≥
您最近一年使用:0次
名校
解题方法
10 . (1)羰基硫(COS)多产生于煤化工合成气中,能引起催化剂中毒,可通过水解反应除去,其热化学方程式为COS(g)+H2O(g) H2S(g)+CO2(g) △H。相关的化学键键能数据如下表所示:
H2S(g)+CO2(g) △H。相关的化学键键能数据如下表所示:
则△H为___ 。
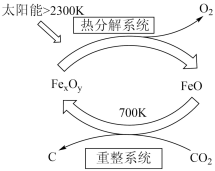
(2)近期太阳能的利用又有新进展。利用太阳能由CO2制取C的原理如图所示,若重整系统发生的反应中 =4,则重整系统中发生反应的化学方程式为:
=4,则重整系统中发生反应的化学方程式为:___ 。
(3)已知:常温下,Ka(HCOOH)=1.77×10-4,Ka(CH3COOH)=1.75×10-5,Kb(NH3·H2O)=1.76×10-5。下列说法正确的是___ (填字母代号)。
A.浓度均为0.1mol·L-1的HCOONa和NH4Cl溶液中阳离子的物质的量浓度之和:前者大于后者
B.用相同浓度的NaOH溶液分别滴定等体积、pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等
C.0.2mol·L-1CH3COONa与0.1mol·L-1盐酸等体积混合后的溶液中(pH<7):c(CH3COO-)>c(Cl-)>c(CH3COOH)>C(H+)
D.0.2mol·L-1HCOOH与0.1mol·L-1 NaOH等体积混合后的溶液中:c(HCOO-)+c(OH-)=c(HCOOH)+c(H+)
(4)NaHS可用作污水处理的沉淀剂。已知:25℃时,H2S的电离常数Ka1=1.0×10-7、Ka2=7.0×10-15,反应Hg2+(aq)+HS-(aq) HgS(s)+H+(aq)的平衡常数K=1.75×1038。则Ksp(HgS)=
HgS(s)+H+(aq)的平衡常数K=1.75×1038。则Ksp(HgS)=___ 。
 H2S(g)+CO2(g) △H。相关的化学键键能数据如下表所示:
H2S(g)+CO2(g) △H。相关的化学键键能数据如下表所示:| 化学键 | C=O(CO2) | C=O(COS) | C=S(COS) | H-S | H-O |
E/kJ mol-1 mol-1 | 803 | 742 | 577 | 339 | 465 |
则△H为
(2)近期太阳能的利用又有新进展。利用太阳能由CO2制取C的原理如图所示,若重整系统发生的反应中
 =4,则重整系统中发生反应的化学方程式为:
=4,则重整系统中发生反应的化学方程式为:
(3)已知:常温下,Ka(HCOOH)=1.77×10-4,Ka(CH3COOH)=1.75×10-5,Kb(NH3·H2O)=1.76×10-5。下列说法正确的是
A.浓度均为0.1mol·L-1的HCOONa和NH4Cl溶液中阳离子的物质的量浓度之和:前者大于后者
B.用相同浓度的NaOH溶液分别滴定等体积、pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等
C.0.2mol·L-1CH3COONa与0.1mol·L-1盐酸等体积混合后的溶液中(pH<7):c(CH3COO-)>c(Cl-)>c(CH3COOH)>C(H+)
D.0.2mol·L-1HCOOH与0.1mol·L-1 NaOH等体积混合后的溶液中:c(HCOO-)+c(OH-)=c(HCOOH)+c(H+)
(4)NaHS可用作污水处理的沉淀剂。已知:25℃时,H2S的电离常数Ka1=1.0×10-7、Ka2=7.0×10-15,反应Hg2+(aq)+HS-(aq)
 HgS(s)+H+(aq)的平衡常数K=1.75×1038。则Ksp(HgS)=
HgS(s)+H+(aq)的平衡常数K=1.75×1038。则Ksp(HgS)=
您最近一年使用:0次



