名校
解题方法
1 . I.根据下列图象,进行分析:
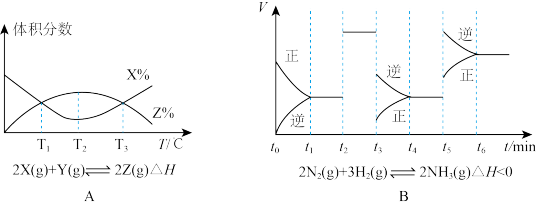
(1)由图A知,该反应的K值随温度的升高而_____ (填“增大”、“减小”或“不变”)。
(2)由图B知,t3时采取的措施为_____ ,t1~t6中,氨气的含量最低的是_____ 。
II.已知H2A在水中电离:H2A=HA-+H+,HA- A2-+H+。
A2-+H+。
(1)常温下NaHA溶液的pH__ (填序号)。
A.大于7 B.小于7 C.等于7 D.无法确定
(2)某温度下,若向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/LKOH溶液至溶液呈中性(稀溶液体积可以加和),此时该混合溶液中的下列关系一定正确的是______ 。
A.c(H+)·c(OH-)=1×10-14 B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+) D.c(Na+)+c(K+)=0.05 mol/L
(3)已知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s) Ca2+(aq)+A2-(aq)∆H>0。若要使该溶液中Ca2+浓度变小,可采取的措施有
Ca2+(aq)+A2-(aq)∆H>0。若要使该溶液中Ca2+浓度变小,可采取的措施有______ 。
A.升高温度 B.加入Na2A固体 C.加入NH4Cl晶体

(1)由图A知,该反应的K值随温度的升高而
(2)由图B知,t3时采取的措施为
II.已知H2A在水中电离:H2A=HA-+H+,HA-
 A2-+H+。
A2-+H+。(1)常温下NaHA溶液的pH
A.大于7 B.小于7 C.等于7 D.无法确定
(2)某温度下,若向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/LKOH溶液至溶液呈中性(稀溶液体积可以加和),此时该混合溶液中的下列关系一定正确的是
A.c(H+)·c(OH-)=1×10-14 B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+) D.c(Na+)+c(K+)=0.05 mol/L
(3)已知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s)
 Ca2+(aq)+A2-(aq)∆H>0。若要使该溶液中Ca2+浓度变小,可采取的措施有
Ca2+(aq)+A2-(aq)∆H>0。若要使该溶液中Ca2+浓度变小,可采取的措施有A.升高温度 B.加入Na2A固体 C.加入NH4Cl晶体
您最近一年使用:0次
名校
2 . 常温下,几种物质的溶度积常数见表:
(1)某酸性CuCl2溶液中含少量的FeCl3,为制得纯净CuCl2溶液,宜加入___ ,将溶液调至pH=4,使Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=___ mol/L。
(2)上述溶液过滤后,将所得滤液经过蒸发浓缩、冷却结晶得到CuCl2•2H2O晶体。某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.800g试样溶于水,加入适当过量的KI固体,充分反应后用0.1000mol/LNa2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液40.00mL。(已知:2Cu2++4I-=2CuI↓+I2;I2+2S2O =S4O
=S4O +2I-)。
+2I-)。
试回答:
①可选用___ 作滴定指示剂,滴定终点的现象是___ 。
②含有CuCl2•2H2O晶体的试样的纯度是___ 。
③若滴定到终点时,仰视读数,则测定结果___ 。
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(1)某酸性CuCl2溶液中含少量的FeCl3,为制得纯净CuCl2溶液,宜加入
(2)上述溶液过滤后,将所得滤液经过蒸发浓缩、冷却结晶得到CuCl2•2H2O晶体。某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.800g试样溶于水,加入适当过量的KI固体,充分反应后用0.1000mol/LNa2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液40.00mL。(已知:2Cu2++4I-=2CuI↓+I2;I2+2S2O
 =S4O
=S4O +2I-)。
+2I-)。试回答:
①可选用
②含有CuCl2•2H2O晶体的试样的纯度是
③若滴定到终点时,仰视读数,则测定结果
您最近一年使用:0次
名校
解题方法
3 . (1)常温下,pH=12的NaOH溶液,其浓度c(NaOH)=
(2)常温下,某一元弱酸溶液的pH=1,其浓度
(3)向物质的量浓度均为0.01mol/L的MnCl2和BaCl2混合溶液中,滴加Na2CO3溶液,先沉淀的离子是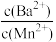 =
=
您最近一年使用:0次
名校
4 . 已知:乙二酸俗称草酸(结构简式为HOOC-COOH,可简写为H2C2O4)。25℃时,草酸的电离平衡常数为K1=5.0×10-2,K2=5.4×10-5;碳酸(H2CO3)的电离平衡常数为K1=4.4×10-7,K2=4.7×10-11。草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。回答下列问题:
(1)相同条件下物质的量浓度都为0.1mol/L的Na2C2O4溶液的pH比Na2CO3溶液的pH__ 。(填“大”“小”或“相等”)
(2)常温下将0.1 mol/L的KOH溶液10mL与0.1 mol/L的草酸溶液10mL混合,若混合溶液显酸性,则混合后溶液中阴离子浓度的大小顺序为__ 。
(3)25℃时,向20 mL碳酸钙的饱和溶液中逐滴加入8.0×10-4 mol/L的草酸钾溶液10mL后,能否产生沉淀(写出计算过程)__________ 。
(1)相同条件下物质的量浓度都为0.1mol/L的Na2C2O4溶液的pH比Na2CO3溶液的pH
(2)常温下将0.1 mol/L的KOH溶液10mL与0.1 mol/L的草酸溶液10mL混合,若混合溶液显酸性,则混合后溶液中阴离子浓度的大小顺序为
(3)25℃时,向20 mL碳酸钙的饱和溶液中逐滴加入8.0×10-4 mol/L的草酸钾溶液10mL后,能否产生沉淀(写出计算过程)
您最近一年使用:0次
5 . 已知乙二酸俗称草酸(H2C2O4)。25℃,有下表相关数据,请回答下列问题
(1)写出 水解的离子方程式
水解的离子方程式___________
(2)相同条件下物质的量浓度都为0.01mol/LNa2C2O4溶液的pH比NaHCO3溶液的pH___________ (填“大”、“小”或“相等”)
(3)常温下将0.2mol/L的KOH溶液10mL与0.1mol/L的草酸溶液10mL混合,混合后溶液中阴离子浓度由大到小顺序为___________
(4)25℃时,向20mL碳酸钙的饱和溶液中逐滴加入amol/L的草酸钾溶液10mL后,有草酸钙沉淀生成,则a的最小值为___________
(5)为了测定草酸晶体H2C2O4·xH2O中的x值,某实验小组进行实验,步骤如下:
①称取1.260g草酸晶体,配成100mL溶液。
②取25.00mL该H2C2O4溶液加入锥形瓶内,再加入适量稀硫酸。
③用浓度为0.1000mol/L的KMnO4溶液滴定至终点。重复上述操作2次,滴定结果如表所示:
①滴定过程中,盛装KMnO4溶液的仪器为___________ (填名称)
②滴定终点的现象为___________
③已知反应:5H2C2O4+2 +6H+=10CO2↑+2Mn2++8H2O。根据数据,计算x=
+6H+=10CO2↑+2Mn2++8H2O。根据数据,计算x=___________
④若滴定终点读数俯视KMnO4溶液液面,则x值会___________ (填“偏大”、“偏小”或“无影响”)
| 电离常数 | 溶度积 | ||
| 草酸 | 碳酸 | 草酸钙 | 碳酸钙 |
| Ka1=5.0×10-2 Ka2=5.4×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ksp=4.0×10-8 | Ksp=2.5×10-9 |
(1)写出
 水解的离子方程式
水解的离子方程式(2)相同条件下物质的量浓度都为0.01mol/LNa2C2O4溶液的pH比NaHCO3溶液的pH
(3)常温下将0.2mol/L的KOH溶液10mL与0.1mol/L的草酸溶液10mL混合,混合后溶液中阴离子浓度由大到小顺序为
(4)25℃时,向20mL碳酸钙的饱和溶液中逐滴加入amol/L的草酸钾溶液10mL后,有草酸钙沉淀生成,则a的最小值为
(5)为了测定草酸晶体H2C2O4·xH2O中的x值,某实验小组进行实验,步骤如下:
①称取1.260g草酸晶体,配成100mL溶液。
②取25.00mL该H2C2O4溶液加入锥形瓶内,再加入适量稀硫酸。
③用浓度为0.1000mol/L的KMnO4溶液滴定至终点。重复上述操作2次,滴定结果如表所示:
| 实验序号 | V(KMnO4溶液) | |
| 滴定前刻度/mL | 滴定后刻度/mL | |
| 1 | 0.50 | 10.00 |
| 2 | 1.10 | 11.10 |
| 3 | 1.50 | 11.50 |
①滴定过程中,盛装KMnO4溶液的仪器为
②滴定终点的现象为
③已知反应:5H2C2O4+2
 +6H+=10CO2↑+2Mn2++8H2O。根据数据,计算x=
+6H+=10CO2↑+2Mn2++8H2O。根据数据,计算x=④若滴定终点读数俯视KMnO4溶液液面,则x值会
您最近一年使用:0次
6 . (1)已知25 ℃时,0.1 L 0.1mol·L-1的NaA溶液的pH=11,则向NaA溶液中滴加酚酞,现象为:______ ;产生该现象的原因(用离子方程式表示)______ 。溶液中各离子的物质的量浓度由大到小的顺序为:______
(2)已知:Ksp(CuS)=1.0×10-36。常温下,向10.0mL 0.20mol·L-1CuCl2溶液中逐滴滴加0.1mol·L-1Na2S溶液,当混和溶液中c(Cu2+)=1.0×10-4mol·L-1时,混和溶液中c(S2-)=______ 。
(3)已知Ka(HA)=1.0×10-6,Ka(HB)=1.0×10-8。则HA电离常数的表达式为______ ;用pH相同的HA和HB分别中和相同物质的量的NaOH溶液,则消耗酸的体积HA______ HB(填=、<、>)。
(2)已知:Ksp(CuS)=1.0×10-36。常温下,向10.0mL 0.20mol·L-1CuCl2溶液中逐滴滴加0.1mol·L-1Na2S溶液,当混和溶液中c(Cu2+)=1.0×10-4mol·L-1时,混和溶液中c(S2-)=
(3)已知Ka(HA)=1.0×10-6,Ka(HB)=1.0×10-8。则HA电离常数的表达式为
您最近一年使用:0次
解题方法
7 . 弱电解质的电离平衡、盐类的水解平衡和难溶物的沉淀溶解平衡均属于化学平衡。
I.已知 在水中存在以下平衡:
在水中存在以下平衡: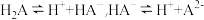 。
。
(1)常温下, 溶液的
溶液的
______ (填字母序号),原因是______ (填离子方程式)。
A.大于7 B.小于7 C.等于7 D.无法确定
(2)常温下,若向 的
的 溶液中逐滴滴加
溶液中逐滴滴加
 溶液至溶液呈中性。此时该混合溶液中的下列关系一定正确的是
溶液至溶液呈中性。此时该混合溶液中的下列关系一定正确的是______ (填字母序号)。
A.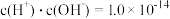 B.
B.
C.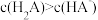 D.
D.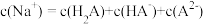
(3)常温下, 的饱和溶液中存在以下平衡:
的饱和溶液中存在以下平衡: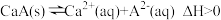 ,若要使该溶液中
,若要使该溶液中 浓度增大,可采取的措施有
浓度增大,可采取的措施有______ (填字母序号)。
A.升高温度 B.降低温度 C.加入少量蒸馏水 D.加入 固体
固体
Ⅱ.化学沉淀法是除去酸性废水中 的主要方法。根据其原理不同可以分为氢氧化物沉淀法、硫化物沉淀法等。水样中各形态铅的百分含量X与溶液
的主要方法。根据其原理不同可以分为氢氧化物沉淀法、硫化物沉淀法等。水样中各形态铅的百分含量X与溶液 变化的关系如图所示。向含
变化的关系如图所示。向含 的溶液中逐滴滴加
的溶液中逐滴滴加 溶液,溶液变浑浊,继续滴加
溶液,溶液变浑浊,继续滴加 溶液又变澄清。
溶液又变澄清。
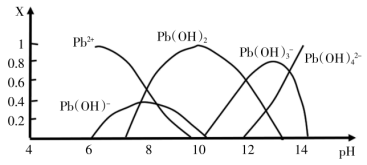
(4)若采用氢氧化物沉淀法除溶液中的 ,应将溶液的
,应将溶液的 调至约为
调至约为______ ; 时,溶液中发生的主要离子方程式为
时,溶液中发生的主要离子方程式为______ 。
(5)向酸性含铅废水中加 可将
可将 转化为
转化为 沉淀除去。若某工厂处理过的废水中
沉淀除去。若某工厂处理过的废水中 浓度为
浓度为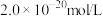 ,则
,则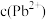 为
为______ 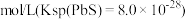 。
。
I.已知
 在水中存在以下平衡:
在水中存在以下平衡: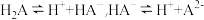 。
。(1)常温下,
 溶液的
溶液的
A.大于7 B.小于7 C.等于7 D.无法确定
(2)常温下,若向
 的
的 溶液中逐滴滴加
溶液中逐滴滴加
 溶液至溶液呈中性。此时该混合溶液中的下列关系一定正确的是
溶液至溶液呈中性。此时该混合溶液中的下列关系一定正确的是A.
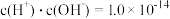 B.
B.
C.
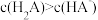 D.
D.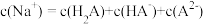
(3)常温下,
 的饱和溶液中存在以下平衡:
的饱和溶液中存在以下平衡: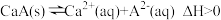 ,若要使该溶液中
,若要使该溶液中 浓度增大,可采取的措施有
浓度增大,可采取的措施有A.升高温度 B.降低温度 C.加入少量蒸馏水 D.加入
 固体
固体Ⅱ.化学沉淀法是除去酸性废水中
 的主要方法。根据其原理不同可以分为氢氧化物沉淀法、硫化物沉淀法等。水样中各形态铅的百分含量X与溶液
的主要方法。根据其原理不同可以分为氢氧化物沉淀法、硫化物沉淀法等。水样中各形态铅的百分含量X与溶液 变化的关系如图所示。向含
变化的关系如图所示。向含 的溶液中逐滴滴加
的溶液中逐滴滴加 溶液,溶液变浑浊,继续滴加
溶液,溶液变浑浊,继续滴加 溶液又变澄清。
溶液又变澄清。
(4)若采用氢氧化物沉淀法除溶液中的
 ,应将溶液的
,应将溶液的 调至约为
调至约为 时,溶液中发生的主要离子方程式为
时,溶液中发生的主要离子方程式为(5)向酸性含铅废水中加
 可将
可将 转化为
转化为 沉淀除去。若某工厂处理过的废水中
沉淀除去。若某工厂处理过的废水中 浓度为
浓度为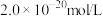 ,则
,则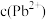 为
为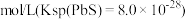 。
。
您最近一年使用:0次
2021-01-30更新
|
398次组卷
|
2卷引用:湖南省怀化市2020-2021学年高二上学期期末考试化学试题
解题方法
8 . 根据所学知识回答下列问题:
(1)0.1 mol·L-1的KAl(SO4)2溶液中各离子的浓度由大到小的顺序为______________ 。
(2)已知:常温时,亚硫酸的电离平衡常数Ka1=1.23×10-2,Ka2=5.60×10-8,则0.1 mol·L-1的NaHSO3溶液显_______ (填“酸”、“中”或“碱”)性,请用相应的数据及文字说明:______________ 。
(3)实验室用FeCl3(s)配制FeCl3溶液的操作为_______ ,若将FeCl3溶液蒸干并灼烧至恒重,得到的物质为_______ (填化学式)。
(4)25℃时,将足量氯化银分别放入下列4种溶液中,充分搅拌后,银离子浓度由大到小的顺序是_______ (填标号);②中氯离子的浓度为_______ mol·L-1.(氯化银的Ksp=1.8×10-10)
①100 mL蒸馏水 ②100 mL 0.2 mol·L-1 AgNO3溶液
③100 mL 0.1 mol·L-1 氯化铝溶液 ④100 mL 0.1 mol·L-1盐酸
(1)0.1 mol·L-1的KAl(SO4)2溶液中各离子的浓度由大到小的顺序为
(2)已知:常温时,亚硫酸的电离平衡常数Ka1=1.23×10-2,Ka2=5.60×10-8,则0.1 mol·L-1的NaHSO3溶液显
(3)实验室用FeCl3(s)配制FeCl3溶液的操作为
(4)25℃时,将足量氯化银分别放入下列4种溶液中,充分搅拌后,银离子浓度由大到小的顺序是
①100 mL蒸馏水 ②100 mL 0.2 mol·L-1 AgNO3溶液
③100 mL 0.1 mol·L-1 氯化铝溶液 ④100 mL 0.1 mol·L-1盐酸
您最近一年使用:0次
解题方法
9 . 依据所学知识回答问题:
(1)0.1 mol·L-1的KAl(SO4)2溶液中各离子的浓度由大到小的顺序为_______ 。
(2)液态SO2是一种似水溶剂,可以微弱电离:SO2+SO2 SO2++SO
SO2++SO 在液态SO2中,视SOCl2为酸,Cs2SO3为碱,试写出二者在液态SO2体系中发生反应的化学方程式:
在液态SO2中,视SOCl2为酸,Cs2SO3为碱,试写出二者在液态SO2体系中发生反应的化学方程式:_______ 。
(3)盐类水解的实质就是盐产生的阴阳离子与水电离出的H+或OH-结合的过程,下列物质与水反应和盐类水解类似,写出相应的化学方程式:
Mg3N2与水反应:_______ ;
PCl5与热水反应:_______ 。
(4)常温下,BaCO3(s)在水中的溶解平衡曲线如图所示,则该温度下,Ksp(BaCO3)=_______ ;将0.2 mol·L-1的Ba(OH)2溶液与0.2 mol·L-1的NaHCO3溶液等体积混合后,混合溶液的pH=_______ ,c(CO )=
)=_______ 。(忽略混合时溶液体积的变化)

(1)0.1 mol·L-1的KAl(SO4)2溶液中各离子的浓度由大到小的顺序为
(2)液态SO2是一种似水溶剂,可以微弱电离:SO2+SO2
 SO2++SO
SO2++SO 在液态SO2中,视SOCl2为酸,Cs2SO3为碱,试写出二者在液态SO2体系中发生反应的化学方程式:
在液态SO2中,视SOCl2为酸,Cs2SO3为碱,试写出二者在液态SO2体系中发生反应的化学方程式:(3)盐类水解的实质就是盐产生的阴阳离子与水电离出的H+或OH-结合的过程,下列物质与水反应和盐类水解类似,写出相应的化学方程式:
Mg3N2与水反应:
PCl5与热水反应:
(4)常温下,BaCO3(s)在水中的溶解平衡曲线如图所示,则该温度下,Ksp(BaCO3)=
 )=
)=
您最近一年使用:0次
10 . 重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
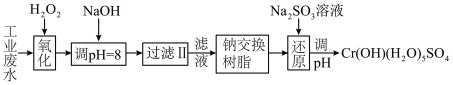
(Ⅰ)某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表。
(1)氧化过程中可代替H2O2加入的试剂是________ 。(填序号)
(2)已知钠离子交换树脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交换除去的杂质离子_________ (填序号)
(3)常温下,Cr(OH)3的溶度积Ksp=1.0×10-32溶液中pH应为________ 时Cr3+恰好完全沉淀,则还原过程中的离子方程式________________________ (已知在氧化过程中Cr3+转化为 )。
)。
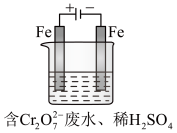
(Ⅱ)酸性条件下,铬元素主要以 形式存在,工业上常用电解法处理含
形式存在,工业上常用电解法处理含 的废水。实验室利用如图装置模拟处理该废水,阳极反应是
的废水。实验室利用如图装置模拟处理该废水,阳极反应是 ,阴极反应式是
,阴极反应式是 。
。
(1)电解时能否用Cu电极来代替Fe电极?________ (填“能”或“不能”)
(2)电解时阳极附近溶液中转化为Cr3+的离子方程式为________________________________ 。
(3)若溶液中初始含有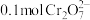 ,则生成的阳离子全部转化成沉淀的质量是
,则生成的阳离子全部转化成沉淀的质量是________ g。
(Ⅰ)某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:

注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表。
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 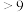 溶解 溶解 |
(1)氧化过程中可代替H2O2加入的试剂是
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)已知钠离子交换树脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交换除去的杂质离子
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)常温下,Cr(OH)3的溶度积Ksp=1.0×10-32溶液中pH应为
 )。
)。(Ⅱ)酸性条件下,铬元素主要以
 形式存在,工业上常用电解法处理含
形式存在,工业上常用电解法处理含 的废水。实验室利用如图装置模拟处理该废水,阳极反应是
的废水。实验室利用如图装置模拟处理该废水,阳极反应是 ,阴极反应式是
,阴极反应式是 。
。(1)电解时能否用Cu电极来代替Fe电极?
(2)电解时阳极附近溶液中转化为Cr3+的离子方程式为
(3)若溶液中初始含有
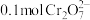 ,则生成的阳离子全部转化成沉淀的质量是
,则生成的阳离子全部转化成沉淀的质量是
您最近一年使用:0次



