1 . 已知K、Ka、KW、Ksp分别表示化学平衡常数、弱酸的电离平衡常数、水的离子积常数、难溶电解质的溶度积常数。
(1)有关上述常数的说法正确的是__ 。
a.它们都能反映一定条件下对应变化进行的程度
b.它们的大小都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
(2)25℃时将amol•L-1的氨水与0.01mol•L-1的盐酸等体积混合所得溶液中c(NH4+)=c(Cl-),则溶液显__ (填“酸”、“碱”或“中”)性;用含a的代数式表示NH3•H2O的电离平衡常数Kb=__ 。
(3)已知25℃时CH3COOH和NH3.H2O电离常数相等,则该温度下CH3COONH4溶液中水电离的H+浓度为__ ,溶液中离子浓度大小关系为__ 。
(4)25℃时,H2SO3=HSO3-+H+的电离常数Ka=1×10-2mol•L-1,则该温度下pH=3、c(HSO3-)=0.1mol•L-1的NaHSO3溶液中c(H2SO3)=__ 。
(5)已知常温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10-38、1.0×10-11,向浓度均为0.1mol/L的FeCl3、MgCl2的混合溶液中加入碱液,要使Fe3+完全沉淀而Mg2+不沉淀,应该调节溶液pH的范围是__ 。(已知lg2=0.3)
(1)有关上述常数的说法正确的是
a.它们都能反映一定条件下对应变化进行的程度
b.它们的大小都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
(2)25℃时将amol•L-1的氨水与0.01mol•L-1的盐酸等体积混合所得溶液中c(NH4+)=c(Cl-),则溶液显
(3)已知25℃时CH3COOH和NH3.H2O电离常数相等,则该温度下CH3COONH4溶液中水电离的H+浓度为
(4)25℃时,H2SO3=HSO3-+H+的电离常数Ka=1×10-2mol•L-1,则该温度下pH=3、c(HSO3-)=0.1mol•L-1的NaHSO3溶液中c(H2SO3)=
(5)已知常温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10-38、1.0×10-11,向浓度均为0.1mol/L的FeCl3、MgCl2的混合溶液中加入碱液,要使Fe3+完全沉淀而Mg2+不沉淀,应该调节溶液pH的范围是
您最近一年使用:0次
2019-12-19更新
|
101次组卷
|
2卷引用:湖南省长沙市明达中学2021-2022学年高二上学期12月月考化学试题
名校
2 . 电化学在我们的生产生活中占有越来越重要的地位。
(1)①燃料电池是一种绿色环保、高效的化学电源。上图为甲醇燃料电池,则负极反应式为____ 。
②用甲醇燃料电池电解300mL饱和食盐水,则电解的化学方程式为_________ 。电解一段时间后,当溶液的pH值为13时,消耗O2的质量为______ g。(忽略溶液体积变化,不考虑损耗)
③用甲醇燃料电池电解2L,1mol/L硫酸铜溶液,一段时间后:两极共收集到标准状况下的气体89.6L,则电路中共转移_______ mol电子。
(2)利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,模拟工业电解法来处理含Cr2O72-废水,如下图所示;电解过程中溶液发生反应:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
①甲池工作时,NO2转变成绿色硝化剂Y,Y是N2O5,可循环使用,则石墨Ⅱ附近发生的电极反应式为__ 。
②向完全还原为Cr3+的乙池工业废水中滴加NaOH溶液,可将铬以Cr(OH)3沉淀的形式除去,已知Cr(OH)3存在以下溶解平衡:Cr(OH)3(s) Cr3+(aq)+3OH-(aq),常温下Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH-)=1.0×10-32,要使c(Cr3+)降至10-5mol•L-1,溶液的pH应调至
Cr3+(aq)+3OH-(aq),常温下Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH-)=1.0×10-32,要使c(Cr3+)降至10-5mol•L-1,溶液的pH应调至________ 。
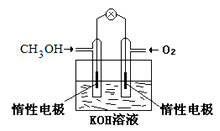
(1)①燃料电池是一种绿色环保、高效的化学电源。上图为甲醇燃料电池,则负极反应式为
②用甲醇燃料电池电解300mL饱和食盐水,则电解的化学方程式为
③用甲醇燃料电池电解2L,1mol/L硫酸铜溶液,一段时间后:两极共收集到标准状况下的气体89.6L,则电路中共转移
(2)利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,模拟工业电解法来处理含Cr2O72-废水,如下图所示;电解过程中溶液发生反应:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
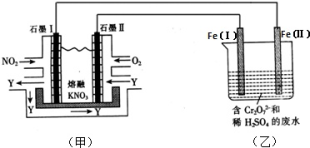
①甲池工作时,NO2转变成绿色硝化剂Y,Y是N2O5,可循环使用,则石墨Ⅱ附近发生的电极反应式为
②向完全还原为Cr3+的乙池工业废水中滴加NaOH溶液,可将铬以Cr(OH)3沉淀的形式除去,已知Cr(OH)3存在以下溶解平衡:Cr(OH)3(s)
 Cr3+(aq)+3OH-(aq),常温下Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH-)=1.0×10-32,要使c(Cr3+)降至10-5mol•L-1,溶液的pH应调至
Cr3+(aq)+3OH-(aq),常温下Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH-)=1.0×10-32,要使c(Cr3+)降至10-5mol•L-1,溶液的pH应调至
您最近一年使用:0次
名校
3 . 按要求回答下列问题
(1)常温下,H2SO3的电离常数Ka1=1.0×10-2、Ka2=1.0×10-7。NaHSO3的水解平衡常数Kh=________ ,其溶液pH________ (填“>”“<”或“=”)7;若向NaHSO3溶液中加入少量的I2(I2能氧化+4价的硫),则溶液中c(H2SO3)/c(HSO3-)将________ (填“增大”“减小”或“不变”)。
(2)已知25 ℃时,Ksp[Mg(OH)2]=1.8×10-11。25 ℃时,向0.01 mol·L-1的MgCl2溶液中逐滴加入浓NaOH溶液,刚好出现沉淀时,溶液的c(H+)为________ ;当Mg2+完全沉淀时,溶液的pH为________ 。(忽略溶液体积变化,已知
 ,lg 7.7=0.9)
,lg 7.7=0.9)
(3)量取10.00 mL密度为1.13 g·mL-1的H2O2溶液至烧杯中稀释,冷却后转移至250 mL容量瓶中,加水定容,摇匀。移取配制好的过氧化氢溶液25.00 mL至锥形瓶中,加入稀H2SO4酸化,用蒸馏水稀释,作被测试样。用KMnO4标准溶液滴定被测试样,重复滴定三次,平均耗用1 mol·L-1KMnO4标准溶液11.30 mL,则
①滴定到达终点的现象___________________________________________
②原H2O2溶液中H2O2的质量分数为________ 。
(1)常温下,H2SO3的电离常数Ka1=1.0×10-2、Ka2=1.0×10-7。NaHSO3的水解平衡常数Kh=
(2)已知25 ℃时,Ksp[Mg(OH)2]=1.8×10-11。25 ℃时,向0.01 mol·L-1的MgCl2溶液中逐滴加入浓NaOH溶液,刚好出现沉淀时,溶液的c(H+)为

 ,lg 7.7=0.9)
,lg 7.7=0.9)(3)量取10.00 mL密度为1.13 g·mL-1的H2O2溶液至烧杯中稀释,冷却后转移至250 mL容量瓶中,加水定容,摇匀。移取配制好的过氧化氢溶液25.00 mL至锥形瓶中,加入稀H2SO4酸化,用蒸馏水稀释,作被测试样。用KMnO4标准溶液滴定被测试样,重复滴定三次,平均耗用1 mol·L-1KMnO4标准溶液11.30 mL,则
①滴定到达终点的现象
②原H2O2溶液中H2O2的质量分数为
您最近一年使用:0次
名校
解题方法
4 . CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:
(1)CO2可以被NaOH溶液捕获。常温下,若所得溶液pH=13,CO2主要转化为________ (写离子符号);若所得溶液c(HCO3-)∶c(CO32-)=2∶1,溶液pH=__________ 。(室温下,H2CO3的K1=4×10-7;K2=5×10-11)
(2)已知25℃,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0 mol·L-1,溶液中的c(OH-)=________________ mol·L-1。将SO2通入该氨水中,当c(OH-)降至1.0×10-7mol·L-1时,溶液中的c(SO32-)/c(HSO3-)=__________________ 。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl-,利用Ag+与CrO 生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5mol·L-1)时,溶液中c(Ag+)为
生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5mol·L-1)时,溶液中c(Ag+)为________ mol·L-1,此时溶液中c(CrO )等于
)等于__________ mol·L-1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)。
(1)CO2可以被NaOH溶液捕获。常温下,若所得溶液pH=13,CO2主要转化为
(2)已知25℃,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0 mol·L-1,溶液中的c(OH-)=
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl-,利用Ag+与CrO
 生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5mol·L-1)时,溶液中c(Ag+)为
生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5mol·L-1)时,溶液中c(Ag+)为 )等于
)等于
您最近一年使用:0次
解题方法
5 . 弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
(1)已知H2A在水中存在以下平衡:H2A H++HA-,HA-
H++HA-,HA- H++A2-。
H++A2-。
①NaHA溶液__________ (选填“显酸性”、“显碱性”、“显中性”或“无法确定”)。
②某温度下,0.1 mol/L的NaHA溶液,下列关系中,一定 正确的是___________ 。
A.c(H+)·c(OH-)=1×10―14 B.c(Na+)+c(H+)=c(HA-)+2c(A2-)
C.c(Na+)>c(HA-)>c(A2-)>c(H2A) D.c(Na+)=c(HA-)+c(A2-)+c(H2A)
③常温下,pH=3的H2A溶液中由水电离出的c(H+)=________________ mol/L
(2)已知常温下,H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s) Ca2+(aq)+A2-(aq) △H>0。
Ca2+(aq)+A2-(aq) △H>0。
①降低温度时,Ksp_______ (填“增大”、“减小”或“不变”,下同)。
②滴加少量浓盐酸,c(Ca2+)__________ 。
③测得25℃时,CaA的Ksp为2.0×10-11,常温下将10 g CaA固体投入100 mL CaCl2溶液中,充分搅拌后仍有固体剩余,测得溶液中c(Ca2+)=0.1 mol/L,则溶液中c(A2-)=_________ mol/L
(1)已知H2A在水中存在以下平衡:H2A
 H++HA-,HA-
H++HA-,HA- H++A2-。
H++A2-。①NaHA溶液
②某温度下,0.1 mol/L的NaHA溶液,下列关系中,
A.c(H+)·c(OH-)=1×10―14 B.c(Na+)+c(H+)=c(HA-)+2c(A2-)
C.c(Na+)>c(HA-)>c(A2-)>c(H2A) D.c(Na+)=c(HA-)+c(A2-)+c(H2A)
③常温下,pH=3的H2A溶液中由水电离出的c(H+)=
(2)已知常温下,H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s)
 Ca2+(aq)+A2-(aq) △H>0。
Ca2+(aq)+A2-(aq) △H>0。①降低温度时,Ksp
②滴加少量浓盐酸,c(Ca2+)
③测得25℃时,CaA的Ksp为2.0×10-11,常温下将10 g CaA固体投入100 mL CaCl2溶液中,充分搅拌后仍有固体剩余,测得溶液中c(Ca2+)=0.1 mol/L,则溶液中c(A2-)=
您最近一年使用:0次
名校
解题方法
6 . (1)H3PO2是一元中强酸,写出其电离方程式_______________________________ 。NaH2PO2为__________ (填“正盐”或“酸式盐”),其溶液显__________ (填“弱酸性”、“中性”或“弱碱性”)
(2)下表列出了某冷轧厂排放的废水中各成分的含量及国家环保标准值的有关数据:
经某一工艺处理后的废水pH=8,常温下,该废水中Zn2+的浓度为__________ mg·L-1(常温下, Ksp[Zn(OH)2]=1.2×10-17),__________ (填“符合”或“不符合”)国家环保标准。
(2)下表列出了某冷轧厂排放的废水中各成分的含量及国家环保标准值的有关数据:
| 冷轧含锌废水水质 | 经处理后的水国家环保标准值 | |
| Zn2+浓度/(mg·L-1) | ≤800 | ≤3.9 |
| pH | 1~5 | 6~9 |
| SO42-浓度/(mg·L-1) | ≤23 000 | ≤150 |
您最近一年使用:0次
7 . (1)25℃时,M(OH)2的Ksp=4.0×10-12 ,求饱和溶液中的c(H+)___________ 。
(2)把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是_______________________ 。
(3)830 K时,已知可逆反应CO(g)+H2O(g) CO2(g)+H2(g)。若起始时c(CO)=2 mol/L,c(H2O)= 3 mol/L,平衡时CO的转化率为60%,则平衡时K值为
CO2(g)+H2(g)。若起始时c(CO)=2 mol/L,c(H2O)= 3 mol/L,平衡时CO的转化率为60%,则平衡时K值为_____________ 。
(2)把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是
(3)830 K时,已知可逆反应CO(g)+H2O(g)
 CO2(g)+H2(g)。若起始时c(CO)=2 mol/L,c(H2O)= 3 mol/L,平衡时CO的转化率为60%,则平衡时K值为
CO2(g)+H2(g)。若起始时c(CO)=2 mol/L,c(H2O)= 3 mol/L,平衡时CO的转化率为60%,则平衡时K值为
您最近一年使用:0次
名校
解题方法
8 . (1)NaF 的水溶液呈__ (填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):_____ ,溶液中含有的各离子浓度从大到小的顺序为______ 。
(2)AlCl3 水溶液呈__ (填“酸”、“中”、“碱”)性,把 AlCl3 溶液蒸干,灼烧,最后得到的主要固体产物是 ______ 。
(3)CaCl2 溶液与 Na2CO3 溶液混合可形成 CaCO3 沉淀,现将 4×10-4mol/L Na2CO3 溶液与某浓度的 CaCl2溶液等体积混合,则生成沉淀所需 CaCl2 溶液的最小浓度为__ mol·L-1(已知:KSP(CaCO3)=2.8×10-9)
(2)AlCl3 水溶液呈
(3)CaCl2 溶液与 Na2CO3 溶液混合可形成 CaCO3 沉淀,现将 4×10-4mol/L Na2CO3 溶液与某浓度的 CaCl2溶液等体积混合,则生成沉淀所需 CaCl2 溶液的最小浓度为
您最近一年使用:0次
名校
9 . 连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。
(1)连二次硝酸中氮元素的化合价为_________________ 。
(2)常温下,用0.01mol • L-1的NaOH溶液滴定10mL 0.01mol·L-1的H2N2O2溶液,测得溶液的pH与NaOH溶液体积的关系如图所示。

①写出H2N2O2在水溶液中的电离方程式:____________________ 。
②b点时溶液中c(H2N2O2)_________ c(N2O22-) 。(填“>”“ <”或“=”下同)
③a点时溶液中c(Na+)_________ c(HN2O2-)+c(N2O22-)。
(3)向10mL 0.1mol/L的硝酸银溶液中滴加等浓度的连二次硝酸钠溶液,要使Ag完全沉淀[c(Ag+)小于10-5 mol/L],至少需要连二次硝酸钠溶液___________ mL。[已知Ksp(Ag2N2O2)=4.0×10-12]
(1)连二次硝酸中氮元素的化合价为
(2)常温下,用0.01mol • L-1的NaOH溶液滴定10mL 0.01mol·L-1的H2N2O2溶液,测得溶液的pH与NaOH溶液体积的关系如图所示。

①写出H2N2O2在水溶液中的电离方程式:
②b点时溶液中c(H2N2O2)
③a点时溶液中c(Na+)
(3)向10mL 0.1mol/L的硝酸银溶液中滴加等浓度的连二次硝酸钠溶液,要使Ag完全沉淀[c(Ag+)小于10-5 mol/L],至少需要连二次硝酸钠溶液
您最近一年使用:0次
名校
10 . (1)AgNO3的水溶液呈________ (填“酸”、“中”、“碱”)性,实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以____ (填“促进”、“抑制”)其水解。
(2)已知难溶电解质A的化学式为XnYm,相对分子质量为M,测得其饱和溶液的密度为ρ g/cm3,Xm+的浓度为c mol/L,则该难溶物XnYm的溶度积常数为Ksp=________ 。
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈_____ (填“酸”、“中”、“碱”)性,混合时醋酸体积________ (填“大于”、“等于”或“小于”)氢氧化钠溶液体积。
(2)已知难溶电解质A的化学式为XnYm,相对分子质量为M,测得其饱和溶液的密度为ρ g/cm3,Xm+的浓度为c mol/L,则该难溶物XnYm的溶度积常数为Ksp=
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈
您最近一年使用:0次
2017-11-17更新
|
229次组卷
|
2卷引用:湖南省醴陵二中、醴陵四中2017-2018学年高二上学期期中联考化学试题



