1 . 弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。回答下列问题:
(1)已知 在水中存在以下平衡:
在水中存在以下平衡: ,
, ,
, 溶液显
溶液显_______ (填“酸性”、“碱性”、“中性”);等体积等物质的量浓度的 和
和 溶液混合后,所得溶液中离子浓度由大到小顺序是
溶液混合后,所得溶液中离子浓度由大到小顺序是_______ 。
(2) 时,次氯酸的
时,次氯酸的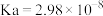 ;亚硫酸的
;亚硫酸的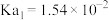 、
、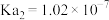 。将少量的
。将少量的 通入
通入 溶液中反应的离子方程式为
溶液中反应的离子方程式为_______ 。
(3)常温下,向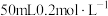 的氨水中逐滴加入
的氨水中逐滴加入 的盐酸,所得溶液的
的盐酸,所得溶液的 、溶液中
、溶液中 和
和 的物质的量分数与加入盐酸的体积的关系如下图所示。
的物质的量分数与加入盐酸的体积的关系如下图所示。

① 的电离常数为
的电离常数为_______ 。
②当加入盐酸的体积为 时,溶液中
时,溶液中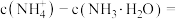
_______  (用计算式表示)。
(用计算式表示)。
(4) 溶液与
溶液与 溶液反应会生成
溶液反应会生成 沉淀。已知:常温下
沉淀。已知:常温下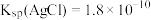 ,
, ,则
,则 转化为
转化为 的平衡常数
的平衡常数
_______ 。
(1)已知
 在水中存在以下平衡:
在水中存在以下平衡: ,
, ,
, 溶液显
溶液显 和
和 溶液混合后,所得溶液中离子浓度由大到小顺序是
溶液混合后,所得溶液中离子浓度由大到小顺序是(2)
 时,次氯酸的
时,次氯酸的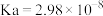 ;亚硫酸的
;亚硫酸的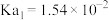 、
、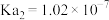 。将少量的
。将少量的 通入
通入 溶液中反应的离子方程式为
溶液中反应的离子方程式为(3)常温下,向
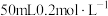 的氨水中逐滴加入
的氨水中逐滴加入 的盐酸,所得溶液的
的盐酸,所得溶液的 、溶液中
、溶液中 和
和 的物质的量分数与加入盐酸的体积的关系如下图所示。
的物质的量分数与加入盐酸的体积的关系如下图所示。
①
 的电离常数为
的电离常数为②当加入盐酸的体积为
 时,溶液中
时,溶液中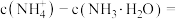
 (用计算式表示)。
(用计算式表示)。(4)
 溶液与
溶液与 溶液反应会生成
溶液反应会生成 沉淀。已知:常温下
沉淀。已知:常温下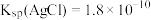 ,
, ,则
,则 转化为
转化为 的平衡常数
的平衡常数
您最近一年使用:0次
名校
2 . 常温下,某小组同学用如下装置探究 的沉淀溶解平衡。
的沉淀溶解平衡。
Ⅰ.实验①测得电导率随时间变化的曲线如图l所示。
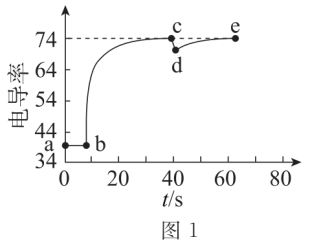
已知:ⅰ.在稀溶液中,离子浓度越大,电导率越大。
(1)a点电导率不等于0的原因是水能发生_______ 。
(2)由图1可知,在 悬浊液中加入少量水的时刻为
悬浊液中加入少量水的时刻为_______ (填“b”、“c”或“d”)点。
(3)分析电导率在de段逐渐上升的原因:d时刻,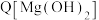
_______ (填“>”、“<”或“=”)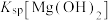 ,导致
,导致_______ (结合沉淀溶解平衡解释原因)。
Ⅱ.实验②测得pH随时间变化的曲线如图2所示。

已知:ⅱ.25℃,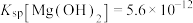
ⅲ.酚酞的变色范围:
(4)依据图2可判断:A点加入的 的物质的量大于C点加入的硫酸的物质的量,判据是
的物质的量大于C点加入的硫酸的物质的量,判据是_______ 。
(5)0~300s时,实验②中溶液先变红,后_______ 。
(6) 常被用于水质改良剂,能够使水体pH约为9,进而抑制细菌的生长。25℃时水体中
常被用于水质改良剂,能够使水体pH约为9,进而抑制细菌的生长。25℃时水体中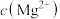 约为
约为_______  。
。
 的沉淀溶解平衡。
的沉淀溶解平衡。| 实验装置 | 实验序号 | 传感器种类 | 实验操作 |
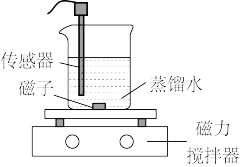 | ① | 电导率传感器 | 向蒸馏水中加入足量 粉末,一段时间后再加入少量蒸馏水 粉末,一段时间后再加入少量蒸馏水 |
| ② | pH传感器 | 向滴有酚酞的蒸馏水中加入 粉末,隔一段时间后,再向所得悬浊液中加入一定量稀硫酸 粉末,隔一段时间后,再向所得悬浊液中加入一定量稀硫酸 |

已知:ⅰ.在稀溶液中,离子浓度越大,电导率越大。
(1)a点电导率不等于0的原因是水能发生
(2)由图1可知,在
 悬浊液中加入少量水的时刻为
悬浊液中加入少量水的时刻为(3)分析电导率在de段逐渐上升的原因:d时刻,
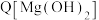
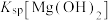 ,导致
,导致Ⅱ.实验②测得pH随时间变化的曲线如图2所示。

已知:ⅱ.25℃,
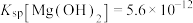
ⅲ.酚酞的变色范围:
| pH | <8.2 | 8.2~10 | >10 |
| 颜色 | 无色 | 淡粉色 | 红色 |
 的物质的量大于C点加入的硫酸的物质的量,判据是
的物质的量大于C点加入的硫酸的物质的量,判据是(5)0~300s时,实验②中溶液先变红,后
(6)
 常被用于水质改良剂,能够使水体pH约为9,进而抑制细菌的生长。25℃时水体中
常被用于水质改良剂,能够使水体pH约为9,进而抑制细菌的生长。25℃时水体中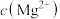 约为
约为 。
。
您最近一年使用:0次
2023-01-05更新
|
426次组卷
|
10卷引用:湖南省长沙市实验中学2023-2024学年高二上学期期中考试化学试题
湖南省长沙市实验中学2023-2024学年高二上学期期中考试化学试题湖南省长沙市长沙县实验中学2023-2024学年高二上学期期中考试化学试卷北京市东城区2022-2023学年高二上学期期末统一检测化学试卷(已下线)第15讲 沉淀溶解平衡-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)北京市清华大学附属中学朝阳学校2023-2024学年高二上学期期中考试化学试题北京市第三十五中学2023-2024学年高二上学期期中考试化学试题 北京市第三中学2023-2024学年高二上学期期中练习化学试题北京市第十三中学2023-2024学年高二上学期期中考试化学试题北京市第五十中学2023-2024学年高二上学期12月月考化学试题北京市2023-2024学年北京三中高二(上)期中化学试卷
名校
解题方法
3 . 氮和硫的化合物在工农业生产、生活中具有重要应用。请回答下列问题:
(1)航天领域中常用 作为火箭发射的助燃剂。
作为火箭发射的助燃剂。 与氨气相似,是一种碱性气体,易溶于水,生成弱碱
与氨气相似,是一种碱性气体,易溶于水,生成弱碱 。用电离方程式表示
。用电离方程式表示 显碱性的原因
显碱性的原因_______ 。
(2)亚硝酸的电离平衡常数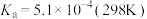 。它的性质和硝酸很类似。
。它的性质和硝酸很类似。
①已知 时,
时, 的
的 ;
; 。向含有
。向含有 碳酸钠的溶液中加入
碳酸钠的溶液中加入 的
的 后,则溶液中
后,则溶液中 、
、 和
和 的离子浓度由大到小是
的离子浓度由大到小是_______ 。
②将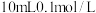 的亚硝酸溶液加入到
的亚硝酸溶液加入到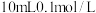 氨水(已知在25℃时,一水合氨的
氨水(已知在25℃时,一水合氨的 )中,最后所得溶液为
)中,最后所得溶液为_______ (填“酸性”、“碱性”或者“中性”)。
(3) 气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在
气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在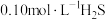 溶液中,通入
溶液中,通入 气体或加入
气体或加入 固体以调节溶液
固体以调节溶液 ,溶液
,溶液 与
与 关系如图所示(忽略溶液体积的变化、
关系如图所示(忽略溶液体积的变化、 的挥发)。
的挥发)。
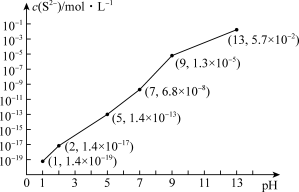
① 时,溶液中的
时,溶液中的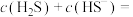
_______  ;
;
②某溶液含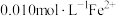 和
和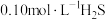 ,当溶液
,当溶液
_______ 时, 开始沉淀。[已知:
开始沉淀。[已知: ]
]
(4) 可用作处理含
可用作处理含 的污水的沉淀剂,已知25℃时,反应
的污水的沉淀剂,已知25℃时,反应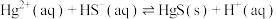 的平衡常数
的平衡常数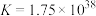 ,
, 的电离平衡常数
的电离平衡常数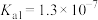 ,
,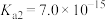 ,则
,则
_______ 。
(1)航天领域中常用
 作为火箭发射的助燃剂。
作为火箭发射的助燃剂。 与氨气相似,是一种碱性气体,易溶于水,生成弱碱
与氨气相似,是一种碱性气体,易溶于水,生成弱碱 。用电离方程式表示
。用电离方程式表示 显碱性的原因
显碱性的原因(2)亚硝酸的电离平衡常数
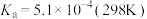 。它的性质和硝酸很类似。
。它的性质和硝酸很类似。①已知
 时,
时, 的
的 ;
; 。向含有
。向含有 碳酸钠的溶液中加入
碳酸钠的溶液中加入 的
的 后,则溶液中
后,则溶液中 、
、 和
和 的离子浓度由大到小是
的离子浓度由大到小是②将
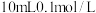 的亚硝酸溶液加入到
的亚硝酸溶液加入到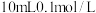 氨水(已知在25℃时,一水合氨的
氨水(已知在25℃时,一水合氨的 )中,最后所得溶液为
)中,最后所得溶液为(3)
 气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在
气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在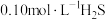 溶液中,通入
溶液中,通入 气体或加入
气体或加入 固体以调节溶液
固体以调节溶液 ,溶液
,溶液 与
与 关系如图所示(忽略溶液体积的变化、
关系如图所示(忽略溶液体积的变化、 的挥发)。
的挥发)。
①
 时,溶液中的
时,溶液中的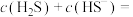
 ;
;②某溶液含
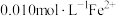 和
和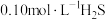 ,当溶液
,当溶液
 开始沉淀。[已知:
开始沉淀。[已知: ]
](4)
 可用作处理含
可用作处理含 的污水的沉淀剂,已知25℃时,反应
的污水的沉淀剂,已知25℃时,反应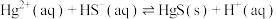 的平衡常数
的平衡常数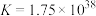 ,
, 的电离平衡常数
的电离平衡常数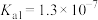 ,
,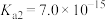 ,则
,则
您最近一年使用:0次
2022-12-12更新
|
133次组卷
|
2卷引用:湖南省岳阳教研联盟2022-2023学年高二上学期期中联考化学试题
4 . 下列有关水溶液中的平衡相关的问题,请填空。
(1)泡沫灭火器是将Al2(SO4)3溶液和NaHCO3溶液混合,有白色沉淀产生同时释放出CO2,写出反应离子方程式_______
(2)保存FeCl3溶液时需要稍微多加点盐酸,原因是_______ (用离子方程式说明)
(3)NaClO溶液显碱性的原因是_______ (用离子方程式说明)
常温时pH=10的NaClO溶液中c(Na+)-c(ClO-)=_______ (列出数值计算表达式)mol·L-1。
(4)25℃时,三种弱酸的电离平衡常数如表所示:
①少量CO2通入NaClO溶液中反应的离子方程式_______
②在某CH3COOH和CH3COONa的混合液中,当 =
= 时,溶液的pH=
时,溶液的pH= _______
③下列离子①CO ②HCO
②HCO ③ClO-④CH3COO-结合质子能力由强到弱的顺序为
③ClO-④CH3COO-结合质子能力由强到弱的顺序为_______
(5)已知25℃时,Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17.取一定量含有I-、Cl-的溶液向其中滴加AgNO3溶液,当AgCl和AgI同时沉淀时,溶液中 为
为_______ (保留有效数字2位)
(1)泡沫灭火器是将Al2(SO4)3溶液和NaHCO3溶液混合,有白色沉淀产生同时释放出CO2,写出反应离子方程式
(2)保存FeCl3溶液时需要稍微多加点盐酸,原因是
(3)NaClO溶液显碱性的原因是
常温时pH=10的NaClO溶液中c(Na+)-c(ClO-)=
(4)25℃时,三种弱酸的电离平衡常数如表所示:
| 分子式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
②在某CH3COOH和CH3COONa的混合液中,当
 =
= 时,溶液的pH=
时,溶液的pH= ③下列离子①CO
 ②HCO
②HCO ③ClO-④CH3COO-结合质子能力由强到弱的顺序为
③ClO-④CH3COO-结合质子能力由强到弱的顺序为(5)已知25℃时,Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17.取一定量含有I-、Cl-的溶液向其中滴加AgNO3溶液,当AgCl和AgI同时沉淀时,溶液中
 为
为
您最近一年使用:0次
2022-12-11更新
|
210次组卷
|
2卷引用:湖南省长沙市德成学校2023-2024学年高二上学期1月期末化学试题
5 . 回答下列问题
(1)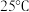 时,
时, 的电离平衡常数为:
的电离平衡常数为: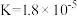 ,
, 的电离平衡常数为:
的电离平衡常数为: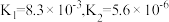 ;则:
;则:
①写出 的电离方程式:
的电离方程式:_______
②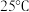 时,
时,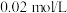 的
的 溶液的电离度约为
溶液的电离度约为_______  。
。
③往 溶液中滴加足量
溶液中滴加足量 溶液的离子反应方程式为:
溶液的离子反应方程式为:_______
(2)①某课外活动小组为了探究 的溶解度,分别将足量
的溶解度,分别将足量 加入下列物质中:
加入下列物质中:
a.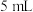 水 b.
水 b.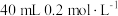 的
的 溶液
溶液
c.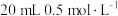 的
的 溶液 d.
溶液 d.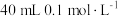 的
的 溶液中
溶液中
溶解 后形成的溶液中,
后形成的溶液中, 的浓度由大到小的顺序为
的浓度由大到小的顺序为_______ (填字母)。
A.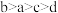 B.
B.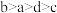 C.
C.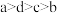 D.
D.
②已知 时,
时,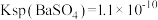 ,此时,溶液b中加入
,此时,溶液b中加入 后,
后, 为
为_______  。
。
(3)新型高效的乙烷燃料电池采用铂为电极材料,两电极上分别通入 和
和 ,电解质溶液为
,电解质溶液为 溶液。请写出乙烷燃料电池的负极反应式:
溶液。请写出乙烷燃料电池的负极反应式:_______ 。
(1)
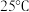 时,
时, 的电离平衡常数为:
的电离平衡常数为: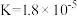 ,
, 的电离平衡常数为:
的电离平衡常数为: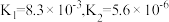 ;则:
;则:①写出
 的电离方程式:
的电离方程式:②
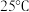 时,
时,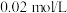 的
的 溶液的电离度约为
溶液的电离度约为 。
。③往
 溶液中滴加足量
溶液中滴加足量 溶液的离子反应方程式为:
溶液的离子反应方程式为:(2)①某课外活动小组为了探究
 的溶解度,分别将足量
的溶解度,分别将足量 加入下列物质中:
加入下列物质中:a.
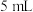 水 b.
水 b.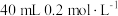 的
的 溶液
溶液c.
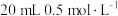 的
的 溶液 d.
溶液 d.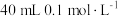 的
的 溶液中
溶液中溶解
 后形成的溶液中,
后形成的溶液中, 的浓度由大到小的顺序为
的浓度由大到小的顺序为A.
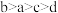 B.
B.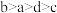 C.
C.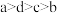 D.
D.
②已知
 时,
时,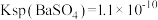 ,此时,溶液b中加入
,此时,溶液b中加入 后,
后, 为
为 。
。(3)新型高效的乙烷燃料电池采用铂为电极材料,两电极上分别通入
 和
和 ,电解质溶液为
,电解质溶液为 溶液。请写出乙烷燃料电池的负极反应式:
溶液。请写出乙烷燃料电池的负极反应式:
您最近一年使用:0次
名校
解题方法
6 . 工业上两次转化法从天青石矿(主要成分 ,含有
,含有 等杂质)制备高纯碳酸锶。
等杂质)制备高纯碳酸锶。
(1)一次转化
①浸泡:用饱和碳酸钠溶液浸泡天青石矿粉,过滤得到粗品 。滤液中
。滤液中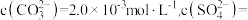
_________  。[已知:
。[已知: ]
]
②酸化:用稀盐酸浸泡粗品 ,加入一定量的催化剂氯化铵,得到含有杂质(
,加入一定量的催化剂氯化铵,得到含有杂质( )的
)的 粗溶液。该酸化过程可描述为
粗溶液。该酸化过程可描述为_________ (催化剂氯化铵参与了 与盐酸生成
与盐酸生成 的反应)。
的反应)。
③除杂。
ⅰ)除铁、铝:向 粗溶液中加入少量的
粗溶液中加入少量的 溶液,在
溶液,在 条件下加入少量的稀氨水,控制溶液
条件下加入少量的稀氨水,控制溶液 在
在_________ 范围内,充分搅拌,过滤。
已知:相关金属离子生成氢氧化物沉淀的 如下表所示,
如下表所示, 为7.8时
为7.8时 沉淀开始溶解。
沉淀开始溶解。
ⅱ)除钙:取ⅰ中滤液,逐滴加入适量稀 溶液。
溶液。
请补充完整去除 的后续实验操作:
的后续实验操作:_________ ,得到较纯净的 溶液。已知:
溶液。已知: 的溶解度随温度的升高而降低;
的溶解度随温度的升高而降低; 时,
时,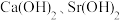 的溶解度分别为
的溶解度分别为 、
、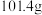 。
。
(2)二次转化。向 溶液中加入适量碳酸氢铵溶液,微热、过滤、洗涤得到高纯度
溶液中加入适量碳酸氢铵溶液,微热、过滤、洗涤得到高纯度 。
。
①写出沉淀过程中发生反应的化学方程式:_________ 。
②锶转化率随温度的变化如图所示。当反应温度大于 时,锶转化率急剧下降的原因是
时,锶转化率急剧下降的原因是_________ 。

 ,含有
,含有 等杂质)制备高纯碳酸锶。
等杂质)制备高纯碳酸锶。(1)一次转化
①浸泡:用饱和碳酸钠溶液浸泡天青石矿粉,过滤得到粗品
 。滤液中
。滤液中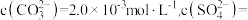
 。[已知:
。[已知: ]
]②酸化:用稀盐酸浸泡粗品
 ,加入一定量的催化剂氯化铵,得到含有杂质(
,加入一定量的催化剂氯化铵,得到含有杂质( )的
)的 粗溶液。该酸化过程可描述为
粗溶液。该酸化过程可描述为 与盐酸生成
与盐酸生成 的反应)。
的反应)。③除杂。
ⅰ)除铁、铝:向
 粗溶液中加入少量的
粗溶液中加入少量的 溶液,在
溶液,在 条件下加入少量的稀氨水,控制溶液
条件下加入少量的稀氨水,控制溶液 在
在已知:相关金属离子生成氢氧化物沉淀的
 如下表所示,
如下表所示, 为7.8时
为7.8时 沉淀开始溶解。
沉淀开始溶解。| 物质 |  |  |  |  | 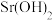 |
开始沉淀 | 1.9 | 7.0 | 3.4 | - | - |
完全沉淀 | 3.2 | 9.0 | 4.7 | 12 | - |
 溶液。
溶液。请补充完整去除
 的后续实验操作:
的后续实验操作: 溶液。已知:
溶液。已知: 的溶解度随温度的升高而降低;
的溶解度随温度的升高而降低; 时,
时,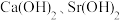 的溶解度分别为
的溶解度分别为 、
、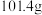 。
。(2)二次转化。向
 溶液中加入适量碳酸氢铵溶液,微热、过滤、洗涤得到高纯度
溶液中加入适量碳酸氢铵溶液,微热、过滤、洗涤得到高纯度 。
。①写出沉淀过程中发生反应的化学方程式:
②锶转化率随温度的变化如图所示。当反应温度大于
 时,锶转化率急剧下降的原因是
时,锶转化率急剧下降的原因是
您最近一年使用:0次
2022-11-12更新
|
593次组卷
|
4卷引用:湖南省株洲市攸县一中2022-2023学年高三第四次月考化学试题
7 . 常温下,几种物质的溶度积常数见下表:
(1)某酸性CuCl2溶液中含少量的FeCl3,为制得纯净的CuCl2溶液,宜加入_______ 调至溶液pH=4,使Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=_______ 。
(2)过滤后,将所得滤液经过_______ 、_______ 操作,可得到CuCl2·2H2O晶体。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.800 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液40.00 mL(已知:I2+2S2O =S4O
=S4O +2I-)。
+2I-)。
①可选用_______ 作指示剂,滴定终点的现象是_______ 。
②CuCl2溶液与KI反应的离子方程式为_______ 。
③该试样中CuCl2·2H2O的质量百分数为_______ 。
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(1)某酸性CuCl2溶液中含少量的FeCl3,为制得纯净的CuCl2溶液,宜加入
(2)过滤后,将所得滤液经过
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.800 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液40.00 mL(已知:I2+2S2O
 =S4O
=S4O +2I-)。
+2I-)。①可选用
②CuCl2溶液与KI反应的离子方程式为
③该试样中CuCl2·2H2O的质量百分数为
您最近一年使用:0次
2022-11-03更新
|
166次组卷
|
3卷引用:湖南省衡阳市第八中学2022-2023学年高二上学期期末考试化学试题
名校
解题方法
8 . 以软锰矿粉(含MnO2及少量Fe、Al、Si、Ca、Mg等的氧化物)为原料制备电池级MnO2。
(1)浸取。将一定量软锰矿粉与Na2SO3、H2SO4溶液中的一种配成悬浊液,加入到三颈瓶中(如图)。70℃下通过满液漏斗缓慢滴加另一种溶液,充分反应,过滤。滴液漏斗中的溶液是_______ ;MnO2转化为Mn2+的离子方程式为_______ 。

(2)除杂。向已经除去Fe、Al、Si的MnSO4溶液(pH约为5)中加入NH4F溶液,溶液中Ca2+、Mg2+形成氟化物沉淀。若沉淀后上层清夜中c(F-)=0.05mol/L,则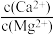 =
=_____ [Ksp(MgF2)=5×10-11,Ksp(CaF2)=5×10-9]
(3)制备MnCO3.在搅拌下向100mL1mol/LMnSO4溶液中缓慢滴加1mol/LNH4HCO3溶液,过滤、洗涤、干燥,得到MnCO3固体。需加入NH4HCO3溶液的体积约为_______ 。
(4)制备MnO2,MnCO3经热解、酸浸等步骤可制备MnO2。MnCO3在空气气流中热解得到三种价态锰的氧化物,锰元素所占比例(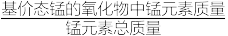 ×100%)随热解温度变化的曲线如图所示。
×100%)随热解温度变化的曲线如图所示。
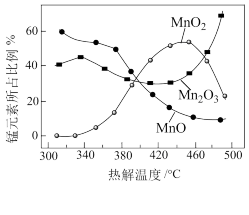
已知:MnO2与酸反应生成Mn2+;Mn2O3氧化性强于Cl2,加热条件下Mn2O3在酸性溶液中转化为MnO2和Mn2+。
为获得较高产率的MnO2,请补充实验方案:取一定量MnCO3置于热解装置中,通空气气流,加热到_______ 。将固体冷却后研成粉末,边搅摔边加入一定量_______ ,_______ ,充分反应后过滤,洗涤,_______ 。固体干燥,得到MnO2(可选用的试剂:1mol/LH2SO4溶液、2mol/LHCl溶液、0.1mo/LBaCl2溶液、0.1mol/LAgNO3溶液)。
(1)浸取。将一定量软锰矿粉与Na2SO3、H2SO4溶液中的一种配成悬浊液,加入到三颈瓶中(如图)。70℃下通过满液漏斗缓慢滴加另一种溶液,充分反应,过滤。滴液漏斗中的溶液是

(2)除杂。向已经除去Fe、Al、Si的MnSO4溶液(pH约为5)中加入NH4F溶液,溶液中Ca2+、Mg2+形成氟化物沉淀。若沉淀后上层清夜中c(F-)=0.05mol/L,则
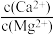 =
=(3)制备MnCO3.在搅拌下向100mL1mol/LMnSO4溶液中缓慢滴加1mol/LNH4HCO3溶液,过滤、洗涤、干燥,得到MnCO3固体。需加入NH4HCO3溶液的体积约为
(4)制备MnO2,MnCO3经热解、酸浸等步骤可制备MnO2。MnCO3在空气气流中热解得到三种价态锰的氧化物,锰元素所占比例(
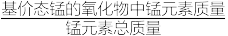 ×100%)随热解温度变化的曲线如图所示。
×100%)随热解温度变化的曲线如图所示。
已知:MnO2与酸反应生成Mn2+;Mn2O3氧化性强于Cl2,加热条件下Mn2O3在酸性溶液中转化为MnO2和Mn2+。
为获得较高产率的MnO2,请补充实验方案:取一定量MnCO3置于热解装置中,通空气气流,加热到
您最近一年使用:0次
2022-10-11更新
|
234次组卷
|
2卷引用:湖南省邵阳市第二中学2023-2024学年高二下学期入学考试化学试题
9 . 物质在水中可能存在电离平衡、水解平衡和沉淀溶解平衡,请根据所学知识回答:
(1)某温度下,纯水中的c(H+)=1.5×10-7,则纯水中的
_______ mol/L,该温度时的水的离子积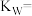
_______ 。保持温度不变,滴入稀盐酸使溶液中的 ,则溶液中的
,则溶液中的 为
为_______  。
。
(2)常温中,一定浓度的CH3COONa溶液的pH=8,已知CH3COOH的电离平衡常数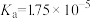 ,则该CH3COONa溶液中:
,则该CH3COONa溶液中: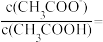
_______ 。
(3)甲酸钠(HCOONa)溶液呈碱性的原因是_______ (用离子方程式表示)。0.02mol/L的HCOONa溶液中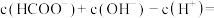
_______ mol/L。
(4)25℃,在0.10mol•L1硫酸铜溶液中加入氢氧化钠稀溶液充分反应,有蓝色氢氧化铜沉淀生成,当溶液的pH=9时,c(Cu2+)=_______ molL1(Ksp[Cu(OH)2]=2.2×1020)。
(1)某温度下,纯水中的c(H+)=1.5×10-7,则纯水中的

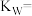
 ,则溶液中的
,则溶液中的 为
为 。
。(2)常温中,一定浓度的CH3COONa溶液的pH=8,已知CH3COOH的电离平衡常数
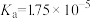 ,则该CH3COONa溶液中:
,则该CH3COONa溶液中: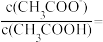
(3)甲酸钠(HCOONa)溶液呈碱性的原因是
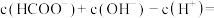
(4)25℃,在0.10mol•L1硫酸铜溶液中加入氢氧化钠稀溶液充分反应,有蓝色氢氧化铜沉淀生成,当溶液的pH=9时,c(Cu2+)=
您最近一年使用:0次
2022-09-14更新
|
308次组卷
|
2卷引用:湖南省岳阳市华容县2021-2022学年高二上学期期末教学质量监测化学试题
10 . 溶度积常数
(1)定义:沉淀溶解平衡的平衡常数叫溶度积常数,简称溶度积,通常用符号_______ 来表示。
(2)表达式:当难溶强电解质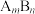 溶于水形成饱和溶液时,建立沉淀溶解平衡
溶于水形成饱和溶液时,建立沉淀溶解平衡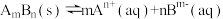 ,其溶度积的表达式为
,其溶度积的表达式为 =
=_______ 。
(3)影响因素: 只与难溶电解质的
只与难溶电解质的_______ 和_______ 有关,而与_______ 无关。
(4)意义: 反映了难溶电解质在水中的
反映了难溶电解质在水中的_______ 能力。当化学式表示的组成中阴、阳离子个数比相同时, 越大,难溶电解质在水中的溶解能力
越大,难溶电解质在水中的溶解能力_______ 。
(5)溶度积规则
①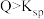 时,溶液
时,溶液_______ 。溶液中析出沉淀,直至平衡。
②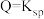 时,沉淀与溶解处于
时,沉淀与溶解处于_______ 。
③ 时,溶液
时,溶液_______ 沉淀会溶解直至平衡。
(1)定义:沉淀溶解平衡的平衡常数叫溶度积常数,简称溶度积,通常用符号
(2)表达式:当难溶强电解质
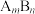 溶于水形成饱和溶液时,建立沉淀溶解平衡
溶于水形成饱和溶液时,建立沉淀溶解平衡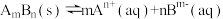 ,其溶度积的表达式为
,其溶度积的表达式为 =
=(3)影响因素:
 只与难溶电解质的
只与难溶电解质的(4)意义:
 反映了难溶电解质在水中的
反映了难溶电解质在水中的 越大,难溶电解质在水中的溶解能力
越大,难溶电解质在水中的溶解能力(5)溶度积规则
①
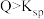 时,溶液
时,溶液②
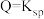 时,沉淀与溶解处于
时,沉淀与溶解处于③
 时,溶液
时,溶液
您最近一年使用:0次
2021-09-03更新
|
603次组卷
|
4卷引用:湖南省邵阳市第二中学2021-2022学年高二上学期期中考试化学试题
湖南省邵阳市第二中学2021-2022学年高二上学期期中考试化学试题课前-3.4.1 沉淀溶解平衡与溶度积-课前、课中、课后(人教版2019选择性必修1)(已下线)第三章第四节 难溶电解的溶解平衡(备作业)-【上好课】2021-2022学年高二化学选修4同步备课系列(人教版)(已下线)3.4.1 沉淀溶解平衡-2021-2022学年高二化学课后培优练(人教版选修4)



