电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离平衡常数如下表:
①HCOONa、NaCN、NaHCO3、Na2CO3这四种溶液的阴离子结合质子能力最强的是______ 。
②体积相同、c(H+)相同的三种酸溶液a.HCOOH;b.HCN;c.H2SO4分别与浓度相等的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填序号)_____ 。
③向NaCN溶液通入少量CO2反应的化学方程式是_______ 。
(2)一定浓度的NaCN溶液pH=9,用离子方程式表示呈碱性的原因是____ ,此时, =
=_____ 。
(3)常温下,向20 mL 0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/L HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
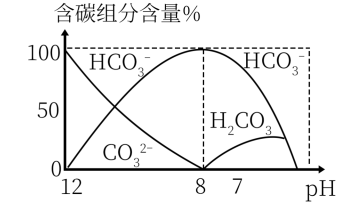
回答下列问题:
在同一溶液中H2CO3、 、
、
______ (填“能”或“不能”)大量共存。
②当pH=7时,溶液中含碳元素的主要微粒为_____ ,溶液中各种离子( 除外)的物质的量浓度的大小关系为
除外)的物质的量浓度的大小关系为______ 。
③已知在25℃时, 水解反应的平衡常数即水解常数Kh=
水解反应的平衡常数即水解常数Kh=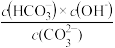 =2.0×10-4,当溶液中c(
=2.0×10-4,当溶液中c( ):c(
):c( )=2:1时,溶液pH=
)=2:1时,溶液pH=______ 。
(4)已知CaCO3的Ksp=2.8×10-9,现将浓度为2×10-4 mol/L Na2CO3溶液与CaCl2溶液等体积混合,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为________ mol/L。
(1)已知部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
①HCOONa、NaCN、NaHCO3、Na2CO3这四种溶液的阴离子结合质子能力最强的是
②体积相同、c(H+)相同的三种酸溶液a.HCOOH;b.HCN;c.H2SO4分别与浓度相等的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填序号)
③向NaCN溶液通入少量CO2反应的化学方程式是
(2)一定浓度的NaCN溶液pH=9,用离子方程式表示呈碱性的原因是
 =
=(3)常温下,向20 mL 0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/L HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。

回答下列问题:
在同一溶液中H2CO3、
 、
、
②当pH=7时,溶液中含碳元素的主要微粒为
 除外)的物质的量浓度的大小关系为
除外)的物质的量浓度的大小关系为③已知在25℃时,
 水解反应的平衡常数即水解常数Kh=
水解反应的平衡常数即水解常数Kh=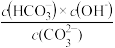 =2.0×10-4,当溶液中c(
=2.0×10-4,当溶液中c( ):c(
):c( )=2:1时,溶液pH=
)=2:1时,溶液pH=(4)已知CaCO3的Ksp=2.8×10-9,现将浓度为2×10-4 mol/L Na2CO3溶液与CaCl2溶液等体积混合,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为
更新时间:2020-07-13 12:56:48
|
相似题推荐
填空题
|
较难
(0.4)
名校
【推荐1】填空。
(1)25℃时,0.1mol/L的HA溶液中 。HA是
。HA是_______ (填“强电解质”或“弱电解质”)。
(2)将0.1mol/L的 加水稀释,随着水量的增加而减小的是
加水稀释,随着水量的增加而减小的是_______ (填字母)
a. b.溶液中离子总数 c.溶液导电性 d.溶液中醋酸分子数 e.醋酸电离程度
b.溶液中离子总数 c.溶液导电性 d.溶液中醋酸分子数 e.醋酸电离程度
(3)已知:HClO的电离常数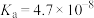 ;
;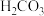 的电离常数
的电离常数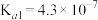 ,
,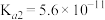 。向NaClO溶液中通入少量
。向NaClO溶液中通入少量 气体,发生反应的离子方程式为
气体,发生反应的离子方程式为_______
(4)已知肼( )是一种二元弱碱,其电离方程式与
)是一种二元弱碱,其电离方程式与 的电离相似,写出肼的第一步电离方程式
的电离相似,写出肼的第一步电离方程式_______
(5)常温下,将pH均为3,体积均为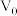 的HA和HB溶液,分别加水稀释至体积V,pH随
的HA和HB溶液,分别加水稀释至体积V,pH随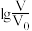 的变化如图所示。a、b、c三点水的电离程度
的变化如图所示。a、b、c三点水的电离程度_______ (用“>”、“<”、“=”填空)

(6) 浓度相同的等体积的两份上述溶液HA和HB,分别加入等质量的锌粉,充分反应后仅有一份溶液中存在锌,则下列说法正确的是
浓度相同的等体积的两份上述溶液HA和HB,分别加入等质量的锌粉,充分反应后仅有一份溶液中存在锌,则下列说法正确的是_______ (填写序号)
①溶液中溶质的物质的量浓度 ②溶液中溶质的物质的量浓度
②溶液中溶质的物质的量浓度
③开始反应时的速率 ④开始反应时的速率
④开始反应时的速率
⑤HA溶液里有锌剩余 ⑥HB溶液里有锌剩余
(1)25℃时,0.1mol/L的HA溶液中
 。HA是
。HA是(2)将0.1mol/L的
 加水稀释,随着水量的增加而减小的是
加水稀释,随着水量的增加而减小的是a.
 b.溶液中离子总数 c.溶液导电性 d.溶液中醋酸分子数 e.醋酸电离程度
b.溶液中离子总数 c.溶液导电性 d.溶液中醋酸分子数 e.醋酸电离程度(3)已知:HClO的电离常数
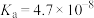 ;
;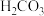 的电离常数
的电离常数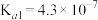 ,
,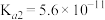 。向NaClO溶液中通入少量
。向NaClO溶液中通入少量 气体,发生反应的离子方程式为
气体,发生反应的离子方程式为(4)已知肼(
 )是一种二元弱碱,其电离方程式与
)是一种二元弱碱,其电离方程式与 的电离相似,写出肼的第一步电离方程式
的电离相似,写出肼的第一步电离方程式(5)常温下,将pH均为3,体积均为
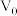 的HA和HB溶液,分别加水稀释至体积V,pH随
的HA和HB溶液,分别加水稀释至体积V,pH随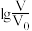 的变化如图所示。a、b、c三点水的电离程度
的变化如图所示。a、b、c三点水的电离程度
(6)
 浓度相同的等体积的两份上述溶液HA和HB,分别加入等质量的锌粉,充分反应后仅有一份溶液中存在锌,则下列说法正确的是
浓度相同的等体积的两份上述溶液HA和HB,分别加入等质量的锌粉,充分反应后仅有一份溶液中存在锌,则下列说法正确的是①溶液中溶质的物质的量浓度
 ②溶液中溶质的物质的量浓度
②溶液中溶质的物质的量浓度
③开始反应时的速率
 ④开始反应时的速率
④开始反应时的速率
⑤HA溶液里有锌剩余 ⑥HB溶液里有锌剩余
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】根据中学化学常见的①CH3COOH;②HCl;③H2SO4三种溶液,请用A、B、C…等符号填空:A ①<②<③ B ①=②=③ C ①>②>③ D ①<②=③ E ①=③>② F ①>②=③ G ①=②>③ H ①=②<③
(1)当它们pH相同时,其物质的量浓度关系是__________ 。
(2)当它们的物质的量浓度相同时,其pH的关系是___________ 。
(3)中和等体积、等物质的量浓度的烧碱溶液,需同物质的量浓度的三种酸溶液的体积关系为_________ 。
(4)当它们pH相同、体积相同时,同时加入锌,则开始时反应速率_________ ,若产生相同体积的气体(相同状况),所需时间___________ 。
(5)将pH相同的三种酸均稀释10倍后,pH关系为___________ 。
(1)当它们pH相同时,其物质的量浓度关系是
(2)当它们的物质的量浓度相同时,其pH的关系是
(3)中和等体积、等物质的量浓度的烧碱溶液,需同物质的量浓度的三种酸溶液的体积关系为
(4)当它们pH相同、体积相同时,同时加入锌,则开始时反应速率
(5)将pH相同的三种酸均稀释10倍后,pH关系为
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】水溶液中存在多种类型的平衡。
(1)25℃时,现有pH=2的醋酸和pH=2的盐酸
①取10mL的上述醋酸溶液,加入等体积的水醋酸的电离平衡__________ 移动(填“向左”、“向右”或“不”)。
②相同条件下,取等体积的上述醋酸、盐酸溶液,各稀释100倍。稀释后的溶液,其pH大小关系为pH(醋酸)__________ pH(盐酸)(填“大于”、“小于”或“等于”)。
③取上述醋酸、盐酸溶液,分别与等体积、等浓度NaOH稀溶液恰好完全反应,则消耗的两种酸溶液的体积大小关系为V(醋酸)__________ V(盐酸)(填“大于”、“小于”或“等于”)。
(2)实验室可用NaOH溶液吸收NO2,含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol·L-1的CH3COONa溶液,则两溶液中c(NO )、c(NO
)、c(NO )和c(CH3COO-)由大到小的顺序为
)和c(CH3COO-)由大到小的顺序为_____ ,已知HNO2的电离常数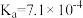 ,CH3COOH的电离常数
,CH3COOH的电离常数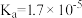 ,可使溶液A和溶液B的pH相等的方法是
,可使溶液A和溶液B的pH相等的方法是__________ 。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(3)25℃时,H2SO3的电离常数:

H2CO3的电离常数: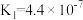

①写出碳酸的第一级电离平衡常数表达式K1=__________ 。
②足量的H2SO3溶液和NaHCO3溶液发生反应的主要离子方程式为__________ 。
③25℃时。将一定量的SO2通入到NaOH溶液。两者恰好完全反应得到NaHSO3溶液,此溶液中c(Na+)、c(HSO )、c(SO
)、c(SO )、c(H2SO3)的浓度由大到小的排列顺序为
)、c(H2SO3)的浓度由大到小的排列顺序为__________ 。
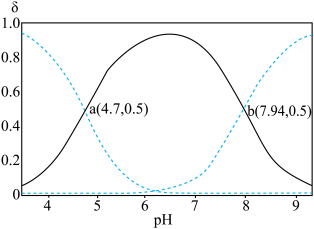
(4)烟气中的SO2可以用“亚硫酸铵吸收法”处理,发生的反应为 ,测得25℃时溶液pH与各组分物质的量分数的变化关系如图所示。b点时溶液pH=7,则n(NH
,测得25℃时溶液pH与各组分物质的量分数的变化关系如图所示。b点时溶液pH=7,则n(NH ):n(HSO
):n(HSO )=
)=__________ 。

(1)25℃时,现有pH=2的醋酸和pH=2的盐酸
①取10mL的上述醋酸溶液,加入等体积的水醋酸的电离平衡
②相同条件下,取等体积的上述醋酸、盐酸溶液,各稀释100倍。稀释后的溶液,其pH大小关系为pH(醋酸)
③取上述醋酸、盐酸溶液,分别与等体积、等浓度NaOH稀溶液恰好完全反应,则消耗的两种酸溶液的体积大小关系为V(醋酸)
(2)实验室可用NaOH溶液吸收NO2,含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol·L-1的CH3COONa溶液,则两溶液中c(NO
 )、c(NO
)、c(NO )和c(CH3COO-)由大到小的顺序为
)和c(CH3COO-)由大到小的顺序为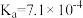 ,CH3COOH的电离常数
,CH3COOH的电离常数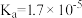 ,可使溶液A和溶液B的pH相等的方法是
,可使溶液A和溶液B的pH相等的方法是a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(3)25℃时,H2SO3的电离常数:


H2CO3的电离常数:
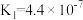

①写出碳酸的第一级电离平衡常数表达式K1=
②足量的H2SO3溶液和NaHCO3溶液发生反应的主要离子方程式为
③25℃时。将一定量的SO2通入到NaOH溶液。两者恰好完全反应得到NaHSO3溶液,此溶液中c(Na+)、c(HSO
 )、c(SO
)、c(SO )、c(H2SO3)的浓度由大到小的排列顺序为
)、c(H2SO3)的浓度由大到小的排列顺序为(4)烟气中的SO2可以用“亚硫酸铵吸收法”处理,发生的反应为
 ,测得25℃时溶液pH与各组分物质的量分数的变化关系如图所示。b点时溶液pH=7,则n(NH
,测得25℃时溶液pH与各组分物质的量分数的变化关系如图所示。b点时溶液pH=7,则n(NH ):n(HSO
):n(HSO )=
)=
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐1】结合下表回答下列问题(均为常温下的数据):
请回答下列问题:
(1)同浓度的 中结合
中结合 的能力最弱的是
的能力最弱的是___________ 。
(2) 时,
时, 的盐酸溶液与
的盐酸溶液与 的
的 溶液混合后
溶液混合后 ,求混合前酸碱的体积比
,求混合前酸碱的体积比___________ 。
(3)常温下,浓度为 的
的 溶液在加水稀释过程中,下列表达式的数据一定变小的是___________(填字母)。
溶液在加水稀释过程中,下列表达式的数据一定变小的是___________(填字母)。
(4)向 溶液中滴加
溶液中滴加 溶液至
溶液至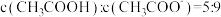 ,此时溶液
,此时溶液
___________ 。
(5)向 溶液中通入少量的
溶液中通入少量的 ,所发生的离子方程式为
,所发生的离子方程式为___________ 。
| 酸 | 电离常数 |
 |  |
 |  |
 |  |
 |  |
 |  |
请回答下列问题:
(1)同浓度的
 中结合
中结合 的能力最弱的是
的能力最弱的是(2)
 时,
时, 的盐酸溶液与
的盐酸溶液与 的
的 溶液混合后
溶液混合后 ,求混合前酸碱的体积比
,求混合前酸碱的体积比(3)常温下,浓度为
 的
的 溶液在加水稀释过程中,下列表达式的数据一定变小的是___________(填字母)。
溶液在加水稀释过程中,下列表达式的数据一定变小的是___________(填字母)。A. | B. | C. | D.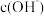 |
 溶液中滴加
溶液中滴加 溶液至
溶液至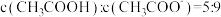 ,此时溶液
,此时溶液
(5)向
 溶液中通入少量的
溶液中通入少量的 ,所发生的离子方程式为
,所发生的离子方程式为
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】碳酸及碳酸盐与自然界碳的循环有着密切的联系。
(1)已知常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3⇌HCO + H+的平衡常数K1=
+ H+的平衡常数K1=____ 。(已知10-5.60=2.5×10-6)
(2)已知H2CO3的第二级电离常数Ka2=5.6×10-11,HClO的电离常数K=3.0×10-8,写出下列所发生反应的离子方程式:
a.少量Cl2通入过量的Na2CO3溶液中:____ 。
b.少量CO2通入过量的NaClO溶液中:____ 。
(3)人体血液里主要通过碳酸氢盐缓冲体系( )维持pH稳定。已知正常人体血液在正常体温时,H2CO3的一级电离常数Ka1=10-6.1,
)维持pH稳定。已知正常人体血液在正常体温时,H2CO3的一级电离常数Ka1=10-6.1, ≈
≈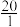 ,1g2=0.3。由题给数据可算得正常人体血液的pH约为
,1g2=0.3。由题给数据可算得正常人体血液的pH约为_____ ,当过量的酸进入血液中时,血液缓冲体系中 的值将
的值将____ (填“变大、变小、不变”)。
(4)NaOH吸收CO2后某种产物的水溶液在pH从0至14的范围内H2CO3、HCO 、CO
、CO 三种成分平衡时的组成分数如图所示,若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为
三种成分平衡时的组成分数如图所示,若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为____ 之间

(1)已知常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3⇌HCO
 + H+的平衡常数K1=
+ H+的平衡常数K1=(2)已知H2CO3的第二级电离常数Ka2=5.6×10-11,HClO的电离常数K=3.0×10-8,写出下列所发生反应的离子方程式:
a.少量Cl2通入过量的Na2CO3溶液中:
b.少量CO2通入过量的NaClO溶液中:
(3)人体血液里主要通过碳酸氢盐缓冲体系(
 )维持pH稳定。已知正常人体血液在正常体温时,H2CO3的一级电离常数Ka1=10-6.1,
)维持pH稳定。已知正常人体血液在正常体温时,H2CO3的一级电离常数Ka1=10-6.1, ≈
≈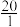 ,1g2=0.3。由题给数据可算得正常人体血液的pH约为
,1g2=0.3。由题给数据可算得正常人体血液的pH约为 的值将
的值将(4)NaOH吸收CO2后某种产物的水溶液在pH从0至14的范围内H2CO3、HCO
 、CO
、CO 三种成分平衡时的组成分数如图所示,若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为
三种成分平衡时的组成分数如图所示,若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】已知: 乙二酸俗称草酸(结构简式为HOOC-COOH,可简写为H2C2O4)。25℃时,草酸的电离平衡常数为K1=5.0×10-2,K2=5.4×10-5;碳酸(H2CO3) 的电离平衡常数为K1=4.5×10-7,K2=4.7×10-11。草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。
回答下列问题:
(1)写出水溶液中草酸的第一步电离方程式________________________ 。
(2)相同条件下物质的量浓度都为0.1mol/L的Na2C2O4溶液的pH 比Na2CO3溶液的pH_____ (填“大”、“小”或“相等”)。
(3)常温下将0.4mol/L 的KOH 溶液20mL 与0.2mol/L 的草酸溶液20mL混合,则混合后溶液中阴离子浓度的大小顺序为___________________________ 。
(4) 往Na2CO3溶液中加入少量草酸溶液,发生反应的离子方程式为_______________________ 。
(5)25℃时,向20mL碳酸钙的饱和溶液中逐滴加入cmolL的草酸钾溶液20mL后,有草酸钙沉淀生成,则c 的最小值为____________ 。
回答下列问题:
(1)写出水溶液中草酸的第一步电离方程式
(2)相同条件下物质的量浓度都为0.1mol/L的Na2C2O4溶液的pH 比Na2CO3溶液的pH
(3)常温下将0.4mol/L 的KOH 溶液20mL 与0.2mol/L 的草酸溶液20mL混合,则混合后溶液中阴离子浓度的大小顺序为
(4) 往Na2CO3溶液中加入少量草酸溶液,发生反应的离子方程式为
(5)25℃时,向20mL碳酸钙的饱和溶液中逐滴加入cmolL的草酸钾溶液20mL后,有草酸钙沉淀生成,则c 的最小值为
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐1】肼在水溶液中为二元弱碱,在水中的电离方式与氨相似。常温下,向0.1mol·L-1肼溶液中,滴加稀盐酸调节pH。溶液中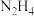 、
、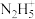 、
、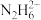 占含氮物种的物质的量分数为
占含氮物种的物质的量分数为 (如
(如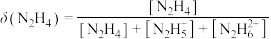 ),
), 随溶液pH变化的曲线如下图所示:
随溶液pH变化的曲线如下图所示:
(1)常温下中性溶液中,各含氮物种的浓度大小关系为______________。
(2)室温时,反应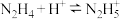 平衡常数K的数值为_____________。
平衡常数K的数值为_____________。
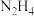 、
、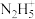 、
、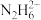 占含氮物种的物质的量分数为
占含氮物种的物质的量分数为 (如
(如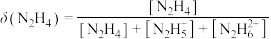 ),
), 随溶液pH变化的曲线如下图所示:
随溶液pH变化的曲线如下图所示:
(1)常温下中性溶液中,各含氮物种的浓度大小关系为______________。
A.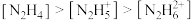 | B.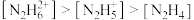 |
C.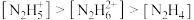 | D.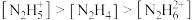 |
(2)室温时,反应
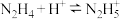 平衡常数K的数值为_____________。
平衡常数K的数值为_____________。A.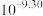 | B.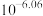 | C. | D.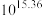 |
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐2】工业上在一定条件下将丙烷脱氢制丙烯.

 反应过程中能量变化如图1所示,下列有关叙述正确的是
反应过程中能量变化如图1所示,下列有关叙述正确的是______ .
 此反应为吸热反应
此反应为吸热反应
 催化剂能改变反应的焓变和活化能
催化剂能改变反应的焓变和活化能
 表示正反应的活化能,
表示正反应的活化能,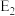 表示逆反应的活化能
表示逆反应的活化能
 有催化剂能加快反应速率,提高丙烷的转化率
有催化剂能加快反应速率,提高丙烷的转化率
 上述反应在恒温恒容密闭容器中达到平衡,其平衡常数K的表达式为
上述反应在恒温恒容密闭容器中达到平衡,其平衡常数K的表达式为______  若升温,该反应的平衡常数
若升温,该反应的平衡常数______  填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变” 若向上述反应达到平衡的容器内再通入少量丙烷,则
若向上述反应达到平衡的容器内再通入少量丙烷,则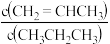
______  填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变” .
.
 在
在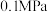 、800K条件下,向恒容密闭容器中通入丙烷和稀有气体,丙烷脱氢反应的转化率随着稀有气体与丙烷比例的变化情况如图2所示,则随着稀有气体与丙烷比例的增加,丙烷转化率逐渐增大的原因是
、800K条件下,向恒容密闭容器中通入丙烷和稀有气体,丙烷脱氢反应的转化率随着稀有气体与丙烷比例的变化情况如图2所示,则随着稀有气体与丙烷比例的增加,丙烷转化率逐渐增大的原因是______ .
 上述反应生成物丙烯经多步氧化生成丙酸,已知常温下
上述反应生成物丙烯经多步氧化生成丙酸,已知常温下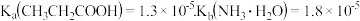 .
.
 用离子方程式表示
用离子方程式表示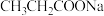 溶液显碱性的原因
溶液显碱性的原因______ .
 常温下,若丙酸与氨水混合后溶液呈中性,则溶液中
常温下,若丙酸与氨水混合后溶液呈中性,则溶液中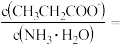
______ .
 已知:
已知:
则丙烷脱氢反应的热化学方程式为______ .

 反应过程中能量变化如图1所示,下列有关叙述正确的是
反应过程中能量变化如图1所示,下列有关叙述正确的是 此反应为吸热反应
此反应为吸热反应 催化剂能改变反应的焓变和活化能
催化剂能改变反应的焓变和活化能 表示正反应的活化能,
表示正反应的活化能,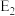 表示逆反应的活化能
表示逆反应的活化能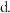 有催化剂能加快反应速率,提高丙烷的转化率
有催化剂能加快反应速率,提高丙烷的转化率 上述反应在恒温恒容密闭容器中达到平衡,其平衡常数K的表达式为
上述反应在恒温恒容密闭容器中达到平衡,其平衡常数K的表达式为 若升温,该反应的平衡常数
若升温,该反应的平衡常数 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变” 若向上述反应达到平衡的容器内再通入少量丙烷,则
若向上述反应达到平衡的容器内再通入少量丙烷,则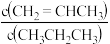
 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变” .
. 在
在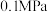 、800K条件下,向恒容密闭容器中通入丙烷和稀有气体,丙烷脱氢反应的转化率随着稀有气体与丙烷比例的变化情况如图2所示,则随着稀有气体与丙烷比例的增加,丙烷转化率逐渐增大的原因是
、800K条件下,向恒容密闭容器中通入丙烷和稀有气体,丙烷脱氢反应的转化率随着稀有气体与丙烷比例的变化情况如图2所示,则随着稀有气体与丙烷比例的增加,丙烷转化率逐渐增大的原因是 上述反应生成物丙烯经多步氧化生成丙酸,已知常温下
上述反应生成物丙烯经多步氧化生成丙酸,已知常温下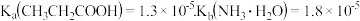 .
. 用离子方程式表示
用离子方程式表示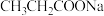 溶液显碱性的原因
溶液显碱性的原因 常温下,若丙酸与氨水混合后溶液呈中性,则溶液中
常温下,若丙酸与氨水混合后溶液呈中性,则溶液中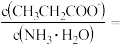
 已知:
已知:| 化学键 |  |  | 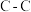 |  |
键能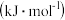 | 436 | 413 | 348 | 612 |
则丙烷脱氢反应的热化学方程式为
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐3】 时部分弱酸的电离平衡常数如下表:
时部分弱酸的电离平衡常数如下表:
(1)在温度相同时,各弱酸的 值与酸性的相对强弱的关系为
值与酸性的相对强弱的关系为_______ 。
(2)室温下①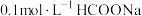 ,②
,②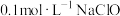 ,③
,③ ,④
,④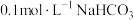 ,溶液的pH由大到小的关系为
,溶液的pH由大到小的关系为_______ (填序号)。
(3)浓度均为 的
的 和
和 的混合溶液中,
的混合溶液中, 、
、 、
、 浓度由大到小的顺序为
浓度由大到小的顺序为_______ 。
(4)在 时,将
时,将 的
的 溶液与
溶液与 的盐酸等体积混合,反应后测得溶液
的盐酸等体积混合,反应后测得溶液 ,则a
,则a_______ (填“>”“<”或“=”)0.01。
(5)某温度下纯水的 。则此温度下
。则此温度下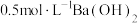 溶液的
溶液的
_______ 。
(6)向 醋酸溶液中加入水,电离平衡向
醋酸溶液中加入水,电离平衡向_______ 移动(填“左”“右”或“不移动”);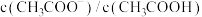
_______ (填“变大”“变小”或“不变”)。
 时部分弱酸的电离平衡常数如下表:
时部分弱酸的电离平衡常数如下表:| 弱酸 |  |  |  |  |
电离平衡常数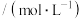 | 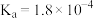 | 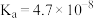 | 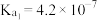 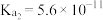 | 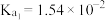 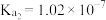 |
 值与酸性的相对强弱的关系为
值与酸性的相对强弱的关系为(2)室温下①
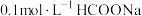 ,②
,②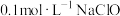 ,③
,③ ,④
,④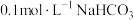 ,溶液的pH由大到小的关系为
,溶液的pH由大到小的关系为(3)浓度均为
 的
的 和
和 的混合溶液中,
的混合溶液中, 、
、 、
、 浓度由大到小的顺序为
浓度由大到小的顺序为(4)在
 时,将
时,将 的
的 溶液与
溶液与 的盐酸等体积混合,反应后测得溶液
的盐酸等体积混合,反应后测得溶液 ,则a
,则a(5)某温度下纯水的
 。则此温度下
。则此温度下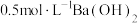 溶液的
溶液的
(6)向
 醋酸溶液中加入水,电离平衡向
醋酸溶液中加入水,电离平衡向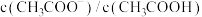
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐1】三氧化钨(WO3)常用于制备特种合金、防火材料和防腐涂层。现利用白钨精矿(含80%CaWO4及少量Fe、Zn和Mg等的氧化物)生产WO3,设计了如下工艺流程:

已知:①浸出液中钨(W)以[WO3C2O4H2O]2-形式存在。
②钨酸(H2WO4)难溶于水。
③Ksp(CaSO4)=4.9×10-5,Ksp(CaC2O4)=2.3×10-9;Ka1(H2C2O4)=5.6×10-2,Ka2(H2C2O4)=1.6×10-4。
回答下列问题:
通过计算说明“浸取”过程形成CaSO4而不能形成CaC2O4的原因:___________ 。

已知:①浸出液中钨(W)以[WO3C2O4H2O]2-形式存在。
②钨酸(H2WO4)难溶于水。
③Ksp(CaSO4)=4.9×10-5,Ksp(CaC2O4)=2.3×10-9;Ka1(H2C2O4)=5.6×10-2,Ka2(H2C2O4)=1.6×10-4。
回答下列问题:
通过计算说明“浸取”过程形成CaSO4而不能形成CaC2O4的原因:
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
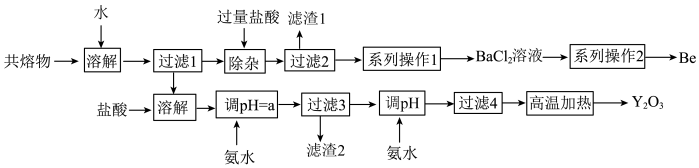
【推荐2】钇是稀土元素之一。我国蕴藏着丰富的钇矿石(Y2FeBe2Si2O10),用NaOH初步处理钇矿石可以得到Y(OH)3、Fe2O3、Na2SiO3和Na2BeO2的共熔物。工业上利用该共熔物制取氧化钇,并获得副产物铍,流程如图:
已知i.铍和铝处于元素周期表的对角线位置,化学性质相似;
ii.Fe3+、Y3+形成氢氧化物沉淀时的pH如表:
(1)滤渣1的主要成分是_______ 。
(2)过滤2所得滤液中含有NaCl、BeCl2和少量HCl。为提纯BeCl2。选择合理步骤并排序完成系列操作1_______ 。
a.加入适量的盐酸
b.通入过量的CO2
c.过滤
d.加入过量的NaOH溶液
e.加入过量的氨水
f.洗涤
(3)由BeCl2溶液制得BeCl2固体的操作为_______ 。
(4)用氨水调节pH=a时,a的取值范围是_______ 。
(5)计算常温下Y3++3H2O Y(OH)3+3H+的平衡常数K=
Y(OH)3+3H+的平衡常数K=_______ 。(常温下Ksp[Y(OH)3]=8.0×10-23)
(6)“除杂”中Na2BeO2与过量盐酸反应的离子方程式为_______ 。
(7)常见的由BeCl2固体生产Be的工业方法有两种:①电解法:电解NaCl-BeCl2混合熔融盐制备Be;②热还原法:熔融条件下,钾还原BeCl2制备Be。以上两种方法你认为哪种更好并说明理由_______ 。

已知i.铍和铝处于元素周期表的对角线位置,化学性质相似;
ii.Fe3+、Y3+形成氢氧化物沉淀时的pH如表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 2.1 | 3.1 |
| Y3+ | 6.0 | 8.3 |
(2)过滤2所得滤液中含有NaCl、BeCl2和少量HCl。为提纯BeCl2。选择合理步骤并排序完成系列操作1
a.加入适量的盐酸
b.通入过量的CO2
c.过滤
d.加入过量的NaOH溶液
e.加入过量的氨水
f.洗涤
(3)由BeCl2溶液制得BeCl2固体的操作为
(4)用氨水调节pH=a时,a的取值范围是
(5)计算常温下Y3++3H2O
 Y(OH)3+3H+的平衡常数K=
Y(OH)3+3H+的平衡常数K=(6)“除杂”中Na2BeO2与过量盐酸反应的离子方程式为
(7)常见的由BeCl2固体生产Be的工业方法有两种:①电解法:电解NaCl-BeCl2混合熔融盐制备Be;②热还原法:熔融条件下,钾还原BeCl2制备Be。以上两种方法你认为哪种更好并说明理由
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐3】已知氢氧化钙和钨酸钙(CaWO4都是微溶电解质,两者的溶解度均随温度升高而减小。在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应I: (aq)+Ca(OH)2(s)⇌CaWO4(s)+2OH-(aq),如图为不同温度下Ca(OH)2、CaWO4 的沉淀溶解平衡曲线。试回答下列问题:
(aq)+Ca(OH)2(s)⇌CaWO4(s)+2OH-(aq),如图为不同温度下Ca(OH)2、CaWO4 的沉淀溶解平衡曲线。试回答下列问题:

(1)①计算T1时,Ksp(CaWO4)=
②T1
(2)①反应I平衡常数K的表达式为
②该反应的△H
③由于溶液中离子间的相互作用,实验测得的平衡常数与理论值直相距甚远。50℃时,向一定体积的钨酸钠碱性溶液[c(Na2WO4)=c(NaOH)=0.5mol/L]中,加入过量Ca(OH)2,反应达到平衡后 的沉淀率为60%,此时
的沉淀率为60%,此时 的平衡浓度为
的平衡浓度为
您最近一年使用:0次



