水溶液广泛存在于生命体及其赖以生存的环境中。弱电解质的电离平衡、盐类的水解平衡和难溶电解质的沉淀溶解平衡都与日常生活、工农业生产等息息相关。回答下列问题:
(1)25℃时,将 的醋酸溶液与
的醋酸溶液与 的氢氧化钠溶液等体积混合,反应后溶液中
的氢氧化钠溶液等体积混合,反应后溶液中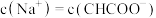 ,则a
,则a___________ 0.01(填“>”、“<”或“=”)。
(2)25℃时,某 溶液的
溶液的 。关于此溶液中的微粒浓度,下列说法正确的是
。关于此溶液中的微粒浓度,下列说法正确的是_______ 。
A.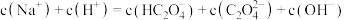
B.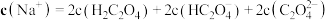
C.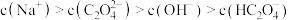
(3)人体内草酸累积过多容易导致结石,其主要成分是草酸钙 ,草酸钻在水中的沉淀溶解平衡可用离子方程式表示为
,草酸钻在水中的沉淀溶解平衡可用离子方程式表示为___________ 。
(4)25℃时,已知 的
的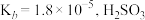 的
的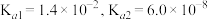 ,则
,则 被氨水捕获所得的
被氨水捕获所得的 溶液呈
溶液呈___________ (填“酸”、“碱”或“中”)性; 也可以被
也可以被 溶液捕获,所得溶液中
溶液捕获,所得溶液中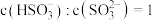 时,该溶液的
时,该溶液的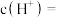
___________ 。
(5) 是水垢成分之一,室温下
是水垢成分之一,室温下 的
的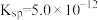 ,向
,向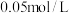 的
的 溶液中通入
溶液中通入 至刚好出现沉淀时,溶液的
至刚好出现沉淀时,溶液的 为
为___________ 。
(6)向 溶液中加入少量水,溶液中
溶液中加入少量水,溶液中
___________ (填“增大”、“减小”或“不变”)。
(1)25℃时,将
 的醋酸溶液与
的醋酸溶液与 的氢氧化钠溶液等体积混合,反应后溶液中
的氢氧化钠溶液等体积混合,反应后溶液中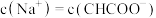 ,则a
,则a(2)25℃时,某
 溶液的
溶液的 。关于此溶液中的微粒浓度,下列说法正确的是
。关于此溶液中的微粒浓度,下列说法正确的是A.
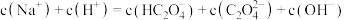
B.
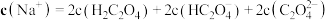
C.
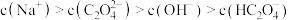
(3)人体内草酸累积过多容易导致结石,其主要成分是草酸钙
 ,草酸钻在水中的沉淀溶解平衡可用离子方程式表示为
,草酸钻在水中的沉淀溶解平衡可用离子方程式表示为(4)25℃时,已知
 的
的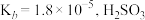 的
的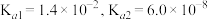 ,则
,则 被氨水捕获所得的
被氨水捕获所得的 溶液呈
溶液呈 也可以被
也可以被 溶液捕获,所得溶液中
溶液捕获,所得溶液中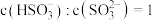 时,该溶液的
时,该溶液的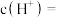
(5)
 是水垢成分之一,室温下
是水垢成分之一,室温下 的
的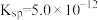 ,向
,向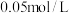 的
的 溶液中通入
溶液中通入 至刚好出现沉淀时,溶液的
至刚好出现沉淀时,溶液的 为
为(6)向
 溶液中加入少量水,溶液中
溶液中加入少量水,溶液中
更新时间:2024-02-03 04:47:33
|
相似题推荐
填空题
|
较难
(0.4)
【推荐1】已知25 ℃时部分弱电解质的电离平衡常数数据如下表:
(1)等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为____ (填字母)。
(2)常温下, 0.1 mol·L-1的CH3COOH 溶液加水稀释,下列表达式的数据变大的是______。
(3)25 ℃时,将 20 mL 0.1 mol·L-1 CH3COOH 溶液和 20mL0.1 mol·L-1HSCN溶液分别与20mL 0.1 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如右图所示:反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是______ ; 反应结束后所得两溶液中,(CH3COO-)_____ c(SCN-)(填“>”、 “<”或“=”)

(4)25 ℃时,在 CH3COOH 与 CH3COONa 的混合溶液中,若测得 pH=6,则溶液中c(CH3COO-)-c(Na+)=____ mol·L-1(填精确值), c(CH3COO-)/c(CH3COOH)=____ 。
(5)用离子方程式表示Na2CO3溶液呈碱性的原因_____ 。
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.7×10-5 | 6.2×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
(1)等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为
(2)常温下, 0.1 mol·L-1的CH3COOH 溶液加水稀释,下列表达式的数据变大的是______。
| A.c (H+) | B.c(H+)/ c (CH3COOH) | C.c (H+) c (OH-) |

(4)25 ℃时,在 CH3COOH 与 CH3COONa 的混合溶液中,若测得 pH=6,则溶液中c(CH3COO-)-c(Na+)=
(5)用离子方程式表示Na2CO3溶液呈碱性的原因
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】按要求回答下列问题:
(1)设Ag=lg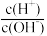 ,常温下,pH=12的Ba(OH)2与0.01mol/LNaHSO4等体积混合,则溶液中的AG=
,常温下,pH=12的Ba(OH)2与0.01mol/LNaHSO4等体积混合,则溶液中的AG=____ 。
(2)已知25℃时,Na2CO3的Kh1=2×10-4mol•L-1,则当Na2CO3溶液中c(HCO ):c(CO
):c(CO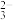 )=2:1时,求溶液的pH=
)=2:1时,求溶液的pH=____ 。
(3)常温下,pH=2的某酸(HxA)溶液与pH=12的某碱[B(OH)y]溶液等体积混合,充分反应后溶液的pH为10,若该盐中只存在一种能水解的离子,则水解的离子方程式为____ ,混合溶液中水电离出的c(H+)=____ 。
(4)某温度下,测得0.01mol/LNaOH溶液的pH=11,则将此温度下pH=12的NaOH溶液VxL与pH=2的H2SO4溶液VyL混合,所得溶液pH=10,则Vx:Vy=____ 。
(5)室温时,CH3COOH的Ka=1.8×10-5,将amol/L醋酸与bmol/LBa(OH)2溶液以2:1体积比混合(忽略溶液体积变化),若混合溶液中2c(Ba2+)=c(CH3COO-),则溶液呈____ 性,混合后溶液中CH3COOH的浓度为_____ mol/L。(用含相关字母的最简代数式表示)
(6)常温下,用300mL浓度为1mol/L的Na2SO3溶液吸收SO2的过程中,溶液pH随吸收SO2物质的量的变化曲线如图所示:
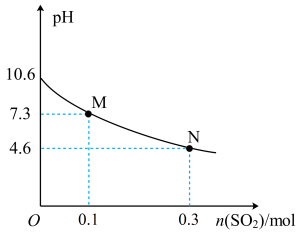
常温下,H2SO3的二级电离平衡常数Ka2约为_____ 。
(1)设Ag=lg
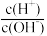 ,常温下,pH=12的Ba(OH)2与0.01mol/LNaHSO4等体积混合,则溶液中的AG=
,常温下,pH=12的Ba(OH)2与0.01mol/LNaHSO4等体积混合,则溶液中的AG=(2)已知25℃时,Na2CO3的Kh1=2×10-4mol•L-1,则当Na2CO3溶液中c(HCO
 ):c(CO
):c(CO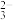 )=2:1时,求溶液的pH=
)=2:1时,求溶液的pH=(3)常温下,pH=2的某酸(HxA)溶液与pH=12的某碱[B(OH)y]溶液等体积混合,充分反应后溶液的pH为10,若该盐中只存在一种能水解的离子,则水解的离子方程式为
(4)某温度下,测得0.01mol/LNaOH溶液的pH=11,则将此温度下pH=12的NaOH溶液VxL与pH=2的H2SO4溶液VyL混合,所得溶液pH=10,则Vx:Vy=
(5)室温时,CH3COOH的Ka=1.8×10-5,将amol/L醋酸与bmol/LBa(OH)2溶液以2:1体积比混合(忽略溶液体积变化),若混合溶液中2c(Ba2+)=c(CH3COO-),则溶液呈
(6)常温下,用300mL浓度为1mol/L的Na2SO3溶液吸收SO2的过程中,溶液pH随吸收SO2物质的量的变化曲线如图所示:

常温下,H2SO3的二级电离平衡常数Ka2约为
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐3】Ⅰ.甲、乙两同学拟用实验确定某酸HA是弱电解质。他们的方案分别是:
甲:①称取一定质量的HA配制 0.1mol/L的溶液100 mL;
②用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL;
②分别取这两种溶液各10 mL,加水稀释为100 mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的足量锌粒,观察现象,即可证明HA是弱电解质。
(1) 在两个方案的第①步中,都要用到的定量仪器是___________ ;
(2) 甲方案中,说明HA是弱电质的理由是测得溶液的pH___________ 1 (选填>,<,=);在pH测定过程中,若事先将pH试纸用蒸馏水润湿,则所测的pH值将 ___________ (填“增大”、“减小”或“无变化”);
(3) 乙方案中,说明HA是弱电解质的现象是___________ 。
Ⅱ.水是一种极弱的电解质,其电离平衡曲线如下图所示。

(1) 若以A点表示25℃时水在电离平衡时的离子浓度, 当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积为___________ ;
(2) 在100℃下,0.01mol/L NaOH溶液中,c(H+)为___________ ;
(3) 在100℃下,将pH=8的Ba(OH)2溶液与pH=4的稀盐酸以11 :9的体积混合,则在该温度下混合之后的pH为___________ 。
甲:①称取一定质量的HA配制 0.1mol/L的溶液100 mL;
②用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL;
②分别取这两种溶液各10 mL,加水稀释为100 mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的足量锌粒,观察现象,即可证明HA是弱电解质。
(1) 在两个方案的第①步中,都要用到的定量仪器是
(2) 甲方案中,说明HA是弱电质的理由是测得溶液的pH
(3) 乙方案中,说明HA是弱电解质的现象是
Ⅱ.水是一种极弱的电解质,其电离平衡曲线如下图所示。

(1) 若以A点表示25℃时水在电离平衡时的离子浓度, 当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积为
(2) 在100℃下,0.01mol/L NaOH溶液中,c(H+)为
(3) 在100℃下,将pH=8的Ba(OH)2溶液与pH=4的稀盐酸以11 :9的体积混合,则在该温度下混合之后的pH为
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐1】物质在水中存在电离平衡、水解平衡。请根据所学知识回答:
(1)次磷酸( )是一种精细化工产品,向10mL
)是一种精细化工产品,向10mL  溶液中加入20mL等物质的量浓度的NaOH溶液后,所得的溶液中只有
溶液中加入20mL等物质的量浓度的NaOH溶液后,所得的溶液中只有 、
、 两种阴离子。
两种阴离子。
①写出 溶液与足量NaOH溶液反应后形成的正盐的化学式:
溶液与足量NaOH溶液反应后形成的正盐的化学式:___________ 。
②常温下,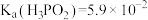 ,0.1mol/L的
,0.1mol/L的 溶液在加水稀释过程中,下列表达式的数据一定变小的是
溶液在加水稀释过程中,下列表达式的数据一定变小的是___________ (填序号)。
A. B.
B. C.
C.
(2)25℃时,HF的电离常数为 ;
; 的电离常数为
的电离常数为 ,
,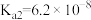 ,
, 。在
。在 溶液加入过量NaF溶液的离子反应方程式为
溶液加入过量NaF溶液的离子反应方程式为___________ 。
(3)盐碱地(含较多 、NaCl)不利于植物生长,盐碱地呈碱性的原因:
、NaCl)不利于植物生长,盐碱地呈碱性的原因:___________ (用离子方程式说明);已知25℃时,H2CO3的Ka1= 4.3×10-7,Ka2= 5×10-11 ,则当 溶液中
溶液中 时,溶液的pH=
时,溶液的pH=___________ 。
(4)某温度下,水的离子积常数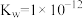 。该温度下,将pH=1的HCl溶液与pH=10的NaOH溶液混合并保持恒温,忽略混合前后溶液体积的变化。欲使混合溶液pH=3,则盐酸溶液与NaOH溶液的体积比为
。该温度下,将pH=1的HCl溶液与pH=10的NaOH溶液混合并保持恒温,忽略混合前后溶液体积的变化。欲使混合溶液pH=3,则盐酸溶液与NaOH溶液的体积比为___________ 。
(5)相同物质的量浓度的五种溶液:① 、②氨水、③
、②氨水、③ 、④
、④ 、⑤
、⑤ ,
, 由大到小顺序是
由大到小顺序是___________ (用序号表示)。
(1)次磷酸(
 )是一种精细化工产品,向10mL
)是一种精细化工产品,向10mL  溶液中加入20mL等物质的量浓度的NaOH溶液后,所得的溶液中只有
溶液中加入20mL等物质的量浓度的NaOH溶液后,所得的溶液中只有 、
、 两种阴离子。
两种阴离子。①写出
 溶液与足量NaOH溶液反应后形成的正盐的化学式:
溶液与足量NaOH溶液反应后形成的正盐的化学式:②常温下,
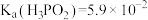 ,0.1mol/L的
,0.1mol/L的 溶液在加水稀释过程中,下列表达式的数据一定变小的是
溶液在加水稀释过程中,下列表达式的数据一定变小的是A.
 B.
B. C.
C.
(2)25℃时,HF的电离常数为
 ;
; 的电离常数为
的电离常数为 ,
,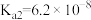 ,
, 。在
。在 溶液加入过量NaF溶液的离子反应方程式为
溶液加入过量NaF溶液的离子反应方程式为(3)盐碱地(含较多
 、NaCl)不利于植物生长,盐碱地呈碱性的原因:
、NaCl)不利于植物生长,盐碱地呈碱性的原因: 溶液中
溶液中 时,溶液的pH=
时,溶液的pH=(4)某温度下,水的离子积常数
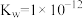 。该温度下,将pH=1的HCl溶液与pH=10的NaOH溶液混合并保持恒温,忽略混合前后溶液体积的变化。欲使混合溶液pH=3,则盐酸溶液与NaOH溶液的体积比为
。该温度下,将pH=1的HCl溶液与pH=10的NaOH溶液混合并保持恒温,忽略混合前后溶液体积的变化。欲使混合溶液pH=3,则盐酸溶液与NaOH溶液的体积比为(5)相同物质的量浓度的五种溶液:①
 、②氨水、③
、②氨水、③ 、④
、④ 、⑤
、⑤ ,
, 由大到小顺序是
由大到小顺序是
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】按要求填写下列相关内容:
(1)实验表明,液氨也能像水那样进行自耦电离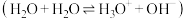 ,碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
,碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
①写出液氨自耦电离的方程式_______ 。
②写出碳酸钠溶于液氨后第一级氨解的离子方程式:_______ 。
(2)室温下 的盐酸和
的盐酸和 的碳酸钠溶液,水电离出的
的碳酸钠溶液,水电离出的 的比值为
的比值为_______ ,将二者等体积混合,溶液显_______ 性。
(3)某温度时, 的
的 溶液的
溶液的 是12,在此温度下,将
是12,在此温度下,将 的盐酸溶液
的盐酸溶液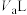 与
与 的
的 溶液
溶液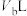 混合,所得混合液为中性,若
混合,所得混合液为中性,若 ,则
,则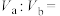
_______ 。
(4)若 水解的离子方程式为
水解的离子方程式为 ,室温下该水解反应的平衡常数
,室温下该水解反应的平衡常数
_______ 。(已知室温下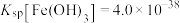 )
)
(5) 在水溶液中的电离如下:
在水溶液中的电离如下: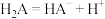 ,
, ,
,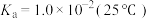
①向 溶液中滴加少量氨水,该反应的离子方程式为
溶液中滴加少量氨水,该反应的离子方程式为_______ 。
②已知 电离平衡常数
电离平衡常数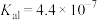 ,
, ,则
,则 和
和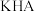 两溶液混合反应的离子方程式为
两溶液混合反应的离子方程式为_______ 。
(1)实验表明,液氨也能像水那样进行自耦电离
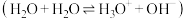 ,碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
,碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。①写出液氨自耦电离的方程式
②写出碳酸钠溶于液氨后第一级氨解的离子方程式:
(2)室温下
 的盐酸和
的盐酸和 的碳酸钠溶液,水电离出的
的碳酸钠溶液,水电离出的 的比值为
的比值为(3)某温度时,
 的
的 溶液的
溶液的 是12,在此温度下,将
是12,在此温度下,将 的盐酸溶液
的盐酸溶液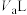 与
与 的
的 溶液
溶液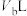 混合,所得混合液为中性,若
混合,所得混合液为中性,若 ,则
,则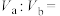
(4)若
 水解的离子方程式为
水解的离子方程式为 ,室温下该水解反应的平衡常数
,室温下该水解反应的平衡常数
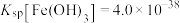 )
)(5)
 在水溶液中的电离如下:
在水溶液中的电离如下: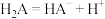 ,
, ,
,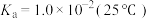
①向
 溶液中滴加少量氨水,该反应的离子方程式为
溶液中滴加少量氨水,该反应的离子方程式为②已知
 电离平衡常数
电离平衡常数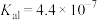 ,
, ,则
,则 和
和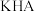 两溶液混合反应的离子方程式为
两溶液混合反应的离子方程式为
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】根据下表内容回答下列问题:
(1)电离平衡常数是衡量弱电解质电离程度强弱的量。上表中给出几种弱电解质的电离平衡常数,从中可以判断:在相同温度下,同浓度的三种酸溶液的导电能力由大到小的顺序为___________ 。
(2)盐类水解程度的强弱同样与弱电解质的电离程度有一定联系,结合表中数据回答下列问题:
①25℃时,有等浓度的a.NaCN溶液、b. 溶液、c.
溶液、c. 溶液,三种溶液的pH由大到小的顺序为
溶液,三种溶液的pH由大到小的顺序为___________ 。(填溶液前序号)
②浓度相同的NaCN溶液与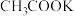 溶液相比,
溶液相比,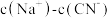
___________ 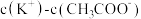 。(填“>”、“<”或“=”)
。(填“>”、“<”或“=”)
③将等体积等物质的量浓度的盐酸和氨水混合后,溶液呈___________ 性(填“酸”、“碱”或“中”),用离子方程式表示原因___________ 。
④室温下,若将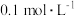 盐酸滴入
盐酸滴入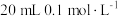 氨水中,溶液pH随加入盐酸体积的变化曲线如下图所示。b点所示溶液中的溶质是
氨水中,溶液pH随加入盐酸体积的变化曲线如下图所示。b点所示溶液中的溶质是___________ 。

⑤ 溶液呈
溶液呈___________ 性(填“酸”、“碱”或 “中”)。
(3)结合表中数据,向NaCN溶液中通入少量 ,所发生反应的化学方程式
,所发生反应的化学方程式___________ 。
| 化学式 |  | HCN |  |  |
| 电离平衡常数(25℃) | 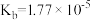 |  |  | 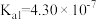 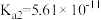 |
(2)盐类水解程度的强弱同样与弱电解质的电离程度有一定联系,结合表中数据回答下列问题:
①25℃时,有等浓度的a.NaCN溶液、b.
 溶液、c.
溶液、c. 溶液,三种溶液的pH由大到小的顺序为
溶液,三种溶液的pH由大到小的顺序为②浓度相同的NaCN溶液与
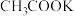 溶液相比,
溶液相比,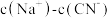
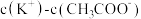 。(填“>”、“<”或“=”)
。(填“>”、“<”或“=”)③将等体积等物质的量浓度的盐酸和氨水混合后,溶液呈
④室温下,若将
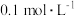 盐酸滴入
盐酸滴入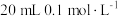 氨水中,溶液pH随加入盐酸体积的变化曲线如下图所示。b点所示溶液中的溶质是
氨水中,溶液pH随加入盐酸体积的变化曲线如下图所示。b点所示溶液中的溶质是
⑤
 溶液呈
溶液呈(3)结合表中数据,向NaCN溶液中通入少量
 ,所发生反应的化学方程式
,所发生反应的化学方程式
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐1】根据电离常数(用Kb表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
(1)氢氟酸的电离方程式为________________________ 。
(2)同浓度的HF、H2CO3、HClO三种溶液中,pH最大的是_____ (写化学式)。
(3)同浓度为0.1 mol/LHF溶液加水稀释一倍(假设温度不变),下列各量增大的是____ 。(填字母)
A.c(H+) B.c(H+)·c(OH—) C.c(H+)/c(HF) D.c(OH-)/c(H+)
(4)25℃时,现有物质的量浓度均为0.1mol/L的四种溶液: ① Na2CO3溶液 ② NaHCO3溶液 ③ NaF溶液 ④NaClO溶液。依据数据判断pH由大到小的顺序是______________ 。(用序号表示)
化学式 | HF | H2CO3 | HClO |
电离平衡常数(Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
(1)氢氟酸的电离方程式为
(2)同浓度的HF、H2CO3、HClO三种溶液中,pH最大的是
(3)同浓度为0.1 mol/LHF溶液加水稀释一倍(假设温度不变),下列各量增大的是
A.c(H+) B.c(H+)·c(OH—) C.c(H+)/c(HF) D.c(OH-)/c(H+)
(4)25℃时,现有物质的量浓度均为0.1mol/L的四种溶液: ① Na2CO3溶液 ② NaHCO3溶液 ③ NaF溶液 ④NaClO溶液。依据数据判断pH由大到小的顺序是
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】火力发电厂释放出的大量NONOx、SO2、CO2会对环境造成污染。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现节能减排、废物利用等目的。
(1)脱硝:利用甲烷催化还原NOx;
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为_____________________________________ 。
(2)脱硫:①某种脱硫工艺将废气处理后可获得硫酸铵和硝酸铵,物质的量浓度相等的硫酸铵溶液和硝酸铵溶液,前者的c(NH4+)与后者的c(NH4+)的关系是__________ 。
A.大于2倍 B.等于2倍 C.介于2倍与2倍之间 D.小于1倍
②25℃时pH均为4的硝酸铵溶液和稀硝酸中由水电离出的氢离子浓度分别为c1、c2 ,则c1与c2的比值等于_______ 。
(2)脱碳:废气中的CO2转化为甲醇(CH3OH)可用于制作甲醇燃料电池(结构如图),质子交换膜左右两侧的溶液均为1L2mol·L-1H2SO4溶液.电极c上发生的电极反应式为____ ,当电池中有1mole-发生转移时左右两侧溶液的质量之差为___ g (假设反应物a、b耗尽,忽略气体的溶解)。

(1)脱硝:利用甲烷催化还原NOx;
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为
(2)脱硫:①某种脱硫工艺将废气处理后可获得硫酸铵和硝酸铵,物质的量浓度相等的硫酸铵溶液和硝酸铵溶液,前者的c(NH4+)与后者的c(NH4+)的关系是
A.大于2倍 B.等于2倍 C.介于2倍与2倍之间 D.小于1倍
②25℃时pH均为4的硝酸铵溶液和稀硝酸中由水电离出的氢离子浓度分别为c1、c2 ,则c1与c2的比值等于
(2)脱碳:废气中的CO2转化为甲醇(CH3OH)可用于制作甲醇燃料电池(结构如图),质子交换膜左右两侧的溶液均为1L2mol·L-1H2SO4溶液.电极c上发生的电极反应式为

您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】资源化利用二氧化硫,一方面能保护环境,另一方面能提高经济效益,具有深远意义。
(1)将 通入
通入 溶液时,得到一组
溶液时,得到一组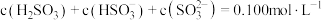 的混合溶液,溶液中部分微粒的物质的量浓度随
的混合溶液,溶液中部分微粒的物质的量浓度随 的关系曲线如下图所示。
的关系曲线如下图所示。 ,溶液中
,溶液中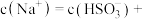
___________ ,此时溶液中
___________  。(选填“
。(选填“ ”“
”“ ”或“
”或“ ”)
”)
(2)上述混合液中存在多个水解平衡,与化学平衡一样,水解平衡也有自己的平衡常数( )。以醋酸钠(
)。以醋酸钠( )为例,其水解平衡常数存在以下定量关系:
)为例,其水解平衡常数存在以下定量关系: (
( 为水的离子积常数,
为水的离子积常数, 为
为 的电离常数)亚硫酸为二元弱酸,
的电离常数)亚硫酸为二元弱酸, 时,其电离常数
时,其电离常数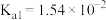 ,
,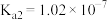 。请结合相关数据说明
。请结合相关数据说明 溶液呈酸性的理由。
溶液呈酸性的理由。___________
(1)将
 通入
通入 溶液时,得到一组
溶液时,得到一组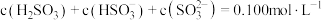 的混合溶液,溶液中部分微粒的物质的量浓度随
的混合溶液,溶液中部分微粒的物质的量浓度随 的关系曲线如下图所示。
的关系曲线如下图所示。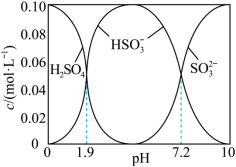
 ,溶液中
,溶液中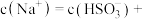

 。(选填“
。(选填“ ”“
”“ ”或“
”或“ ”)
”)(2)上述混合液中存在多个水解平衡,与化学平衡一样,水解平衡也有自己的平衡常数(
 )。以醋酸钠(
)。以醋酸钠( )为例,其水解平衡常数存在以下定量关系:
)为例,其水解平衡常数存在以下定量关系: (
( 为水的离子积常数,
为水的离子积常数, 为
为 的电离常数)亚硫酸为二元弱酸,
的电离常数)亚硫酸为二元弱酸, 时,其电离常数
时,其电离常数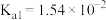 ,
,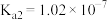 。请结合相关数据说明
。请结合相关数据说明 溶液呈酸性的理由。
溶液呈酸性的理由。
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐1】回答下列问题
(1)已知 (次磷酸)的水溶液中存在
(次磷酸)的水溶液中存在 分子。
分子。 与足量
与足量 溶液充分反应,消耗的酸和碱的物质的量相等,则生成盐的化学式为
溶液充分反应,消耗的酸和碱的物质的量相等,则生成盐的化学式为___________ 。
(2)常温下,用 溶液吸收
溶液吸收 得到
得到 的
的 溶液,吸收过程中水的电离平衡
溶液,吸收过程中水的电离平衡___________ (填“向左”、“向右”或“不”)移动。试计算该溶液中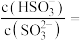
___________ (常温下 的电离平衡常数
的电离平衡常数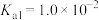 ,
, )。
)。
(3)保险粉样品中 的纯度(质量分数)可通过氧化还原滴定法来测定,反应的离子方程式为
的纯度(质量分数)可通过氧化还原滴定法来测定,反应的离子方程式为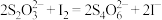 。准确称取
。准确称取 样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂。用
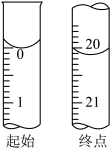
样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂。用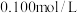 碘的标准溶液进行滴定,判断达到滴定终点的操作和现象是
碘的标准溶液进行滴定,判断达到滴定终点的操作和现象是___________ 。滴定起始和终点的液面位置如图所示。则样品的纯度为___________ 。(设 的摩尔质量为
的摩尔质量为 )
)
(4)化工生产中常用 作沉淀剂除去工业废水中的
作沉淀剂除去工业废水中的 ,其反应原理为
,其反应原理为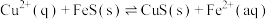 。下列有关叙述正确的是
。下列有关叙述正确的是___________ 。
a、
b、达到平衡时
c、该反应平衡常数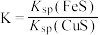
(1)已知
 (次磷酸)的水溶液中存在
(次磷酸)的水溶液中存在 分子。
分子。 与足量
与足量 溶液充分反应,消耗的酸和碱的物质的量相等,则生成盐的化学式为
溶液充分反应,消耗的酸和碱的物质的量相等,则生成盐的化学式为(2)常温下,用
 溶液吸收
溶液吸收 得到
得到 的
的 溶液,吸收过程中水的电离平衡
溶液,吸收过程中水的电离平衡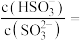
 的电离平衡常数
的电离平衡常数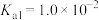 ,
, )。
)。(3)保险粉样品中
 的纯度(质量分数)可通过氧化还原滴定法来测定,反应的离子方程式为
的纯度(质量分数)可通过氧化还原滴定法来测定,反应的离子方程式为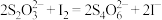 。准确称取
。准确称取 样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂。用
样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂。用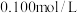 碘的标准溶液进行滴定,判断达到滴定终点的操作和现象是
碘的标准溶液进行滴定,判断达到滴定终点的操作和现象是 的摩尔质量为
的摩尔质量为 )
)
(4)化工生产中常用
 作沉淀剂除去工业废水中的
作沉淀剂除去工业废水中的 ,其反应原理为
,其反应原理为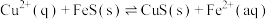 。下列有关叙述正确的是
。下列有关叙述正确的是a、

b、达到平衡时

c、该反应平衡常数
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐2】物质在水中可能存在电离平衡、水解平衡和沉淀溶解平衡。根据所学知识回答下列问题:
(1)下列方法中,可以使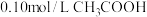 溶液中
溶液中 值增大的措施是
值增大的措施是______ (填序号)。
a.加水稀释 b.加入少量 固体
固体
c.加入少量冰醋酸 d.升高温度
(2)25℃下,有浓度均为 的三种溶液:a.
的三种溶液:a. ;b.
;b. ;C.
;C. 。(已知25℃时电离常数:
。(已知25℃时电离常数:
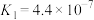 ,
, ;
;
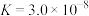 ;
;
 )
)
①三种溶液 由小到大的顺序为:
由小到大的顺序为:__________ (填序号)。
②足量的次氯酸与碳酸钠的反应离子方程式为:__________ 。
(3)已知 ,
, 。
。
①现将浓度为 溶液与
溶液与 溶液等体积混合,则生成
溶液等体积混合,则生成 沉淀所需
沉淀所需 溶液的最小浓度为
溶液的最小浓度为__________  。
。
②向含有 固体的溶液中滴加
固体的溶液中滴加 溶液,当有
溶液,当有 沉淀生成时,溶液中
沉淀生成时,溶液中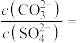
__________ (保留三位有效数字)。
(1)下列方法中,可以使
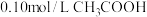 溶液中
溶液中 值增大的措施是
值增大的措施是a.加水稀释 b.加入少量
 固体
固体c.加入少量冰醋酸 d.升高温度
(2)25℃下,有浓度均为
 的三种溶液:a.
的三种溶液:a. ;b.
;b. ;C.
;C. 。(已知25℃时电离常数:
。(已知25℃时电离常数:
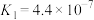 ,
, ;
;
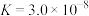 ;
;
 )
)①三种溶液
 由小到大的顺序为:
由小到大的顺序为:②足量的次氯酸与碳酸钠的反应离子方程式为:
(3)已知
 ,
, 。
。①现将浓度为
 溶液与
溶液与 溶液等体积混合,则生成
溶液等体积混合,则生成 沉淀所需
沉淀所需 溶液的最小浓度为
溶液的最小浓度为 。
。②向含有
 固体的溶液中滴加
固体的溶液中滴加 溶液,当有
溶液,当有 沉淀生成时,溶液中
沉淀生成时,溶液中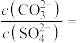
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】氨是重要的基础化工原料,工业上常用于制备氨水、亚硝酸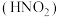 、连二次硝酸
、连二次硝酸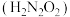 、尿素
、尿素 等多种含氮的化工产品。
等多种含氮的化工产品。
(1)已知: 时,连二次硝酸
时,连二次硝酸 的电离常数为
的电离常数为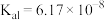 、
、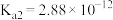 ;往
;往 溶液中滴加氢氧化钠溶液至
溶液中滴加氢氧化钠溶液至 ,
, 、
、 、离子浓度由大到小的顺序为
、离子浓度由大到小的顺序为___________ 。
(2)常温下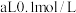 的
的 和
和 的
的 混合,混合后溶液呈中性,
混合,混合后溶液呈中性, 的电离常数为
的电离常数为___________ (用含a、b的式子表示)
(3)向浓度均为 的
的 和
和 混合液中滴加碳酸铵溶液,当加入碳酸铵溶液至生成两种沉淀,则溶液中
混合液中滴加碳酸铵溶液,当加入碳酸铵溶液至生成两种沉淀,则溶液中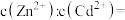
___________ 。[已知: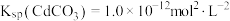 ,
,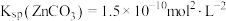 ]
]
可乐中的食品添加剂有白砂糖、二氧化碳、焦糖色、磷酸、咖啡因等。可乐的辛辣味与磷酸(化学式为 ,沸点高难挥发)有一定关系。
,沸点高难挥发)有一定关系。
(4)羟基磷灰石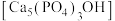 是牙釉质的主要成分,在唾液中存在平衡:
是牙釉质的主要成分,在唾液中存在平衡: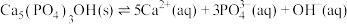 。长期过量饮用可乐会破坏牙釉质,造成龋齿。结合平衡移动原理解释原因:
。长期过量饮用可乐会破坏牙釉质,造成龋齿。结合平衡移动原理解释原因:___________
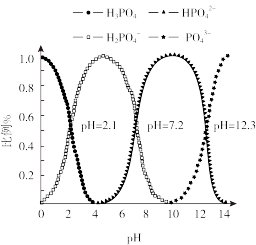
(5)常温下,向磷酸溶液中滴加 溶液,含磷微粒的分布比例与
溶液,含磷微粒的分布比例与 的关系如图所示。
的关系如图所示。 溶液显酸性,下列有关分析正确的是___________。
溶液显酸性,下列有关分析正确的是___________。
(6)联氨(又称联肼, 无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离的方程式为:
无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离的方程式为:____________ 平衡常数值为___________ (已知: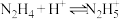 的
的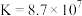 ;
;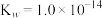 )。
)。
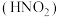 、连二次硝酸
、连二次硝酸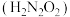 、尿素
、尿素 等多种含氮的化工产品。
等多种含氮的化工产品。(1)已知:
 时,连二次硝酸
时,连二次硝酸 的电离常数为
的电离常数为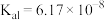 、
、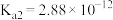 ;往
;往 溶液中滴加氢氧化钠溶液至
溶液中滴加氢氧化钠溶液至 ,
, 、
、 、离子浓度由大到小的顺序为
、离子浓度由大到小的顺序为(2)常温下
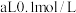 的
的 和
和 的
的 混合,混合后溶液呈中性,
混合,混合后溶液呈中性, 的电离常数为
的电离常数为(3)向浓度均为
 的
的 和
和 混合液中滴加碳酸铵溶液,当加入碳酸铵溶液至生成两种沉淀,则溶液中
混合液中滴加碳酸铵溶液,当加入碳酸铵溶液至生成两种沉淀,则溶液中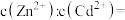
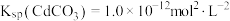 ,
,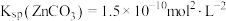 ]
]可乐中的食品添加剂有白砂糖、二氧化碳、焦糖色、磷酸、咖啡因等。可乐的辛辣味与磷酸(化学式为
 ,沸点高难挥发)有一定关系。
,沸点高难挥发)有一定关系。(4)羟基磷灰石
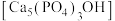 是牙釉质的主要成分,在唾液中存在平衡:
是牙釉质的主要成分,在唾液中存在平衡: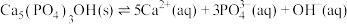 。长期过量饮用可乐会破坏牙釉质,造成龋齿。结合平衡移动原理解释原因:
。长期过量饮用可乐会破坏牙釉质,造成龋齿。结合平衡移动原理解释原因:(5)常温下,向磷酸溶液中滴加
 溶液,含磷微粒的分布比例与
溶液,含磷微粒的分布比例与 的关系如图所示。
的关系如图所示。 溶液显酸性,下列有关分析正确的是___________。
溶液显酸性,下列有关分析正确的是___________。
A.溶液中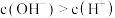 |
B. 的电离程度大于其水解程度 的电离程度大于其水解程度 |
C. c(Na+)+ c(H+)=c(H2PO )+2c(HPO )+2c(HPO )+3c(PO )+3c(PO )+c(OH—) )+c(OH—) |
| D.溶液中水的电离程度比纯水大 |
(6)联氨(又称联肼,
 无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离的方程式为:
无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离的方程式为: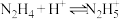 的
的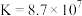 ;
;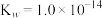 )。
)。
您最近一年使用:0次



