回答下列问题
(1)常温下,0.05mol/L硫酸溶液中,pH值为_____ ,水电离的
_____ mol/L。
(2)氨水和稀盐酸反应后的溶液呈中性,所得溶液中的离子浓度大小关系是_____ 。
(3)某温度(t℃)时,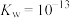 ,将此温度下pH=11的NaOH溶液aL与pH=l的
,将此温度下pH=11的NaOH溶液aL与pH=l的 溶液bL混合,若所得混合溶液为中性,则
溶液bL混合,若所得混合溶液为中性,则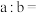
_____ ;
(4)已知 的
的 。则
。则
①某 溶液里
溶液里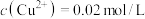 ,如要生成
,如要生成 沉淀,应调整溶液的pH大于
沉淀,应调整溶液的pH大于_____ 。
②要使0.2
 溶液中
溶液中 沉淀完全,则应向溶液里加入NaOH溶液,使溶液的pH为
沉淀完全,则应向溶液里加入NaOH溶液,使溶液的pH为_____ 。
(5)按要求写出下列基态粒子的表示式
Ti的简化电子排布式_____ ,第24号元素的价层电子的轨道表示式_____ 。
(1)常温下,0.05mol/L硫酸溶液中,pH值为

(2)氨水和稀盐酸反应后的溶液呈中性,所得溶液中的离子浓度大小关系是
(3)某温度(t℃)时,
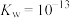 ,将此温度下pH=11的NaOH溶液aL与pH=l的
,将此温度下pH=11的NaOH溶液aL与pH=l的 溶液bL混合,若所得混合溶液为中性,则
溶液bL混合,若所得混合溶液为中性,则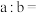
(4)已知
 的
的 。则
。则①某
 溶液里
溶液里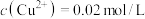 ,如要生成
,如要生成 沉淀,应调整溶液的pH大于
沉淀,应调整溶液的pH大于②要使0.2

 溶液中
溶液中 沉淀完全,则应向溶液里加入NaOH溶液,使溶液的pH为
沉淀完全,则应向溶液里加入NaOH溶液,使溶液的pH为(5)按要求写出下列基态粒子的表示式
Ti的简化电子排布式
更新时间:2023-12-05 18:38:33
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】按要求填空:
(1)①写出下列物质在水中的电离式NH4HSO3_______ ;H3PO4_______ ;
② HClO4、H2SO4、HCl、HNO3都是强酸,其酸性在水溶液中差别不大,以下是某温度下这四种酸在冰醋酸中的电离常数,下列说法不正确的是_______
A.温度会影响这四种酸在冰酸中的电离常数
B.在冰醋酸中HClO4是这四种酸中最强的酸
C.在冰醋酸中H2SO4的电离方程式为H2SO4 =2H++SO
D.这四种酸在冰醋酸中都没有完全电离,但仍属于强电解质
(2)在水的电离平衡中,c(H+)和(OH-)的关系如图所示:
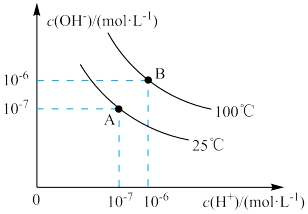
① 100℃时,若盐酸中c(H+)=5×10-4mol/L,则由水电离产生的c(H+)=_______ 。
② 25℃时,若0.015mol/L H2SO4溶液与pH=12 NaOH溶液等积混合(混合后体积变化不计),混合后的pH为_______ 。若pH=a的100体积某强酸溶液与pH=b的1体积某强碱溶液混合后溶液呈中性,则混合之前a+b=_______ 。
(1)①写出下列物质在水中的电离式NH4HSO3
② HClO4、H2SO4、HCl、HNO3都是强酸,其酸性在水溶液中差别不大,以下是某温度下这四种酸在冰醋酸中的电离常数,下列说法不正确的是
| 酸 | HClO4 | H2SO4 | HCl | HNO3 |
| Ka | 1.6×10-5 | Ka1=6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
B.在冰醋酸中HClO4是这四种酸中最强的酸
C.在冰醋酸中H2SO4的电离方程式为H2SO4 =2H++SO

D.这四种酸在冰醋酸中都没有完全电离,但仍属于强电解质
(2)在水的电离平衡中,c(H+)和(OH-)的关系如图所示:

① 100℃时,若盐酸中c(H+)=5×10-4mol/L,则由水电离产生的c(H+)=
② 25℃时,若0.015mol/L H2SO4溶液与pH=12 NaOH溶液等积混合(混合后体积变化不计),混合后的pH为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】根据要求,回答下列问题:
(1)某温度下,纯水中的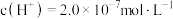 ,则该温度时的水的离子积
,则该温度时的水的离子积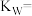
_______ 。保持温度不变,滴入稀盐酸使溶液中的 ,则溶液中的c(OH-)为
,则溶液中的c(OH-)为_______  。
。
(2)常温时,K2CO3的水溶液pH大于7,原因是(用离子方程式表示):_______ 。
(3)将AlCl3溶液蒸干、灼烧,最后所得的固体的主要成份是_______ 。
(4)物质的量浓度相同的三种盐NaX、NaY、NaZ的溶液,其pH依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是_______ 。
(5)已知:a. Ksp[Zn(OH)2]=10-17
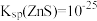
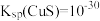
b.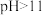 时,
时,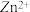 会转化为
会转化为
c.离子浓度≤10-5 mol/L,即认为其完全沉淀
①若加入 来沉淀
来沉淀 和
和 ,当溶液中
,当溶液中 和
和 共存时,
共存时,
_______ 。
②若加入 溶液来调节
溶液来调节 ,使
,使 和
和 完全沉淀,
完全沉淀, 应满足的条件为
应满足的条件为_______ 。
(1)某温度下,纯水中的
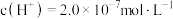 ,则该温度时的水的离子积
,则该温度时的水的离子积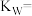
 ,则溶液中的c(OH-)为
,则溶液中的c(OH-)为 。
。(2)常温时,K2CO3的水溶液pH大于7,原因是(用离子方程式表示):
(3)将AlCl3溶液蒸干、灼烧,最后所得的固体的主要成份是
(4)物质的量浓度相同的三种盐NaX、NaY、NaZ的溶液,其pH依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是
(5)已知:a. Ksp[Zn(OH)2]=10-17

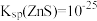
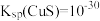
b.
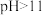 时,
时,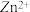 会转化为
会转化为
c.离子浓度≤10-5 mol/L,即认为其完全沉淀
①若加入
 来沉淀
来沉淀 和
和 ,当溶液中
,当溶液中 和
和 共存时,
共存时,
②若加入
 溶液来调节
溶液来调节 ,使
,使 和
和 完全沉淀,
完全沉淀, 应满足的条件为
应满足的条件为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】酸、碱、盐的水溶液在生产生活及化学实验中有广泛的应用,请同学们运用所学知识解决下列问题。
(1)某温度T下,0.1mol/L的NaOH溶液中,c(H+)=1.0×10-11mol/L,此时水的离子积常数Kw=____ 。温度T____ 25℃(填“大于”“小于”或“等于”),原因是____ 。由水电离的c(OH-)=____ mol/L。
(2)已知水溶液中c(H+)和c(OH-)的关系如图所示:

①图中A、B、C、D四点对应的水的离子积常数由大到小的顺序是____ 。
②若A点到E点,可采用的措施是____ (填序号,下同);从A点到C点,可采用的措施是____ ;促进水的电离平衡的措施是____ 。
a.升温 b.加入少量的盐酸 c.加入少量的NaOH
(3)常温下0.1mol/L的HA溶液中,c(H+)=0.001mol/L,写出HA的电离方程式____ ,水电离的c(H+)=____ mol/L。为使HA溶液中HA和H2O的电离平衡正向移动,而水的Kw保持不变可以采取的措施是____ 。
(1)某温度T下,0.1mol/L的NaOH溶液中,c(H+)=1.0×10-11mol/L,此时水的离子积常数Kw=
(2)已知水溶液中c(H+)和c(OH-)的关系如图所示:

①图中A、B、C、D四点对应的水的离子积常数由大到小的顺序是
②若A点到E点,可采用的措施是
a.升温 b.加入少量的盐酸 c.加入少量的NaOH
(3)常温下0.1mol/L的HA溶液中,c(H+)=0.001mol/L,写出HA的电离方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】常温下,浓度均为0.1 mol/L的四种溶液:
①Na2CO3溶液 ②NaHCO3溶液 ③盐酸 ④氨水
试回答下列问题:
(1)上述溶液中有水解反应发生的是________ (填编号,下同),溶液中溶质存在电离平衡的是____________ ;
(2)比较①、②溶液,pH值较大的是__________________ ;
(3)在溶液④中加入少量NH4Cl固体,此时 的值将
的值将______ (填“变小”,“变大”或“不变”);
(4)用溶液③滴定V mL溶液④,其滴定曲线如右图所示:
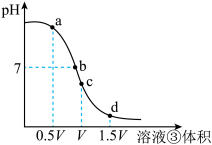
①试分析在滴定过程中,滴定曲线上a、b、c、d四点:
水的电离程度最大的是______ 点,理由是;__________________________________________________________________________ ;
②a点溶液中离子浓度大小关系是_______________________________________ ;
③取少量c点溶液于试管,再滴加0.1 mol/L NaOH溶液至中性。此时溶液中除H+、OH-外,离子浓度大小关系是___________________________ 。
①Na2CO3溶液 ②NaHCO3溶液 ③盐酸 ④氨水
试回答下列问题:
(1)上述溶液中有水解反应发生的是
(2)比较①、②溶液,pH值较大的是
(3)在溶液④中加入少量NH4Cl固体,此时
 的值将
的值将(4)用溶液③滴定V mL溶液④,其滴定曲线如右图所示:

①试分析在滴定过程中,滴定曲线上a、b、c、d四点:
水的电离程度最大的是
②a点溶液中离子浓度大小关系是
③取少量c点溶液于试管,再滴加0.1 mol/L NaOH溶液至中性。此时溶液中除H+、OH-外,离子浓度大小关系是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】根据要求回答下列问题:
(1)在25℃时,pH=9和pH=11的两种氢氧化钠溶液等体积混合后,溶液中的氢离子浓度约为___ 。
(2)FeCl2溶液蒸干并灼烧后得到的物质是_____ (填化学式)。
(3)浓度均为0.1 mol·L-1的①H2S溶液、②NaHS溶液、③Na2S溶液、④H2S和NaHS的混合溶液,各溶液pH从大到小的顺序是_____ (用序号表示)。
(4)在25℃时,现有下列四种溶液:①0.1 mol·L-1 CH3COONH4溶液,②0.1 mol·L-1 NH4SO4溶液,③0.1 mol·L-1 NH3·H2O和0.1 mol·L-1 NH4Cl的混合溶液,④0.1 mol·L-1 NH3·H2O溶液。比较①、②、③、④溶液中c( )由大到小的顺序为
)由大到小的顺序为_____ (用序号表示)。
(1)在25℃时,pH=9和pH=11的两种氢氧化钠溶液等体积混合后,溶液中的氢离子浓度约为
(2)FeCl2溶液蒸干并灼烧后得到的物质是
(3)浓度均为0.1 mol·L-1的①H2S溶液、②NaHS溶液、③Na2S溶液、④H2S和NaHS的混合溶液,各溶液pH从大到小的顺序是
(4)在25℃时,现有下列四种溶液:①0.1 mol·L-1 CH3COONH4溶液,②0.1 mol·L-1 NH4SO4溶液,③0.1 mol·L-1 NH3·H2O和0.1 mol·L-1 NH4Cl的混合溶液,④0.1 mol·L-1 NH3·H2O溶液。比较①、②、③、④溶液中c(
 )由大到小的顺序为
)由大到小的顺序为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】弱电解质的研究是重要课题。
(1)已知不同pH条件下,水溶液中碳元素的存在形态如图所示。下列说法不 正确的是_______

a.pH=8时,溶液中含碳元素的微粒主要是
b.A点,溶液中 和
和 浓度相同
浓度相同
c.当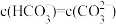 时,
时,
(2)H2CO3以及其它部分弱酸的电离平衡常数如表:
按要求回答下列问题:
①H2S、H2CO3、HClO的酸性由强到弱的顺序为_______ 。
②将少量CO2气体通入NaClO溶液中,写出该反应的离子方程式:_______ 。
③测得0.1mol·L−1BaS溶液pH≈13,溶液中OH-、S2−、HS-三种离子浓度由大到小的顺序依次是____ 。
(3)常温下,已知0.1mol/L一元酸HCOOH(甲酸)溶液中
①0.1mol/LHCOOH的pH=_______ 。
②取10mL0.1mol/L的HCOOH溶液稀释100倍,有关说法正确的是_______ (填写序号)
A.所有离子的浓度在稀释过程中都会减少
B.稀释后溶液的pH=5
C.稀释后甲酸的电离度会增大
D.与稀释前比较,稀释后水的电离程度增大
(1)已知不同pH条件下,水溶液中碳元素的存在形态如图所示。下列说法

a.pH=8时,溶液中含碳元素的微粒主要是

b.A点,溶液中
 和
和 浓度相同
浓度相同c.当
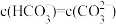 时,
时,
(2)H2CO3以及其它部分弱酸的电离平衡常数如表:
| 弱酸 | H2S | H2CO3 | HClO |
| 电离平衡常数(25℃) | 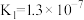 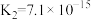 |  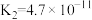 |  |
①H2S、H2CO3、HClO的酸性由强到弱的顺序为
②将少量CO2气体通入NaClO溶液中,写出该反应的离子方程式:
③测得0.1mol·L−1BaS溶液pH≈13,溶液中OH-、S2−、HS-三种离子浓度由大到小的顺序依次是
(3)常温下,已知0.1mol/L一元酸HCOOH(甲酸)溶液中

①0.1mol/LHCOOH的pH=
②取10mL0.1mol/L的HCOOH溶液稀释100倍,有关说法正确的是
A.所有离子的浓度在稀释过程中都会减少
B.稀释后溶液的pH=5
C.稀释后甲酸的电离度会增大
D.与稀释前比较,稀释后水的电离程度增大
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】已知常温下,FeS的Ksp=6.25×10-18,ZnS的Ksp=1.2×10-23,H2S的饱和溶液中c(H+)与c(S2-)之间存在如下关系:c2(H+)·c(S2-)=1.0×10-22。试回答下列有关问题:
(1)向ZnS的饱和溶液中:
①加入少量固体Na2S,则溶液中c(S2-)_______ (填“变大”、“变小”或“不变”,下同);
②加入ZnS固体,则溶液中c(S2-)_______ ;
③加入FeS固体,则溶液中c(Zn2+)_______ 。
(2)在常温下,将适量的FeS投入到氢硫酸饱和溶液中,欲使溶液中c(Fe2+)达到0.01 mol/L,应调节溶液的pH=_______ (已知:lg2=0.3)。
(1)向ZnS的饱和溶液中:
①加入少量固体Na2S,则溶液中c(S2-)
②加入ZnS固体,则溶液中c(S2-)
③加入FeS固体,则溶液中c(Zn2+)
(2)在常温下,将适量的FeS投入到氢硫酸饱和溶液中,欲使溶液中c(Fe2+)达到0.01 mol/L,应调节溶液的pH=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。根据要求回答问题。
(1)生活中明矾常作净水剂,其净水的原理是_____________ (用离子方程式表示)。
(2)常温下,取0.2 mol/L HCl溶液与0.2mol/L MOH溶液等体积混合,测得混合后溶液的pH=5,则PH=13的MOH溶液的浓度_______ 0.1mol/L(填<、>或=)。
(3)0.1mol/L的NaHA溶液,测得溶液显碱性。则
①该溶液中c(H2A)_______________ c(A2-)(填<、>或=)。
②作出上述判断的依据是_____________ (用文字解释)。
(4)含Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3mol/L的Cr2O72-。为了使废水的排放达标,进行如下处理:
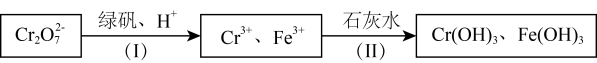
绿矾为FeSO4• 7H2O。反应(I)中Cr2O72-与FeSO4的物质的量之比为___________ 。常温下若处理后的废水中c(Cr3+)=6.0×10-7mol/L,则处理后的废水的pH=_______ 。{Ksp[Cr(OH)3]=6.0×10-31}
(1)生活中明矾常作净水剂,其净水的原理是
(2)常温下,取0.2 mol/L HCl溶液与0.2mol/L MOH溶液等体积混合,测得混合后溶液的pH=5,则PH=13的MOH溶液的浓度
(3)0.1mol/L的NaHA溶液,测得溶液显碱性。则
①该溶液中c(H2A)
②作出上述判断的依据是
(4)含Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3mol/L的Cr2O72-。为了使废水的排放达标,进行如下处理:

绿矾为FeSO4• 7H2O。反应(I)中Cr2O72-与FeSO4的物质的量之比为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】以废旧的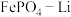 电池正极材料(含
电池正极材料(含 、
、 等)为原料,通过浸出、除铝和沉淀处理后可制备
等)为原料,通过浸出、除铝和沉淀处理后可制备 。已知:
。已知: 、
、 都容易与
都容易与 形成配合物。
形成配合物。
(1)浸出:用 溶液浸取正极材料中的铁元素。正极材料中的
溶液浸取正极材料中的铁元素。正极材料中的 与
与 反应的微观过程如图1所示。
反应的微观过程如图1所示。

 与
与 反应的化学方程式为
反应的化学方程式为_______ 。
(2)除铝:30℃时,向浸出液中加入氢氟酸,生成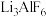 沉淀。
沉淀。
①生成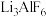 沉淀的离子方程式为
沉淀的离子方程式为_______ 。
②研究发现,铝元素去除率随溶液初始 变化如图2所示。当溶液初始
变化如图2所示。当溶液初始 为
为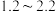 范围时,铝元素去除率先上升后降低的可能原因是
范围时,铝元素去除率先上升后降低的可能原因是_______ 。
(3)沉淀:向除铝后溶液中加入一定量的 溶液,生成
溶液,生成 沉淀。
沉淀。
①为确定加入 的量,需先用
的量,需先用 标准溶液测定溶液中的
标准溶液测定溶液中的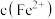 ,反应的离子方程式如下:
,反应的离子方程式如下: (未配平)。现滴定
(未配平)。现滴定 溶液中
溶液中 ,消耗
,消耗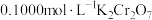 溶液
溶液 ,则溶液中
,则溶液中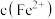 为
为_______  (写出计算过程)。
(写出计算过程)。
②欲使溶液中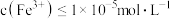 ,
,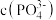 最小为
最小为_______  。(已知:室温下,
。(已知:室温下,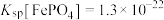 。)
。)
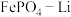 电池正极材料(含
电池正极材料(含 、
、 等)为原料,通过浸出、除铝和沉淀处理后可制备
等)为原料,通过浸出、除铝和沉淀处理后可制备 。已知:
。已知: 、
、 都容易与
都容易与 形成配合物。
形成配合物。(1)浸出:用
 溶液浸取正极材料中的铁元素。正极材料中的
溶液浸取正极材料中的铁元素。正极材料中的 与
与 反应的微观过程如图1所示。
反应的微观过程如图1所示。
 与
与 反应的化学方程式为
反应的化学方程式为(2)除铝:30℃时,向浸出液中加入氢氟酸,生成
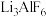 沉淀。
沉淀。①生成
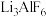 沉淀的离子方程式为
沉淀的离子方程式为②研究发现,铝元素去除率随溶液初始
 变化如图2所示。当溶液初始
变化如图2所示。当溶液初始 为
为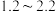 范围时,铝元素去除率先上升后降低的可能原因是
范围时,铝元素去除率先上升后降低的可能原因是(3)沉淀:向除铝后溶液中加入一定量的
 溶液,生成
溶液,生成 沉淀。
沉淀。①为确定加入
 的量,需先用
的量,需先用 标准溶液测定溶液中的
标准溶液测定溶液中的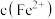 ,反应的离子方程式如下:
,反应的离子方程式如下: (未配平)。现滴定
(未配平)。现滴定 溶液中
溶液中 ,消耗
,消耗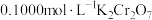 溶液
溶液 ,则溶液中
,则溶液中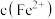 为
为 (写出计算过程)。
(写出计算过程)。②欲使溶液中
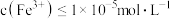 ,
,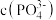 最小为
最小为 。(已知:室温下,
。(已知:室温下,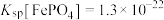 。)
。)
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】按要求回答下列问题:
(1)写出O的电子排布式:___________
(2)写出P的价层电子排布式:___________
(3)写出Cu的简化电子排布式:___________
(4)写出基态Fe2+的价电子排布图:___________
(1)写出O的电子排布式:
(2)写出P的价层电子排布式:
(3)写出Cu的简化电子排布式:
(4)写出基态Fe2+的价电子排布图:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】铬是一种重要的元素,在合金、电镀、鞣制领域都有重要的应用, 的配位能力很强,可以形成多种配离子。
的配位能力很强,可以形成多种配离子。
(1)基态Cr原子价层电子的轨道表达式为__________ ,同周期元素的基态原子最外层电子数与Cr相同的元素有__________ 种。
(2) 是最重要的铬(Ⅲ)盐之一,阴离子
是最重要的铬(Ⅲ)盐之一,阴离子 的空间构型为
的空间构型为__________ ,基态S原子核外电子中成对电子数和未成对电子数之比为__________ 。
(3)NH3、H2O、 都是常见的配体,以上配体中所含元素的电负性由大到小的顺序是
都是常见的配体,以上配体中所含元素的电负性由大到小的顺序是____________________ 。
(4) 中
中 键的数目为
键的数目为__________ ,基态N原子电子占据最高能级的电子云轮廓图为__________ 形。
(5)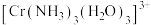 中配体
中配体 的杂化类型是
的杂化类型是__________ , 的键角
的键角__________  的键角(填“大于”、“小于”或“等于”),判断依据是
的键角(填“大于”、“小于”或“等于”),判断依据是______________________________ 。
 的配位能力很强,可以形成多种配离子。
的配位能力很强,可以形成多种配离子。(1)基态Cr原子价层电子的轨道表达式为
(2)
 是最重要的铬(Ⅲ)盐之一,阴离子
是最重要的铬(Ⅲ)盐之一,阴离子 的空间构型为
的空间构型为(3)NH3、H2O、
 都是常见的配体,以上配体中所含元素的电负性由大到小的顺序是
都是常见的配体,以上配体中所含元素的电负性由大到小的顺序是(4)
 中
中 键的数目为
键的数目为(5)
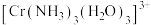 中配体
中配体 的杂化类型是
的杂化类型是 的键角
的键角 的键角(填“大于”、“小于”或“等于”),判断依据是
的键角(填“大于”、“小于”或“等于”),判断依据是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大.
某同学根据上述信息,推断
(1)画出A基态原子的核外电子排布图____________________ 。
(2)B基态原子的核外电子排布图 , 该同学所画的电子排布图违背了
, 该同学所画的电子排布图违背了____________________________________ 。
(3)D基态原子中能量最高的电子,其电子云在空间有____________ 个方向,原子轨道呈____________ 形。
(4)写出C原子的电子排布式____________ ;写出E原子的电子简化排布式____________ 。
(5)请写出F元素价电子排布式________________________ 。
| A元素原子的核外p电子数比s电子数少3 |
| B元素形成的物质种类繁多.其形成的一种固体单质工业上常用作切割工具 |
| C元素基态原子p轨道有3个未成对电子 |
| D原子核外所有p轨道全满或半满 |
| E在该周期中未成对电子数最多 |
| F能形成红色(或砖红色)和黑色的两种氧化物 |
某同学根据上述信息,推断
(1)画出A基态原子的核外电子排布图
(2)B基态原子的核外电子排布图
 , 该同学所画的电子排布图违背了
, 该同学所画的电子排布图违背了(3)D基态原子中能量最高的电子,其电子云在空间有
(4)写出C原子的电子排布式
(5)请写出F元素价电子排布式
您最近一年使用:0次



