一种废镍催化剂中含有Ni、Al、Cr、Cu、FeS及碳粉,以其为原料制备环烷酸镍[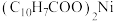 ,常温下为难溶于水的液体]的工艺流程如图所示:
,常温下为难溶于水的液体]的工艺流程如图所示:
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
回答下列问题:
(1)“灼烧”后Cr转化为 ,已知
,已知 与
与 性质相似,则滤液中阴离子有
性质相似,则滤液中阴离子有 、
、___________ 。基态Cr原子的价层电子排布式为___________ 。
(2)“酸溶”时,先加入一定量的水,然后分次加入浓硫酸,与直接用稀硫酸溶解相比,其优点是___________ 。
(3)“调pH”时,溶液pH的范围为___________ 。
(4)常温下,CuS的 极小,用
极小,用 可将
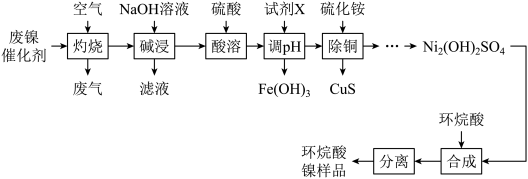
可将 完全沉淀。CuS晶胞中
完全沉淀。CuS晶胞中 的位置如图1所示,
的位置如图1所示, 位于
位于 所构成的四面体中心,晶胞侧视图如图2所示。
所构成的四面体中心,晶胞侧视图如图2所示。
①与 距离最近的
距离最近的 数目为
数目为___________ 。
②CuS的晶胞参数为apm,阿伏加德罗常数的值为 ,则CuS晶体的密度为
,则CuS晶体的密度为___________  。
。
(5)环烷酸的化学式为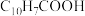 ,写出“合成”反应的化学方程式:
,写出“合成”反应的化学方程式:___________ 。
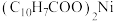 ,常温下为难溶于水的液体]的工艺流程如图所示:
,常温下为难溶于水的液体]的工艺流程如图所示:
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
| 金属离子 |  |  |  |  |
| 开始沉淀的pH | 1.9 | 7.0 | 6.4 | 5.4 |
| 完全沉淀的pH | 3.2 | 9.0 | 8.4 | 6.7 |
(1)“灼烧”后Cr转化为
 ,已知
,已知 与
与 性质相似,则滤液中阴离子有
性质相似,则滤液中阴离子有 、
、(2)“酸溶”时,先加入一定量的水,然后分次加入浓硫酸,与直接用稀硫酸溶解相比,其优点是
(3)“调pH”时,溶液pH的范围为
(4)常温下,CuS的
 极小,用
极小,用 可将
可将 完全沉淀。CuS晶胞中
完全沉淀。CuS晶胞中 的位置如图1所示,
的位置如图1所示, 位于
位于 所构成的四面体中心,晶胞侧视图如图2所示。
所构成的四面体中心,晶胞侧视图如图2所示。
①与
 距离最近的
距离最近的 数目为
数目为②CuS的晶胞参数为apm,阿伏加德罗常数的值为
 ,则CuS晶体的密度为
,则CuS晶体的密度为 。
。(5)环烷酸的化学式为
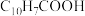 ,写出“合成”反应的化学方程式:
,写出“合成”反应的化学方程式:
更新时间:2023-10-16 09:36:16
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:
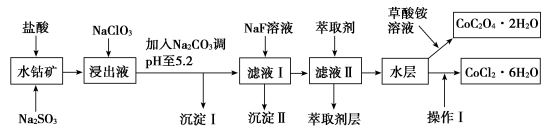
已知:①NaClO3不能氧化CoCl2
②流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
(1)浸出过程中加入Na2SO3目的是_______ 。
(2)加入Na2CO3调pH至5.2,目的是_______ ;萃取剂层含锰元素,则沉淀Ⅱ的主要成分为_______ 。
(3)操作Ⅰ包括:将水层加入浓盐酸调整pH为2~3,_______ 、_______ 、过滤、洗涤、减压烘干等过程。
(4)将5.49g草酸钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。
经测定,整个受热过程,只产生水蒸气和CO2气体,则290~320℃温度范围,剩余的固体物质化学式为_______ 。[已知:CoC2O4·2H2O的摩尔质量为183g·mol−1]

已知:①NaClO3不能氧化CoCl2
②流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)加入Na2CO3调pH至5.2,目的是
(3)操作Ⅰ包括:将水层加入浓盐酸调整pH为2~3,
(4)将5.49g草酸钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
您最近一年使用:0次
【推荐2】磷锌白[Zn3(PO4)2]可用于生产无毒防锈颜料和水溶性涂料。一种利用烧铸灰(主要含ZnO,还含少量Fe3O4、PbO、SnO2、CuO及SiO2等)为原料制取磷锌白的工艺流程如下图所示:

回答下列问题:
(1)为提高“酸溶”时锌的浸出率,可采取的措施有_______ (列举1条),“滤渣1”的主要成分为_______ (填化学式)。
(2)写出“沉锰”步骤的离子方程式:_______ 。
(3)几种金属离子开始沉淀与沉淀完全的pH如下表所示:
“调pH”为4.0的目的是除去Fe3+和_______ ,为检验“过滤2”后的滤液中是否含有Fe3+,可选用的化学试剂是_______ 。
(4)“制备”时,加Na2HPO4至Zn2+恰好沉淀完全的离子方程式为_______ 。
(5)本实验采用过量的锌粉除去铜离子杂质,还可以通入H2S除铜离子,当通入H2S达到饱和时测得溶液的pH = 1,此时溶液中c(Cu2+)为_______ 。[已知:25℃,H2S溶于水形成饱和溶液时,c(H2S) = 0.1 mol/L;H2S的电离平衡常数Ka1 = 1×10−7,Ka2 = 1×10−13;Ksp(CuS) = 6×10−36]
(6)某工厂用7 t烧铸灰(氧化锌的质量分数为81%)进行上述工艺流程,最终制得Zn3(PO4)2 7.7 t,则产率为_______ (保留三位有效数字)。

回答下列问题:
(1)为提高“酸溶”时锌的浸出率,可采取的措施有
(2)写出“沉锰”步骤的离子方程式:
(3)几种金属离子开始沉淀与沉淀完全的pH如下表所示:
| 金属离子 | Sn4+ | Fe3+ | Cu2+ | Zn2+ |
| 开始沉淀的pH | 0.5 | 2.2 | 4.8 | 6.5 |
| 沉淀完全的pH | 1.3 | 3.6 | 6.4 | 8.5 |
(4)“制备”时,加Na2HPO4至Zn2+恰好沉淀完全的离子方程式为
(5)本实验采用过量的锌粉除去铜离子杂质,还可以通入H2S除铜离子,当通入H2S达到饱和时测得溶液的pH = 1,此时溶液中c(Cu2+)为
(6)某工厂用7 t烧铸灰(氧化锌的质量分数为81%)进行上述工艺流程,最终制得Zn3(PO4)2 7.7 t,则产率为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】实验室以工业钴渣为原料制取CoSO4溶液和ZnSO4·7H2O晶体,其实验流程如下:
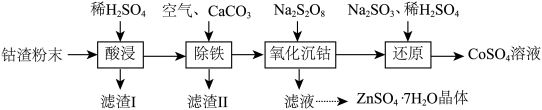
已知:①“酸浸”所得溶液中主要含CoSO4、ZnSO4,另含少量FeSO4、NiSO4。②金属活动性:Ni介于Fe、Cu之间。③下表是相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度1 mol·L-1计算,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-):
(1)“酸浸”时所加稀硫酸不宜过量太多的原因是________ 。
(2)“除铁”时,向溶液中持续鼓入空气的作用是________ 。
(3)流程中需将滤渣Ⅰ、滤渣Ⅱ的洗涤液与“除铁”后所得滤液合并,目的是________ 。
(4)写出“还原”过程中Na2SO3、稀H2SO4与Co(OH)3反应的离子方程式:________ 。
(5)实验所得CoSO4溶液可用于制备CoCO3,制备时CoSO4饱和溶液与Na2CO3饱和溶液的混合方式为________ 。
(6)请结合如图硫酸锌晶体的溶解度曲线,设计从“氧化沉钴”后的滤液(含ZnSO4、Na2SO4、NiSO4等)中获取ZnSO4·7H2O的实验方案:取适量滤液,____________________________ ,过滤,用少量冰水洗涤,低温干燥得ZnSO4·7H2O晶体。(实验中须使用的试剂有:Zn粉、1.0 mol·L-1 NaOH、1.0 mol·L-1 H2SO4)


已知:①“酸浸”所得溶液中主要含CoSO4、ZnSO4,另含少量FeSO4、NiSO4。②金属活动性:Ni介于Fe、Cu之间。③下表是相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度1 mol·L-1计算,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-):
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
| Co2+ | 7.6 | 9.4 |
| Zn2+ | 5.9 | 8.9 |
(2)“除铁”时,向溶液中持续鼓入空气的作用是
(3)流程中需将滤渣Ⅰ、滤渣Ⅱ的洗涤液与“除铁”后所得滤液合并,目的是
(4)写出“还原”过程中Na2SO3、稀H2SO4与Co(OH)3反应的离子方程式:
(5)实验所得CoSO4溶液可用于制备CoCO3,制备时CoSO4饱和溶液与Na2CO3饱和溶液的混合方式为
(6)请结合如图硫酸锌晶体的溶解度曲线,设计从“氧化沉钴”后的滤液(含ZnSO4、Na2SO4、NiSO4等)中获取ZnSO4·7H2O的实验方案:取适量滤液,

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】某厂利用富锗ZnO烟尘(还含有CuO、CaO、PbO2、FeO、MnO2等)生产锗精矿和碱式碳酸锌[Zn2(OH)2CO3]。其流程如图:

已知:Ⅰ.酸浸时,锰与铅元素被还原为+2价,锗以Ge4+存在。
Ⅱ.25℃:Ksp[Fe(OH)3]=4×10-38、Ksp[Zn(OH)2]=1.2×10-17。
请回答下列问题:
(1)基态Zn2+的价层电子排布式______ 。
(2)浸渣①主要含有______ ;酸浸中PbO2与98%H2SO4反应的化学方程式为______ 。
(3)流程中,“Ⅰ”加入Zn粉主要是为了置换______ (填离子符号);常温下,“Ⅱ”控制pH最高为______ (溶液中金属离子浓度均按0.12mol•L-1计算)。
(4)沉锌的离子方程式为______ 。
(5)若ZnS晶胞沿体对角线方向投影,所得的原子投影外围图形为正六边形,如图乙所示,请用“ ”在图乙中标出晶胞中4个Zn原子的投影位置
”在图乙中标出晶胞中4个Zn原子的投影位置______ ;设晶胞中S离子与其最近的Zn离子的距离为dnm,其密度为ρg•cm-3,阿伏加德罗常数NA为______ (用含d、ρ的式子表示)。


已知:Ⅰ.酸浸时,锰与铅元素被还原为+2价,锗以Ge4+存在。
Ⅱ.25℃:Ksp[Fe(OH)3]=4×10-38、Ksp[Zn(OH)2]=1.2×10-17。
请回答下列问题:
(1)基态Zn2+的价层电子排布式
(2)浸渣①主要含有
(3)流程中,“Ⅰ”加入Zn粉主要是为了置换
(4)沉锌的离子方程式为
(5)若ZnS晶胞沿体对角线方向投影,所得的原子投影外围图形为正六边形,如图乙所示,请用“
 ”在图乙中标出晶胞中4个Zn原子的投影位置
”在图乙中标出晶胞中4个Zn原子的投影位置
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】早在2000多年前我国已掌握铜镍合金的冶炼,但直到250年前才有科学家制得单质镍。回答下列问题:
(1)基态镍原子的价电子排布式为_______ 。基态铜、镍原子的第二电离能分别为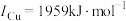 、
、 、
、 的原因是
的原因是_______ 。
(2)丁二铜肟常用于检验 。在稀氨水介质中,丁二酮肟与
。在稀氨水介质中,丁二酮肟与 反应生成鲜红色沉淀,其结构如图所示,该物质中:
反应生成鲜红色沉淀,其结构如图所示,该物质中:

①非金属元素电负性由大到小的顺序为_______ 。
②氢氧原子间存在_______ 作用。
③ 的配位数为
的配位数为_______ 。
④已知: 和N位于同一平面。可采用配合物的杂化轨道理论进行解释:
和N位于同一平面。可采用配合物的杂化轨道理论进行解释: 原有d电子可违反洪特规则进行重排,再利用外层空轨道杂化后接受N原子提供的孤对电子。则推测
原有d电子可违反洪特规则进行重排,再利用外层空轨道杂化后接受N原子提供的孤对电子。则推测 采用的杂化轨道类型为
采用的杂化轨道类型为_______ (填字母标号)。
A. B.
B. C.
C. D.
D.
(3)二元铜镍固溶体称为普通白铜,其晶胞结构如图。
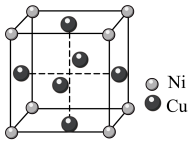
已知立方晶胞边长为acm,阿伏加德罗常数为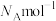 。
。
①该晶体类型为_______ ,Cu与Cu之间的最近距离为_______ pm。
②该晶体密度为_______  (用含
(用含 、a的式子表示)。
、a的式子表示)。
(1)基态镍原子的价电子排布式为
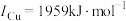 、
、 、
、 的原因是
的原因是(2)丁二铜肟常用于检验
 。在稀氨水介质中,丁二酮肟与
。在稀氨水介质中,丁二酮肟与 反应生成鲜红色沉淀,其结构如图所示,该物质中:
反应生成鲜红色沉淀,其结构如图所示,该物质中:
①非金属元素电负性由大到小的顺序为
②氢氧原子间存在
③
 的配位数为
的配位数为④已知:
 和N位于同一平面。可采用配合物的杂化轨道理论进行解释:
和N位于同一平面。可采用配合物的杂化轨道理论进行解释: 原有d电子可违反洪特规则进行重排,再利用外层空轨道杂化后接受N原子提供的孤对电子。则推测
原有d电子可违反洪特规则进行重排,再利用外层空轨道杂化后接受N原子提供的孤对电子。则推测 采用的杂化轨道类型为
采用的杂化轨道类型为A.
 B.
B. C.
C.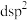 D.
D.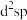
(3)二元铜镍固溶体称为普通白铜,其晶胞结构如图。

已知立方晶胞边长为acm,阿伏加德罗常数为
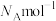 。
。①该晶体类型为
②该晶体密度为
 (用含
(用含 、a的式子表示)。
、a的式子表示)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】前四周期元素A、B、C、D、E、F原子序数依次增大,其相关性质如下表所示:
请根据以上情况,回答下列问题:
(1)E元素基态原子核外有__ 种能量不同的电子,电子排布式为__ ,画出F元素基态原子的价电子排布图___ 。
(2)与B相邻的同周期元素的第一电离能由大到小的顺序为___ 。(用元素符号表示)
(3)B、C、D三种元素的简单离子的半径由小到大的顺序为___ (用离子符号表示)。
| A | 2p能级电子半充满 |
| B | 与A同周期,且原子核外有2个未成对电子 |
| C | 基态原子核外有6个原子轨道排有电子,且只有1个未成对电子 |
| D | 其基态原子外围电子排布为msnmpn+2 |
| E | 前四周期元素中,E元素基态原子未成对电子数最多 |
| F | 基态F+各能级电子全充满 |
请根据以上情况,回答下列问题:
(1)E元素基态原子核外有
(2)与B相邻的同周期元素的第一电离能由大到小的顺序为
(3)B、C、D三种元素的简单离子的半径由小到大的顺序为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】金属及其化合物在化工、医药、材料等领域有着广泛的应用。请回答下列问题:
(1)与Fe最外层电子数相同且同周期的过渡元素有___________ 种。
(2)次磷酸的正盐KH2PO2中P的___________ 杂化轨道与O的___________ 轨道形成 键。
键。
(3)Zn、Fe、Cu等过渡金属的原子或离子易通过配位键形成配合物或配离子。
①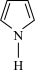 和
和 中所有原子均共面,其中氮原子较易形成配位键的是
中所有原子均共面,其中氮原子较易形成配位键的是___________ 。
②配位原子提供孤电子对的能力与元素的电负性大小有关,元素电负性越大,其原子越不容易提供孤电子对。则对于配合物Fe(SCN)3,配体SCN-中提供孤电子对的原子是___________ (填元素符号)。
③将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质,下列物质中,属于顺磁性物质的是___________ 。
A.[Cu(NH3)2]C1 B.[Cu(NH3)4]SO4
C.[Zn(NH3)4]SO4 D.[Cr(H2O)5Cl]Cl2
(4)硫化锌(ZnS)晶体属于六方晶系,Zn原子位于4个S原子形成的正四面体空隙中。晶胞参数如图所示α=120°,β=γ=90°。___________ 。
②已知空间利用率 ,设锌和硫的原子半径分别r1cm和r2cm,则该晶体的空间利用率为(列出计算式即可)
,设锌和硫的原子半径分别r1cm和r2cm,则该晶体的空间利用率为(列出计算式即可)___________ 。
③以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标。若A点原子的分数坐标为(0,0,0),则B点原子的分数坐标为___________ 。
(1)与Fe最外层电子数相同且同周期的过渡元素有
(2)次磷酸的正盐KH2PO2中P的
 键。
键。(3)Zn、Fe、Cu等过渡金属的原子或离子易通过配位键形成配合物或配离子。
①
 和
和 中所有原子均共面,其中氮原子较易形成配位键的是
中所有原子均共面,其中氮原子较易形成配位键的是②配位原子提供孤电子对的能力与元素的电负性大小有关,元素电负性越大,其原子越不容易提供孤电子对。则对于配合物Fe(SCN)3,配体SCN-中提供孤电子对的原子是
③将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质,下列物质中,属于顺磁性物质的是
A.[Cu(NH3)2]C1 B.[Cu(NH3)4]SO4
C.[Zn(NH3)4]SO4 D.[Cr(H2O)5Cl]Cl2
(4)硫化锌(ZnS)晶体属于六方晶系,Zn原子位于4个S原子形成的正四面体空隙中。晶胞参数如图所示α=120°,β=γ=90°。

②已知空间利用率
 ,设锌和硫的原子半径分别r1cm和r2cm,则该晶体的空间利用率为(列出计算式即可)
,设锌和硫的原子半径分别r1cm和r2cm,则该晶体的空间利用率为(列出计算式即可)③以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标。若A点原子的分数坐标为(0,0,0),则B点原子的分数坐标为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】碳硫、铝、铁是生活中常见的四种元素,根据所学知识回答下列问题:
(1)铁原子基态时核外电子排布式为__ ,三氯化铁的熔点306℃、沸点315℃,由此判断三氯化铁属于___ 晶体。
(2)碳的电负性比硫__ (填“大”“小”或“相等"),碳、氮、氧元素第一电离能由大到小的顺序为__ (填元素符号)。
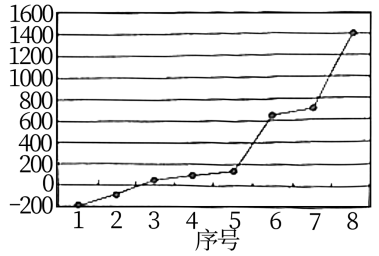
(3)硫元素所在周期的8种元素的单质熔点如图所示,其中序号“8”代表__ (填元素符号);形成最高价氧化物对应水化物酸性最强的是__ (填图中的序号)。
(4)CS2分子的空间构型为__ ,C原子的价层电子对数为__ 。
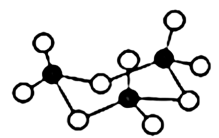
(5)固态SO3的三聚体环状结构如图所示,该结构中S原子的杂化轨道类型为__ ;该分子中含有___ 个σ键。
(6)铝单质的晶胞特征及原子之间相互位置关系如图所示,若已知铝的原子半径为dcm,NA代表阿伏加 德罗常数,铝的相对原子质量为M,则该晶体的密度为__ g/cm3(用字母表示)。

(1)铁原子基态时核外电子排布式为
(2)碳的电负性比硫
(3)硫元素所在周期的8种元素的单质熔点如图所示,其中序号“8”代表

(4)CS2分子的空间构型为
(5)固态SO3的三聚体环状结构如图所示,该结构中S原子的杂化轨道类型为

(6)铝单质的晶胞特征及原子之间相互位置关系如图所示,若已知铝的原子半径为dcm,NA代表阿伏加 德罗常数,铝的相对原子质量为M,则该晶体的密度为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】磷存在于人体所有细胞中,是维持骨骼和牙齿的必要物质,几乎参与所有生理上的化学反应。回答下列问题:
(1)基态P原子的价电子排布式为____ 。
(2)磷的一种同素异形体是白磷(P4),其分子的空间构型为____ ,键角为____ ,推测其在CS2中的溶解度____ (填“大于”“等于”或“小于”)其在水中的溶解度。
(3)两种三角锥形气态氢化物膦(PH3)和氨(NH3)的键角分别为93.6°和107°,试分析PH3的键角小于NH3的原因__________ 。
(4)常温下PCl5是一种白色晶体,其立方晶系晶胞结构模型如图所示,由A、B两种微粒构成。将其加热至148 ℃熔化,形成一种能导电的熔体。已知A、B两种微粒分别与CCl4、SF6互为等电子体,则A为____ ,其中心原子杂化轨道类型为_______ 。

(5)磷化硼(BP)是一种超硬耐磨涂层材料,如图为其立方晶胞,其中每个原子均满足8电子稳定结构,P原子的配位数为______ 。已知B—P键的键长为x cm,则磷化硼晶体的密度为____ g·cm-3(列出计算式即可)。
(1)基态P原子的价电子排布式为
(2)磷的一种同素异形体是白磷(P4),其分子的空间构型为
(3)两种三角锥形气态氢化物膦(PH3)和氨(NH3)的键角分别为93.6°和107°,试分析PH3的键角小于NH3的原因
(4)常温下PCl5是一种白色晶体,其立方晶系晶胞结构模型如图所示,由A、B两种微粒构成。将其加热至148 ℃熔化,形成一种能导电的熔体。已知A、B两种微粒分别与CCl4、SF6互为等电子体,则A为

(5)磷化硼(BP)是一种超硬耐磨涂层材料,如图为其立方晶胞,其中每个原子均满足8电子稳定结构,P原子的配位数为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】Ag、 是两种重要的化工产品。某小组以含
是两种重要的化工产品。某小组以含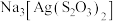 的废定影液为原料制备Ag和
的废定影液为原料制备Ag和 的流程如下。
的流程如下。
(1)现用15 mol⋅L 浓硝酸和水以体积比1∶1的比例配制100 mL的硝酸,简述其操作是
浓硝酸和水以体积比1∶1的比例配制100 mL的硝酸,简述其操作是____________ 。
(2)“焙烧”过程中发生反应的化学方程式为____________ 。
(3)“酸溶”中制备 的离子方程式为
的离子方程式为____________ 。
(4)粗银提取纯Ag分两步进行:第一步,用物理方法即______ 除去大量Fe粉;第二步,将含少量Fe粉的银溶于盐酸,经______ (填实验操作名称)、水洗、干燥得到纯银。
(5)“沉银1”发生的反应: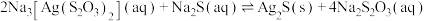 ,该反应的平衡常数
,该反应的平衡常数 为
为______ (结果保留两位有效数字)。
已知: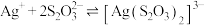 的平衡常数
的平衡常数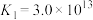 ,
,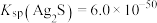 。
。
(6)利用重结晶法从“沉银1”的滤液中提取大苏打,测定大苏打纯度。称取W g产品溶于水配制成250 mL溶液,准确量取25.00 mL溶液于锥形瓶中,滴加几滴淀粉溶液,用c mol⋅L
 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液V mL。已知滴定反应:
溶液V mL。已知滴定反应: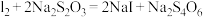 ,该产品中
,该产品中 的质量分数为
的质量分数为______ (用含c、V、W的式子表示)。三次平行实验发现,测得的产品纯度均大于实际值(实验操作均正确),其原因可能是______ 。
(7)银晶胞为面心立方最密堆积晶胞,如图所示。该晶胞中原子空间利用率为______(填标号)。(提示:原子空间利用率=原子总体积与晶胞体积之比)
 是两种重要的化工产品。某小组以含
是两种重要的化工产品。某小组以含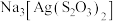 的废定影液为原料制备Ag和
的废定影液为原料制备Ag和 的流程如下。
的流程如下。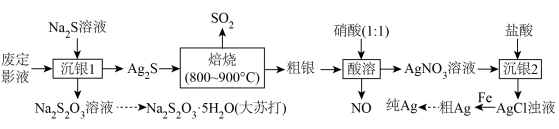
(1)现用15 mol⋅L
 浓硝酸和水以体积比1∶1的比例配制100 mL的硝酸,简述其操作是
浓硝酸和水以体积比1∶1的比例配制100 mL的硝酸,简述其操作是(2)“焙烧”过程中发生反应的化学方程式为
(3)“酸溶”中制备
 的离子方程式为
的离子方程式为(4)粗银提取纯Ag分两步进行:第一步,用物理方法即
(5)“沉银1”发生的反应:
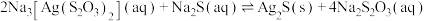 ,该反应的平衡常数
,该反应的平衡常数 为
为已知:
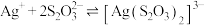 的平衡常数
的平衡常数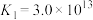 ,
,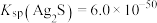 。
。(6)利用重结晶法从“沉银1”的滤液中提取大苏打,测定大苏打纯度。称取W g产品溶于水配制成250 mL溶液,准确量取25.00 mL溶液于锥形瓶中,滴加几滴淀粉溶液,用c mol⋅L

 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液V mL。已知滴定反应:
溶液V mL。已知滴定反应: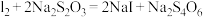 ,该产品中
,该产品中 的质量分数为
的质量分数为(7)银晶胞为面心立方最密堆积晶胞,如图所示。该晶胞中原子空间利用率为______(填标号)。(提示:原子空间利用率=原子总体积与晶胞体积之比)
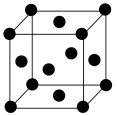
A.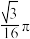 | B.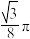 | C. | D.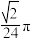 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】ClO2(黄绿色易溶于水的气体)是一种高效、低毒的消毒剂。某兴趣小组通过图1装置(夹持装置略)对其制备、吸收和释放进行了研究。

(1)仪器A的名称是_______________________ 。
(2)安装F中导管时,应选用图2中的___________________ 。
(3)A中发生反应生成ClO2和Cl2,其氧化产物和还原产物物质的量之比为__________ 。
(4)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是__________________ 。
(5)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为____ 。
(6)ClO2很不稳定,需随用随制,产物用水吸收可得到ClO2溶液。为测定所得溶液中ClO2的浓度,进行了下列实验:
步骤1:准确量取ClO2溶液10.00mL,稀释成100.00mL试样,量取V0 mL试样加入到锥形瓶中;
步骤2:用稀硫酸调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入指示剂,用c mol·L−1 Na2S2O3溶液滴定至终点。重复2次,测得消耗Na2S2O3溶液平均值为V1 mL。
(已知2ClO2+10I−+8H+=2Cl−+5I2+4H2O 2Na2S2O3+I2 Na2S4O6+2NaI)
Na2S4O6+2NaI)
计算该ClO2的浓度为______ g/L(用含字母的代数式表示,计算结果化简)。

(1)仪器A的名称是
(2)安装F中导管时,应选用图2中的
(3)A中发生反应生成ClO2和Cl2,其氧化产物和还原产物物质的量之比为
(4)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是
(5)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为
(6)ClO2很不稳定,需随用随制,产物用水吸收可得到ClO2溶液。为测定所得溶液中ClO2的浓度,进行了下列实验:
步骤1:准确量取ClO2溶液10.00mL,稀释成100.00mL试样,量取V0 mL试样加入到锥形瓶中;
步骤2:用稀硫酸调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入指示剂,用c mol·L−1 Na2S2O3溶液滴定至终点。重复2次,测得消耗Na2S2O3溶液平均值为V1 mL。
(已知2ClO2+10I−+8H+=2Cl−+5I2+4H2O 2Na2S2O3+I2
 Na2S4O6+2NaI)
Na2S4O6+2NaI)计算该ClO2的浓度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】硫酰氯(SO2Cl2)常用作氯化剂和氯磺化剂,在染料、药品、除草剂和农用杀虫剂的生产过程中有重要作用。现在拟用干燥的Cl2和SO2在活性炭催化下制取硫酰氯。反应的化学方程式为:SO2(g)+ Cl2(g) =SO2Cl2(l) ΔH =−97.3 kJ·mol−1,实验装置如图所示(部分夹持装置未画出)。
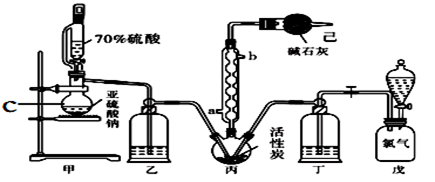
已知:硫酰氯通常条件下为无色液体,熔点−54.1℃,沸点69.1℃。在潮湿空气中“发烟”;长期放置或者100°C以上发生分解,生成二氧化硫和氯气。回答下列问题:
(1)仪器C的名称是_______________ ,冷凝管的进水方向______ (填“a”或“b”)。
(2)下列操作或描述正确的是_________________ 。
A.将70%硫酸换成98.3%硫酸,可以加快制取SO2的速率
B.实验中通过观察乙、丁导管口产生气泡的速率相等,可控制两种反应物体积相等
C.装置戊上方分液漏斗中最好选用0.10 mol·L-1NaCl溶液,减小氯气的溶解度
D.装置己防止污染,又防止硫酰氯变质
(3)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯,写出反应方程式:____________________ 。
(4)硫酰氯在潮湿空气中“发烟”,原因是_______________________ (用化学方程式表示)。
(5)若反应中消耗的二氧化硫体积为560 mL(标准状况下),最后经过分离提纯得到2.7 g纯净的硫酰氯,则硫酰氯的产率为_______ 。

已知:硫酰氯通常条件下为无色液体,熔点−54.1℃,沸点69.1℃。在潮湿空气中“发烟”;长期放置或者100°C以上发生分解,生成二氧化硫和氯气。回答下列问题:
(1)仪器C的名称是
(2)下列操作或描述正确的是
A.将70%硫酸换成98.3%硫酸,可以加快制取SO2的速率
B.实验中通过观察乙、丁导管口产生气泡的速率相等,可控制两种反应物体积相等
C.装置戊上方分液漏斗中最好选用0.10 mol·L-1NaCl溶液,减小氯气的溶解度
D.装置己防止污染,又防止硫酰氯变质
(3)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯,写出反应方程式:
(4)硫酰氯在潮湿空气中“发烟”,原因是
(5)若反应中消耗的二氧化硫体积为560 mL(标准状况下),最后经过分离提纯得到2.7 g纯净的硫酰氯,则硫酰氯的产率为
您最近一年使用:0次



