名校
1 . 完成下列问题
(1)某温度(t℃)时,水的Kw=10-13,则该温度(填大于、等于或小于)_______ 25℃,将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合,
①若所得混合溶液为中性,则a:b=_______ ;
②若所得混合溶液pH=2, 则 a:b=_______ 。
(2)在一定温度下,有a.醋酸 b.盐酸 c.硫酸 三种酸:
①同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小 的顺序是_______ ;(用a、b、c表示,下同)
②若三者c(H+)相同时,酸的物质的量浓度由大到小 的顺序为_______ ;
③将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小 的顺序是_______ 。
(1)某温度(t℃)时,水的Kw=10-13,则该温度(填大于、等于或小于)
①若所得混合溶液为中性,则a:b=
②若所得混合溶液pH=2, 则 a:b=
(2)在一定温度下,有a.醋酸 b.盐酸 c.硫酸 三种酸:
①同体积、同物质的量浓度的三种酸,中和NaOH的能力
②若三者c(H+)相同时,酸的物质的量浓度
③将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)
您最近一年使用:0次
2022-10-28更新
|
574次组卷
|
3卷引用:安徽省合肥庐巢八校2022-2023学年高二上学期12月联考化学试题
名校
解题方法
2 . (1)常温下,已知0.1mol·L-1一元酸HA溶液中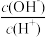 =1×108。
=1×108。
①常温下,0.1mol·L-1HA溶液的pH=___ ;写出该酸(HA)与NaOH溶液反应的离子方程式:___ 。
②0.2mol·L1HA溶液与0.1mol·L1NaOH溶液等体积混合后所得溶液中:c(H+)+c(HA)-c(OH-)=___ mol·L1。(溶液体积变化忽略不计)
(2)t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数Kw=___ 。
①该温度下(t℃),将100mL0.1mol·L1的稀H2SO4溶液与100mL0.4mol·L1的NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH=___ 。
②该温度下(t℃),1体积的稀硫酸和10体积的NaOH溶液混合后溶液呈中性,则稀硫酸的pH(pHa)与NaOH溶液的pH(pHb)的关系是:___ 。
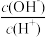 =1×108。
=1×108。①常温下,0.1mol·L-1HA溶液的pH=
②0.2mol·L1HA溶液与0.1mol·L1NaOH溶液等体积混合后所得溶液中:c(H+)+c(HA)-c(OH-)=
(2)t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数Kw=
①该温度下(t℃),将100mL0.1mol·L1的稀H2SO4溶液与100mL0.4mol·L1的NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH=
②该温度下(t℃),1体积的稀硫酸和10体积的NaOH溶液混合后溶液呈中性,则稀硫酸的pH(pHa)与NaOH溶液的pH(pHb)的关系是:
您最近一年使用:0次
解题方法
3 . (1)25 ℃时,0.05mol·L-1H2SO4溶液的pH=_______ ,0.01 mol·L-1NaOH溶液的pH=_______ 。
(2)某温度下纯水中的c(H+)=2×10-7 mol·L-1,则此时溶液中的c(OH-)=_______ ;若温度不变,滴入稀盐酸,使c(H+)=5×10-4 mol·L-1,则此时溶液中由水电离产生的c(H+)=_______ 。
(2)某温度下纯水中的c(H+)=2×10-7 mol·L-1,则此时溶液中的c(OH-)=
您最近一年使用:0次
4 . (1)某温度时,测得0.01mol﹒L-1的NaOH溶液的pH为11,则该温度下水的离子积常数Kw=___ 。
(2)在(1)所述温度下,将pH=a的NaOH溶液VaL与pH=b的硫酸VbL混合。若所得混合液的pH=10,且a=12,b=2,则Va:Vb=___ 。
(3)已知:25℃时,H2SO3Ka1=1.5×10-2Ka2=1.0×10-7;H2CO3Ka1=4.4×10-7Ka2=4.7×10-11;HNO2Ka=5.1×10-4;HClOKa=3.0×10-8下列离子反应正确的有:___ 。
A.2HCO +SO2=SO
+SO2=SO +2CO2+H2O
+2CO2+H2O
B.ClO-+CO2+H2O=HClO+HCO
C.ClO-+SO2+H2O=HClO+HSO
D.2ClO-+SO2+H2O=2HClO+SO
(4)已知:Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10。某实验小组采用K2CrO4作为指示剂,以AgNO3标准溶液滴定溶液中Cl-,利用Ag+与CrO 生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5mol/L)时,此时溶液中c(CrO
生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5mol/L)时,此时溶液中c(CrO )等于
)等于___ mol/L。
(5)已知:

①C(s)+H2O(g)=CO(g)+H2(g)ΔH=+131.3kJ﹒mol-1;
②CO2(g)+H2(g)=CO(g)+H2O(g)ΔH=+41.3kJ﹒mol-1。
则碳与水蒸气反应生成二氧化碳和氢气的热化学方程式为___ 。
(6)水煤气(主要成分CO、H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C(s)+H2O(g) CO(g)+H2(g);ΔH=+131.3kJ•mol-1。现有一个容积可变的密闭容器。恒温恒压下,向其中加入1.0mol炭和1.0mol水蒸气(H216O),发生上述反应,达到平衡时,容器的体积变为原来的1.25倍。若再补充amol(a<3)水蒸气(H218O),最终容器中C16O和C18O的物质的量之比为
CO(g)+H2(g);ΔH=+131.3kJ•mol-1。现有一个容积可变的密闭容器。恒温恒压下,向其中加入1.0mol炭和1.0mol水蒸气(H216O),发生上述反应,达到平衡时,容器的体积变为原来的1.25倍。若再补充amol(a<3)水蒸气(H218O),最终容器中C16O和C18O的物质的量之比为___ 。
(2)在(1)所述温度下,将pH=a的NaOH溶液VaL与pH=b的硫酸VbL混合。若所得混合液的pH=10,且a=12,b=2,则Va:Vb=
(3)已知:25℃时,H2SO3Ka1=1.5×10-2Ka2=1.0×10-7;H2CO3Ka1=4.4×10-7Ka2=4.7×10-11;HNO2Ka=5.1×10-4;HClOKa=3.0×10-8下列离子反应正确的有:
A.2HCO
 +SO2=SO
+SO2=SO +2CO2+H2O
+2CO2+H2OB.ClO-+CO2+H2O=HClO+HCO

C.ClO-+SO2+H2O=HClO+HSO

D.2ClO-+SO2+H2O=2HClO+SO

(4)已知:Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10。某实验小组采用K2CrO4作为指示剂,以AgNO3标准溶液滴定溶液中Cl-,利用Ag+与CrO
 生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5mol/L)时,此时溶液中c(CrO
生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5mol/L)时,此时溶液中c(CrO )等于
)等于(5)已知:

①C(s)+H2O(g)=CO(g)+H2(g)ΔH=+131.3kJ﹒mol-1;
②CO2(g)+H2(g)=CO(g)+H2O(g)ΔH=+41.3kJ﹒mol-1。
则碳与水蒸气反应生成二氧化碳和氢气的热化学方程式为
(6)水煤气(主要成分CO、H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C(s)+H2O(g)
 CO(g)+H2(g);ΔH=+131.3kJ•mol-1。现有一个容积可变的密闭容器。恒温恒压下,向其中加入1.0mol炭和1.0mol水蒸气(H216O),发生上述反应,达到平衡时,容器的体积变为原来的1.25倍。若再补充amol(a<3)水蒸气(H218O),最终容器中C16O和C18O的物质的量之比为
CO(g)+H2(g);ΔH=+131.3kJ•mol-1。现有一个容积可变的密闭容器。恒温恒压下,向其中加入1.0mol炭和1.0mol水蒸气(H216O),发生上述反应,达到平衡时,容器的体积变为原来的1.25倍。若再补充amol(a<3)水蒸气(H218O),最终容器中C16O和C18O的物质的量之比为
您最近一年使用:0次
名校
5 . 下表是不同温度下水的离子积数据:
试回答以下问题:
(1)若25<t1<t2,则a__ 1×10-14(填“>”、“<”或“=”),作此判断的理由是___ 。
(2)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4mol·L-1,取该溶液1mL加水稀释至100mL,则稀释后溶液中c(Na+):c(OH-)=___ 。
(3)在t2℃下,pH=2的稀硫酸溶液中,水电离产生的H+浓度为c(H+)水=___ 。
(4)t2℃下,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L(混合体积为原两溶液体积之和),所得混合溶液的pH=2,则V2:V1=___ 。
(5)t2℃下,取相同体积、相同pH的醋酸和盐酸,各稀释100倍后其pH大小关系为:pH(醋酸)___ pH(盐酸)(填“大于”、“小于”或“等于”。下同);稀释后溶液分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为:V(醋酸)___ V(盐酸)。
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积(mol2·L-2 ) | 1×10-14 | a | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则a
(2)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4mol·L-1,取该溶液1mL加水稀释至100mL,则稀释后溶液中c(Na+):c(OH-)=
(3)在t2℃下,pH=2的稀硫酸溶液中,水电离产生的H+浓度为c(H+)水=
(4)t2℃下,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L(混合体积为原两溶液体积之和),所得混合溶液的pH=2,则V2:V1=
(5)t2℃下,取相同体积、相同pH的醋酸和盐酸,各稀释100倍后其pH大小关系为:pH(醋酸)
您最近一年使用:0次
2019-10-31更新
|
384次组卷
|
2卷引用:安徽省霍邱县第二中学2019-2020学年高二上学期第一次月考化学试题
6 . 已知水在25℃和95℃时,水电离平衡曲线如图所示:

(1)则95℃时,水的电离平衡曲线应为B,请说明理由______________________ .
25℃时,将pH=9的NaOH溶液与pH=4的硫酸溶液混合,所得混合溶液的pH=7,则NaOH溶液与硫酸溶液的体积比为______________ 。
(2)95℃时,若100体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则a与b之间应满足的关系是______________ .
(3)曲线A所对应的温度下,pH=2的HCl溶液和pH=11的某BOH溶液中,若水的电离程度分别用α1、α2表示,则α1______________ α2(填“大于”、“小于”、“等于”或“无法确定”)。
(4)曲线B对应温度下,将0.02mol/LBa(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合后,混合溶液的pH=________________ 。

(1)则95℃时,水的电离平衡曲线应为B,请说明理由
25℃时,将pH=9的NaOH溶液与pH=4的硫酸溶液混合,所得混合溶液的pH=7,则NaOH溶液与硫酸溶液的体积比为
(2)95℃时,若100体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则a与b之间应满足的关系是
(3)曲线A所对应的温度下,pH=2的HCl溶液和pH=11的某BOH溶液中,若水的电离程度分别用α1、α2表示,则α1
(4)曲线B对应温度下,将0.02mol/LBa(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合后,混合溶液的pH=
您最近一年使用:0次
2016-12-09更新
|
384次组卷
|
3卷引用:安徽省滁州市定远县育才学校2019-2020学年高二上学期期末考试(普通班)化学试题
14-15高二上·甘肃兰州·期末
名校
解题方法
7 . 列式并计算下列各小题:
(1)某温度时,测得0.01 mol/L的NaOH溶液pH为11,求该温度下水的离子积常数Kw
(2)在此温度下,将pH=a的NaOH溶液VaL与pH=b的硫酸VbL混合。
①若所得混合溶液为中性,且a=12,b=2,求Va∶Vb。
②若所得混合溶液的pH=10,且a=12,b=2,求Va∶Vb。
(1)某温度时,测得0.01 mol/L的NaOH溶液pH为11,求该温度下水的离子积常数Kw
(2)在此温度下,将pH=a的NaOH溶液VaL与pH=b的硫酸VbL混合。
①若所得混合溶液为中性,且a=12,b=2,求Va∶Vb。
②若所得混合溶液的pH=10,且a=12,b=2,求Va∶Vb。
您最近一年使用:0次
2016-12-09更新
|
1065次组卷
|
6卷引用:安徽省芜湖市无为襄安中学2022-2023学年高二上学期12月月考化学试题
安徽省芜湖市无为襄安中学2022-2023学年高二上学期12月月考化学试题(已下线)2013-2014学年甘肃省兰州一中高二上学期期末考试化学试卷(已下线)2014-2015学年山西省山大附中高二上学期期中化学试卷2015-2016学年甘肃省兰州一中高二上学期期末化学试卷湖北省恩施州巴东县第二高级中学2019-2020学年高一下学期网课质量检测化学试题(已下线)3.2.2 溶液pH的计算(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)



