名校
解题方法
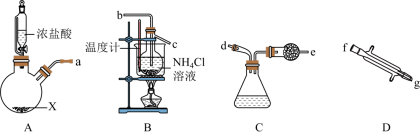
1 . 焦亚硫酸钠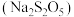 是一种抗氧化剂,受热易分解。某研究小组用下述方法制备少量
是一种抗氧化剂,受热易分解。某研究小组用下述方法制备少量 :在不断搅拌下,控制反应温度在
:在不断搅拌下,控制反应温度在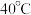 左右,向
左右,向 过饱和溶液中通入适量
过饱和溶液中通入适量 ,在
,在 左右静置结晶。实验装置如图所示。
左右静置结晶。实验装置如图所示。 的化学方程式为
的化学方程式为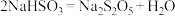 ,该反应是否为氧化还原反应
,该反应是否为氧化还原反应_______ (填“是”或“否”)。
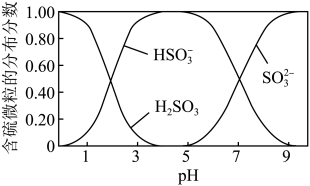
(2)已知平衡时含硫微粒的分布系数(分布系数 )与
)与 的关系如图所示。装置
的关系如图所示。装置 中,
中, 与
与 溶液反应的离子方程式为
溶液反应的离子方程式为_______ ;判定可停止通 的实验操作为
的实验操作为_______ 。
(3)装置 的作用是
的作用是_______ 。
(4)制得的 中混有
中混有 和
和 杂质,其可能的原因是
杂质,其可能的原因是_______ 。
(5)测定某葡萄酒中 残留量,取
残留量,取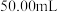 样品,用
样品,用 的碘标准液滴定至终点,消耗
的碘标准液滴定至终点,消耗 标准液。滴定反应为
标准液。滴定反应为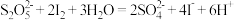 。该样品中
。该样品中 的残留量为
的残留量为_______  ;以下操作会造成
;以下操作会造成 残留量测定值偏高的是
残留量测定值偏高的是_______ (填字母)。
A.滴定终点读数时,俯视滴定管的刻度
B.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
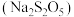 是一种抗氧化剂,受热易分解。某研究小组用下述方法制备少量
是一种抗氧化剂,受热易分解。某研究小组用下述方法制备少量 :在不断搅拌下,控制反应温度在
:在不断搅拌下,控制反应温度在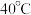 左右,向
左右,向 过饱和溶液中通入适量
过饱和溶液中通入适量 ,在
,在 左右静置结晶。实验装置如图所示。
左右静置结晶。实验装置如图所示。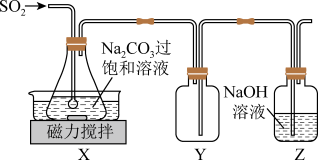
 的化学方程式为
的化学方程式为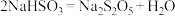 ,该反应是否为氧化还原反应
,该反应是否为氧化还原反应(2)已知平衡时含硫微粒的分布系数(分布系数
 )与
)与 的关系如图所示。装置
的关系如图所示。装置 中,
中, 与
与 溶液反应的离子方程式为
溶液反应的离子方程式为 的实验操作为
的实验操作为(3)装置
 的作用是
的作用是(4)制得的
 中混有
中混有 和
和 杂质,其可能的原因是
杂质,其可能的原因是(5)测定某葡萄酒中
 残留量,取
残留量,取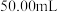 样品,用
样品,用 的碘标准液滴定至终点,消耗
的碘标准液滴定至终点,消耗 标准液。滴定反应为
标准液。滴定反应为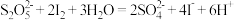 。该样品中
。该样品中 的残留量为
的残留量为 ;以下操作会造成
;以下操作会造成 残留量测定值偏高的是
残留量测定值偏高的是A.滴定终点读数时,俯视滴定管的刻度
B.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
您最近半年使用:0次
名校
2 . 三氯化铬主要用作媒染剂及催化剂,在高温下能被氧气氧化。
I.实验室以重铬酸铵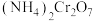 为原料合成三氯化铬
为原料合成三氯化铬
步骤1.加热使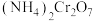 晶体分解为
晶体分解为 。
。
步骤2.取2.5 g干燥的 置于小瓷舟中(装置如下),将小瓷舟置于石英管内并使它们正好位于管式炉的中部。在锥形瓶中加入50∼60 mL
置于小瓷舟中(装置如下),将小瓷舟置于石英管内并使它们正好位于管式炉的中部。在锥形瓶中加入50∼60 mL ,然后将锥形瓶置于水浴中,并维持水浴温度60∼65℃,同时加热管式炉。当管式炉温度升至500℃左右时,开始通入适当流速的
,然后将锥形瓶置于水浴中,并维持水浴温度60∼65℃,同时加热管式炉。当管式炉温度升至500℃左右时,开始通入适当流速的 ,当管式炉加热至700℃时,停止升温,保温2小时。然后关闭管式炉电源,撤去锥形瓶下水浴,在氮气气氛中冷却。
,当管式炉加热至700℃时,停止升温,保温2小时。然后关闭管式炉电源,撤去锥形瓶下水浴,在氮气气氛中冷却。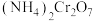 加热分解的化学方程式:
加热分解的化学方程式:___________ 。
(2)制备 时,反应管中生成
时,反应管中生成 的同时还生成有毒的、易水解的
的同时还生成有毒的、易水解的 。可用NaOH溶液吸收
。可用NaOH溶液吸收 ,其离子方程式为
,其离子方程式为___________ 。
(3)向A中通入 的作用为
的作用为___________ 、___________ 。其流速不能太快的原因是___________ 。
II.样品中三氯化铬质量分数的测定
称取样品0.3000 g,加水溶解并定容于250 mL容量瓶中。移取25.00 mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入1 g ,充分加热煮沸,适当稀释,然后加入过量2 mol⋅L
,充分加热煮沸,适当稀释,然后加入过量2 mol⋅L
 至溶液呈强酸性,此时铬以
至溶液呈强酸性,此时铬以 存在,再加入1.1 g KI,加塞摇匀,充分反应后铬以
存在,再加入1.1 g KI,加塞摇匀,充分反应后铬以 存在,于暗处静置5 min后,加入适量指示剂,用0.0250 mol⋅L
存在,于暗处静置5 min后,加入适量指示剂,用0.0250 mol⋅L 标准
标准 溶液滴定至终点,平行测定三次,平均消耗标准
溶液滴定至终点,平行测定三次,平均消耗标准 溶液21.00 mL。已知:
溶液21.00 mL。已知: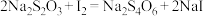 。
。
(4)下列说法正确的是___________ (填字母)。
A.该实验可选用的指示剂为淀粉溶液,滴定终点的现象是溶液由蓝色变为无色,且半分钟内不恢复蓝色
B.若实验过程中未充分加热煮沸,则测定结果偏低
C.加入KI时,发生反应的氧化剂与还原剂的物质的量之比为1∶6
(5)样品中无水三氯化铬的质量分数为___________ (保留三位有效数字)。
I.实验室以重铬酸铵
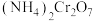 为原料合成三氯化铬
为原料合成三氯化铬步骤1.加热使
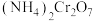 晶体分解为
晶体分解为 。
。步骤2.取2.5 g干燥的
 置于小瓷舟中(装置如下),将小瓷舟置于石英管内并使它们正好位于管式炉的中部。在锥形瓶中加入50∼60 mL
置于小瓷舟中(装置如下),将小瓷舟置于石英管内并使它们正好位于管式炉的中部。在锥形瓶中加入50∼60 mL ,然后将锥形瓶置于水浴中,并维持水浴温度60∼65℃,同时加热管式炉。当管式炉温度升至500℃左右时,开始通入适当流速的
,然后将锥形瓶置于水浴中,并维持水浴温度60∼65℃,同时加热管式炉。当管式炉温度升至500℃左右时,开始通入适当流速的 ,当管式炉加热至700℃时,停止升温,保温2小时。然后关闭管式炉电源,撤去锥形瓶下水浴,在氮气气氛中冷却。
,当管式炉加热至700℃时,停止升温,保温2小时。然后关闭管式炉电源,撤去锥形瓶下水浴,在氮气气氛中冷却。
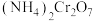 加热分解的化学方程式:
加热分解的化学方程式:(2)制备
 时,反应管中生成
时,反应管中生成 的同时还生成有毒的、易水解的
的同时还生成有毒的、易水解的 。可用NaOH溶液吸收
。可用NaOH溶液吸收 ,其离子方程式为
,其离子方程式为(3)向A中通入
 的作用为
的作用为II.样品中三氯化铬质量分数的测定
称取样品0.3000 g,加水溶解并定容于250 mL容量瓶中。移取25.00 mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入1 g
 ,充分加热煮沸,适当稀释,然后加入过量2 mol⋅L
,充分加热煮沸,适当稀释,然后加入过量2 mol⋅L
 至溶液呈强酸性,此时铬以
至溶液呈强酸性,此时铬以 存在,再加入1.1 g KI,加塞摇匀,充分反应后铬以
存在,再加入1.1 g KI,加塞摇匀,充分反应后铬以 存在,于暗处静置5 min后,加入适量指示剂,用0.0250 mol⋅L
存在,于暗处静置5 min后,加入适量指示剂,用0.0250 mol⋅L 标准
标准 溶液滴定至终点,平行测定三次,平均消耗标准
溶液滴定至终点,平行测定三次,平均消耗标准 溶液21.00 mL。已知:
溶液21.00 mL。已知: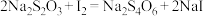 。
。(4)下列说法正确的是
A.该实验可选用的指示剂为淀粉溶液,滴定终点的现象是溶液由蓝色变为无色,且半分钟内不恢复蓝色
B.若实验过程中未充分加热煮沸,则测定结果偏低
C.加入KI时,发生反应的氧化剂与还原剂的物质的量之比为1∶6
(5)样品中无水三氯化铬的质量分数为
您最近半年使用:0次
3 . 叠氮化钠 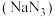 是一种应用广泛的化工产品,可用于合成抗生素头孢菌素药物的中间体、汽车安全气囊等。回答下列问题:
是一种应用广泛的化工产品,可用于合成抗生素头孢菌素药物的中间体、汽车安全气囊等。回答下列问题:
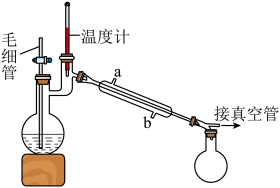
Ⅰ.实验室制备
水合肼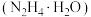 与亚硝酸甲酯
与亚硝酸甲酯 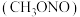 在氢氧化钠存在下制备
在氢氧化钠存在下制备  ,其反应装置如图所示:
,其反应装置如图所示: 无色无味,微溶于醇,溶于水。
无色无味,微溶于醇,溶于水。
(1)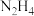 的电子式为
的电子式为_______ ; 晶体中阴离子与阳离子个数之比为
晶体中阴离子与阳离子个数之比为_______ 。
(2)装置中多孔球泡的作用是_______ 。
(3)锥形瓶中水合与亚硝酸甲酯在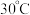 时可以反应生成叠氮化钠、甲醇等物质,写出该反应的化学方程式:
时可以反应生成叠氮化钠、甲醇等物质,写出该反应的化学方程式:_______ 。
Ⅱ.回收甲醇
将制备反应后所得混合溶液加入烧瓶中,按照图所示装置进行减压蒸馏。
①
② 在
在 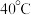 时分解。
时分解。
(4)实验时冷凝管中冷却水要_______ (填“ 进
进  出”或 “
出”或 “ 进
进  出”)。
出”)。
(5)甲醇回收时需用减压蒸馏的原因是_______ 。
Ⅲ.产品提取及纯度测定
将蒸馏后所得母液降温结晶,过滤得 湿品;再用去离子水重结晶得
湿品;再用去离子水重结晶得  产品并用碘量法测定产品纯度。取产品
产品并用碘量法测定产品纯度。取产品  加入足量去离子水中溶解,并加入适量稀硫酸酸化;向混合液中加入
加入足量去离子水中溶解,并加入适量稀硫酸酸化;向混合液中加入  溶液,溶液呈紫红色;再加入足量
溶液,溶液呈紫红色;再加入足量 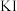 溶液消耗过量的
溶液消耗过量的 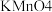 溶液;其后用
溶液;其后用 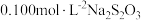 ,标准溶液滴定所产生的
,标准溶液滴定所产生的 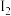 ,消耗
,消耗  溶液
溶液 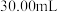 。
。
(6)实验所得产品的纯度为_______ ;若加入的 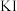 溶液有部分被空气中的氧气氧化,则测得产品的纯度
溶液有部分被空气中的氧气氧化,则测得产品的纯度_______ (填“偏低”、“偏高”、“不变”)。
已知:①产品中杂质不参与反应。
②测定过程中发生的反应:
 ;
;
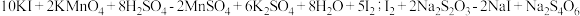 。
。
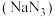 是一种应用广泛的化工产品,可用于合成抗生素头孢菌素药物的中间体、汽车安全气囊等。回答下列问题:
是一种应用广泛的化工产品,可用于合成抗生素头孢菌素药物的中间体、汽车安全气囊等。回答下列问题:Ⅰ.实验室制备

水合肼
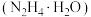 与亚硝酸甲酯
与亚硝酸甲酯 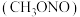 在氢氧化钠存在下制备
在氢氧化钠存在下制备  ,其反应装置如图所示:
,其反应装置如图所示:
 无色无味,微溶于醇,溶于水。
无色无味,微溶于醇,溶于水。(1)
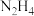 的电子式为
的电子式为 晶体中阴离子与阳离子个数之比为
晶体中阴离子与阳离子个数之比为(2)装置中多孔球泡的作用是
(3)锥形瓶中水合与亚硝酸甲酯在
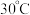 时可以反应生成叠氮化钠、甲醇等物质,写出该反应的化学方程式:
时可以反应生成叠氮化钠、甲醇等物质,写出该反应的化学方程式:Ⅱ.回收甲醇
将制备反应后所得混合溶液加入烧瓶中,按照图所示装置进行减压蒸馏。
①
| 物质 |  | 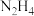 |  |
沸点  | 64.7 | 113.5 | 300 |
 在
在 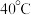 时分解。
时分解。(4)实验时冷凝管中冷却水要
 进
进  出”或 “
出”或 “ 进
进  出”)。
出”)。(5)甲醇回收时需用减压蒸馏的原因是
Ⅲ.产品提取及纯度测定
将蒸馏后所得母液降温结晶,过滤得
 湿品;再用去离子水重结晶得
湿品;再用去离子水重结晶得  产品并用碘量法测定产品纯度。取产品
产品并用碘量法测定产品纯度。取产品  加入足量去离子水中溶解,并加入适量稀硫酸酸化;向混合液中加入
加入足量去离子水中溶解,并加入适量稀硫酸酸化;向混合液中加入  溶液,溶液呈紫红色;再加入足量
溶液,溶液呈紫红色;再加入足量 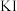 溶液消耗过量的
溶液消耗过量的 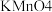 溶液;其后用
溶液;其后用 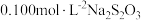 ,标准溶液滴定所产生的
,标准溶液滴定所产生的 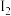 ,消耗
,消耗  溶液
溶液 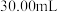 。
。(6)实验所得产品的纯度为
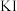 溶液有部分被空气中的氧气氧化,则测得产品的纯度
溶液有部分被空气中的氧气氧化,则测得产品的纯度已知:①产品中杂质不参与反应。
②测定过程中发生的反应:
 ;
;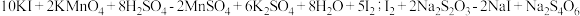 。
。
您最近半年使用:0次
4 . 在实验室可用Cl2和NH4Cl溶液反应制取NCl3,所用仪器如图所示(忽略部分夹持装置):
回答下列问题:
(1)盛装NH4Cl的仪器名称为___________ ;药品X可为___________ ;根据气流方向,各仪器的连接顺序为___________ (用各接口字母表示,各接口所需橡胶塞已省略)。
(2)待反应至油状液体不再增加,用止水夹夹住ab间的橡胶管,控制水浴加热的温度范围为___________ ,将产品NCl3蒸出。
(3) NCl3含量测定:NCl3可将HCl氧化为Cl2其化学反应方程式为___________ 。
(4)利用间接碘量法测定氯气的量即可测定NCl3的纯度。实验步骤如下:
ⅰ.准确称量C中的产物0.5g置于三颈烧瓶中,加入10mL足量浓盐酸,使用磁力搅拌器搅拌,并鼓入氮气;
ⅱ.将混合气通入200mL0.1 mol∙L-1KI溶液中,待试管中无色液体变成黄色且颜色不再变化,关闭氮气(溶液体积变化忽略不计);
ⅲ.量取20.00mL吸收液,加入淀粉指示剂,用0.1 mol∙L-1 Na2S2O3标准液进行滴定,滴定至终点时消耗Na2S2O3溶液18.00mL。(已知:反应原理为I2+2Na2S2O3=2NaI+Na2S4O6)
①确定滴定终点的现象为___________ 。
②NCl3的质量为___________ g。(精确到小数点后四位)。
回答下列问题:
(1)盛装NH4Cl的仪器名称为
(2)待反应至油状液体不再增加,用止水夹夹住ab间的橡胶管,控制水浴加热的温度范围为
(3) NCl3含量测定:NCl3可将HCl氧化为Cl2其化学反应方程式为
(4)利用间接碘量法测定氯气的量即可测定NCl3的纯度。实验步骤如下:
ⅰ.准确称量C中的产物0.5g置于三颈烧瓶中,加入10mL足量浓盐酸,使用磁力搅拌器搅拌,并鼓入氮气;
ⅱ.将混合气通入200mL0.1 mol∙L-1KI溶液中,待试管中无色液体变成黄色且颜色不再变化,关闭氮气(溶液体积变化忽略不计);
ⅲ.量取20.00mL吸收液,加入淀粉指示剂,用0.1 mol∙L-1 Na2S2O3标准液进行滴定,滴定至终点时消耗Na2S2O3溶液18.00mL。(已知:反应原理为I2+2Na2S2O3=2NaI+Na2S4O6)
①确定滴定终点的现象为
②NCl3的质量为
您最近半年使用:0次
5 . 某小组设计实验探究硫脲 异构化及异构率。回答下列问题:
异构化及异构率。回答下列问题:
实验(一)探究硫脲异构化产物成分。
资料显示:①硫脲不溶于丙酮,也不溶于水,且不导电。
② 的熔点为
的熔点为 。③在
。③在 时,
时, 异构化只有一种产物。
异构化只有一种产物。
实验步骤如下:
步骤1:取适量硫脲 加热
加热 约
约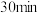 后,冷却,得到固体
后,冷却,得到固体 。
。
步骤2:用丙酮多次浸取M,测得丙酮、丙酮浸出液在室温下导电率分别为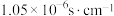 、
、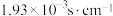 。
。
步骤3:向丙酮浸出液中滴加盐酸,出现白色沉淀 。分离
。分离 后,用丙酮洗涤5次、烘干,
后,用丙酮洗涤5次、烘干, 的熔点为
的熔点为 ,在熔点处升华。经元素分析,
,在熔点处升华。经元素分析, 只含
只含 、
、 和
和 3种元素。向分离
3种元素。向分离 后的滤液中滴加
后的滤液中滴加 溶液,溶液由无色变为红色。
溶液,溶液由无色变为红色。
(1)步骤2中,丙酮浸出液的导电率高于丙酮,其主要原因是___________ 。
(2)步骤3中,由实验现象可知,丙酮浸出液中含有的阴离子是___________ (填离子符号)。X是___________ (填化学式),丙酮中析出白色沉淀 的原因是
的原因是___________ (从物质结构与性质角度分析)。
(3)步骤3中,向丙酮浸出液中滴加盐酸,导电率与盐酸体积的关系如图所示, 处产生沉淀
处产生沉淀 的量最多。
的量最多。 段导电率增大,主要原因是滴加盐酸,盐酸增强了导电性;
段导电率增大,主要原因是滴加盐酸,盐酸增强了导电性;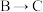 段导电率降低,其原因是
段导电率降低,其原因是___________ 。
② 段导电率增大,其原因是
段导电率增大,其原因是___________ 。
实验(二)测定硫脲异构化率。
步骤1:取 硫脲,在
硫脲,在 下熔融
下熔融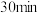 ,冷却,得到固体
,冷却,得到固体 。
。
步骤2:用适量水反复浸取固体 ,得到浸出液
,得到浸出液 。
。
步骤3:将浸出液 配制成
配制成 溶液。
溶液。
步骤4:量取 步骤3的配制溶液于锥形瓶,用
步骤3的配制溶液于锥形瓶,用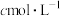 的
的 标准溶液滴定至终点(已知:
标准溶液滴定至终点(已知: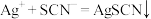 ),消耗滴定液
),消耗滴定液 。
。
(4)实验选择指示剂是___________ (填名称);本实验选择棕色滴定管,其原因是___________ 。
(5)若滴定管没有用标准溶液润洗,则测得结果___________ (填“偏高”“偏低”或“无影响”)。
 异构化及异构率。回答下列问题:
异构化及异构率。回答下列问题:实验(一)探究硫脲异构化产物成分。
资料显示:①硫脲不溶于丙酮,也不溶于水,且不导电。
②
 的熔点为
的熔点为 。③在
。③在 时,
时, 异构化只有一种产物。
异构化只有一种产物。实验步骤如下:
步骤1:取适量硫脲
 加热
加热 约
约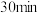 后,冷却,得到固体
后,冷却,得到固体 。
。步骤2:用丙酮多次浸取M,测得丙酮、丙酮浸出液在室温下导电率分别为
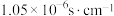 、
、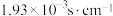 。
。步骤3:向丙酮浸出液中滴加盐酸,出现白色沉淀
 。分离
。分离 后,用丙酮洗涤5次、烘干,
后,用丙酮洗涤5次、烘干, 的熔点为
的熔点为 ,在熔点处升华。经元素分析,
,在熔点处升华。经元素分析, 只含
只含 、
、 和
和 3种元素。向分离
3种元素。向分离 后的滤液中滴加
后的滤液中滴加 溶液,溶液由无色变为红色。
溶液,溶液由无色变为红色。(1)步骤2中,丙酮浸出液的导电率高于丙酮,其主要原因是
(2)步骤3中,由实验现象可知,丙酮浸出液中含有的阴离子是
 的原因是
的原因是(3)步骤3中,向丙酮浸出液中滴加盐酸,导电率与盐酸体积的关系如图所示,
 处产生沉淀
处产生沉淀 的量最多。
的量最多。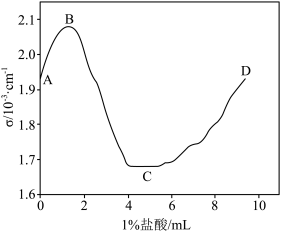
 段导电率增大,主要原因是滴加盐酸,盐酸增强了导电性;
段导电率增大,主要原因是滴加盐酸,盐酸增强了导电性;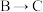 段导电率降低,其原因是
段导电率降低,其原因是②
 段导电率增大,其原因是
段导电率增大,其原因是实验(二)测定硫脲异构化率。
步骤1:取
 硫脲,在
硫脲,在 下熔融
下熔融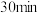 ,冷却,得到固体
,冷却,得到固体 。
。步骤2:用适量水反复浸取固体
 ,得到浸出液
,得到浸出液 。
。步骤3:将浸出液
 配制成
配制成 溶液。
溶液。步骤4:量取
 步骤3的配制溶液于锥形瓶,用
步骤3的配制溶液于锥形瓶,用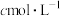 的
的 标准溶液滴定至终点(已知:
标准溶液滴定至终点(已知: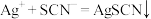 ),消耗滴定液
),消耗滴定液 。
。(4)实验选择指示剂是
(5)若滴定管没有用标准溶液润洗,则测得结果
您最近半年使用:0次
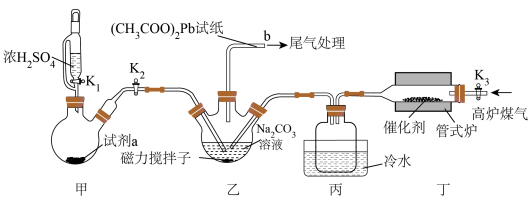
6 . 高炉煤气(主要成分为CO、N2、H2、H2S和少量COS)是炼铁过程中所得到的一种副产品,直接排放会污染空气。某化学兴趣小组利用高炉煤气和SO2制备Na2S2O3·5H2O,装置如图所示。回答下列问题: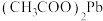 试纸可鉴别
试纸可鉴别 ,方程式为:
,方程式为: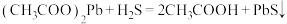 (黑色)
(黑色)
Ⅰ.Na2S2O3的制备
步骤一:关闭K1、K2,打开K3,通入高炉煤气。
发生的反应有:丁中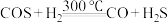 ;乙中
;乙中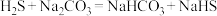 。
。
(1)当润湿的(CH3COO)2Pb试纸_____ (填现象),关闭K3,停止通入高炉煤气。
(2)导管b接盛有醋酸亚铜氨溶液的洗气瓶。醋酸亚铜氨溶液的洗气瓶用于吸收CO气体,方程式为: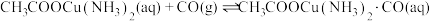
 。
。
①过量H2S会导致吸收CO的能力下降的原因是_____ 。
②将吸收液通过_____ (任写一种)的方法实现吸收液的再生,同时释放CO,达到资源再利用。
步骤二:打开K1、K2,通入SO2气体。
(3)试剂a为_____ (填化学式)。
(4)装置乙中生成Na2S2O3的化学方程式为_____ 。
(5)导管b接盛有_____ (填化学式)溶液的洗气瓶用于尾气处理。
Ⅱ.Na2S2O3·5H2O纯度的测定
(6)测定某样品中Na2S2O3·5H2O的含量的实验步骤如下(杂质不参加反应):
i.取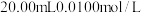 的
的 溶液,用硫酸酸化后,加入过量
溶液,用硫酸酸化后,加入过量 溶液,发生反应:
溶液,发生反应:
ii.称取 样品,配制成
样品,配制成 溶液,取该溶液滴定步骤i所得溶液(淀粉作指示剂)至终点。三次平行实验,平均消耗
溶液,取该溶液滴定步骤i所得溶液(淀粉作指示剂)至终点。三次平行实验,平均消耗 样品溶液。发生的反应为:
样品溶液。发生的反应为: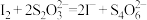
①判断步骤ii的滴定终点方法为_____ 。
②样品中Na2S2O3·5H2O的质量分数为_____ 。
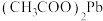 试纸可鉴别
试纸可鉴别 ,方程式为:
,方程式为: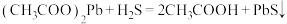 (黑色)
(黑色)Ⅰ.Na2S2O3的制备
步骤一:关闭K1、K2,打开K3,通入高炉煤气。
发生的反应有:丁中
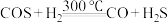 ;乙中
;乙中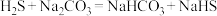 。
。(1)当润湿的(CH3COO)2Pb试纸
(2)导管b接盛有醋酸亚铜氨溶液的洗气瓶。醋酸亚铜氨溶液的洗气瓶用于吸收CO气体,方程式为:
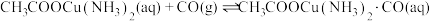
 。
。①过量H2S会导致吸收CO的能力下降的原因是
②将吸收液通过
步骤二:打开K1、K2,通入SO2气体。
(3)试剂a为
(4)装置乙中生成Na2S2O3的化学方程式为
(5)导管b接盛有
Ⅱ.Na2S2O3·5H2O纯度的测定
(6)测定某样品中Na2S2O3·5H2O的含量的实验步骤如下(杂质不参加反应):
i.取
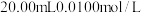 的
的 溶液,用硫酸酸化后,加入过量
溶液,用硫酸酸化后,加入过量 溶液,发生反应:
溶液,发生反应:
ii.称取
 样品,配制成
样品,配制成 溶液,取该溶液滴定步骤i所得溶液(淀粉作指示剂)至终点。三次平行实验,平均消耗
溶液,取该溶液滴定步骤i所得溶液(淀粉作指示剂)至终点。三次平行实验,平均消耗 样品溶液。发生的反应为:
样品溶液。发生的反应为: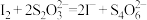
①判断步骤ii的滴定终点方法为
②样品中Na2S2O3·5H2O的质量分数为
您最近半年使用:0次
解题方法
7 . 铬酰氯(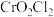 )常作有机合成的氯化剂。它的部分性质如下表所示:
)常作有机合成的氯化剂。它的部分性质如下表所示:
某小组设计如图装置利用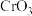 和HCl迅速反应制备铬酰氯。
和HCl迅速反应制备铬酰氯。
(1)装浓盐酸的仪器名称是___________ ,B装置作用是___________ 。
(2)A中可能看到的现象是___________ ,利用浓硫酸的性质是___________ 。
(3)C中反应的化学方程式是___________ 。
(4)有人认为,E装置可以用盛装NaOH溶液的洗气瓶替代,是否合理:___________ (填“是”或“否”),请解释原因:___________ 。
(5)利用如图装置测定铬酰氯中氯元素含量(杂质不参与反应)。 溶液,过滤,用稀硝酸酸化滤液,再加入
溶液,过滤,用稀硝酸酸化滤液,再加入 溶液,最后用
溶液,最后用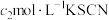 溶液滴定过量的
溶液滴定过量的 ,消耗溶液
,消耗溶液 。
。
该样品中氯元素质量分数为___________ 。如果滴定管没有润洗,测得结果会___________ (填“偏高”“偏低”或“无影响”)。
已知:常温下, ,
,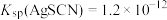 ,
,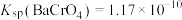 。
。
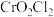 )常作有机合成的氯化剂。它的部分性质如下表所示:
)常作有机合成的氯化剂。它的部分性质如下表所示:| 物理性质 | 化学性质 |
| 熔点:-96.5℃,沸点:117℃ | 放置在空气中会迅速挥发并水解 |
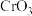 和HCl迅速反应制备铬酰氯。
和HCl迅速反应制备铬酰氯。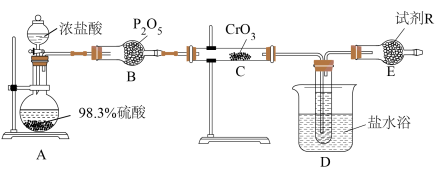
(1)装浓盐酸的仪器名称是
(2)A中可能看到的现象是
(3)C中反应的化学方程式是
(4)有人认为,E装置可以用盛装NaOH溶液的洗气瓶替代,是否合理:
(5)利用如图装置测定铬酰氯中氯元素含量(杂质不参与反应)。
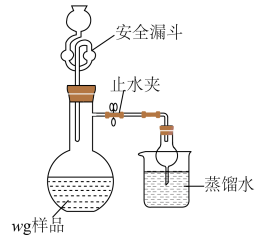
 溶液,过滤,用稀硝酸酸化滤液,再加入
溶液,过滤,用稀硝酸酸化滤液,再加入 溶液,最后用
溶液,最后用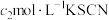 溶液滴定过量的
溶液滴定过量的 ,消耗溶液
,消耗溶液 。
。该样品中氯元素质量分数为
已知:常温下,
 ,
,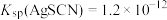 ,
,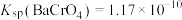 。
。
您最近半年使用:0次
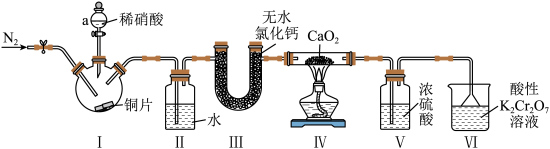
8 . 亚硝酸钙是一种白色粉末,易潮解,在钢筋混凝土工程中,主要用作水泥硬化促进剂和防冻阻锈剂。实验室中采用如图装置制取少量亚硝酸钙。
(1)装置Ⅰ中仪器a的名称是___________ ,装置中发生主要反应的化学方程式为___________ 。
(2)装置Ⅱ的作用是___________ 。
(3)如图装置中,能用来替代装置Ⅲ的是___________ (填标号)。 ,待反应结束后还需继续通入一段时间
,待反应结束后还需继续通入一段时间 ,两次通
,两次通 的目的分别是
的目的分别是___________ ;___________ 。
(5)若缺少装置Ⅴ,产生的影响是___________ 。
(6)装置Ⅵ中氮元素被氧化成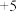 价,则反应的离子方程式为
价,则反应的离子方程式为___________ 。
(7)若所得亚硝酸钙产品中仅含少量硝酸钙杂质,可用如下实验操作测定其纯度:称量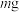 产品溶于水,先加入足量
产品溶于水,先加入足量 溶液,充分搅拌后过滤,除去
溶液,充分搅拌后过滤,除去 ,再加入适量
,再加入适量 饱和溶液,加热煮沸
饱和溶液,加热煮沸 ,将
,将 转化为
转化为 。然后向所得溶液中加入
。然后向所得溶液中加入 溶液,并用稀硫酸酸化,充分反应后用
溶液,并用稀硫酸酸化,充分反应后用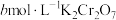 标准溶液滴定过量的
标准溶液滴定过量的 ,消耗标准溶液的体积为
,消耗标准溶液的体积为 。
。
①除去 时,反应的离子方程式为
时,反应的离子方程式为___________ 。
②计算可知,所得产品的纯度为___________ (用含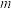 、
、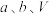 的式子表示)。
的式子表示)。
(1)装置Ⅰ中仪器a的名称是
(2)装置Ⅱ的作用是
(3)如图装置中,能用来替代装置Ⅲ的是

 ,待反应结束后还需继续通入一段时间
,待反应结束后还需继续通入一段时间 ,两次通
,两次通 的目的分别是
的目的分别是(5)若缺少装置Ⅴ,产生的影响是
(6)装置Ⅵ中氮元素被氧化成
 价,则反应的离子方程式为
价,则反应的离子方程式为(7)若所得亚硝酸钙产品中仅含少量硝酸钙杂质,可用如下实验操作测定其纯度:称量
 产品溶于水,先加入足量
产品溶于水,先加入足量 溶液,充分搅拌后过滤,除去
溶液,充分搅拌后过滤,除去 ,再加入适量
,再加入适量 饱和溶液,加热煮沸
饱和溶液,加热煮沸 ,将
,将 转化为
转化为 。然后向所得溶液中加入
。然后向所得溶液中加入 溶液,并用稀硫酸酸化,充分反应后用
溶液,并用稀硫酸酸化,充分反应后用 标准溶液滴定过量的
标准溶液滴定过量的 ,消耗标准溶液的体积为
,消耗标准溶液的体积为 。
。①除去
 时,反应的离子方程式为
时,反应的离子方程式为②计算可知,所得产品的纯度为
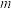 、
、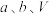 的式子表示)。
的式子表示)。
您最近半年使用:0次
名校
9 . 回答下列问题
(1)盐碱地(含较多 、NaCl)不利于植物生长,盐碱地呈碱性的原因:
、NaCl)不利于植物生长,盐碱地呈碱性的原因:___________ (用离子方程式表示)。
(2)D元素的正三价离子的3d轨道为半充满,其基态原子的价层电子排布式为___________ 。
(3)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,其基态原子的简化电子排布式为___________ ,在元素周期表中的位置是___________ 。
(4)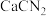 是离子化合物,各原子均满足8电子稳定结构,
是离子化合物,各原子均满足8电子稳定结构,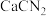 的电子式是
的电子式是___________ 。
(5)Xe是第五周期的稀有气体元素,与F形成的 室温下易升华。下列对
室温下易升华。下列对 中心原子杂化方式推断合理的是
中心原子杂化方式推断合理的是___________ (填字母)。
(6)为测定某 消毒剂样品中含氯量,用
消毒剂样品中含氯量,用 溶液滴定该样品溶液,操作如下:
溶液滴定该样品溶液,操作如下:
a.取样:取20.00 mL样品溶液置于锥形瓶,加入稀硫酸酸化,发生反应: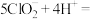
 (
( 极易溶于水);
极易溶于水);
b.氧化:加入足量碘化钾溶液,振荡充分反应;
c.滴定:加入淀粉作指示剂,在锥形瓶下垫一张白纸,用0.1000 mol/L 标准溶液滴定碘单质(已知:
标准溶液滴定碘单质(已知: );
);
d.重复上述操作三次。
滴定终点现象为:加入最后半滴 溶液后,溶液
溶液后,溶液___________ ,即到终点。
测得的实验数据如下表:
由以上数据计算该样品溶液的含氯量(以 计)
计)___________ g/L(保留三位有效数字)。滴定时,有一组数据出现了明显异常,所测含氯量偏大,原因可能有___________ (填字母序号)。
A.取样时用25.00 mL的滴定管液面在5.00 mL处放出所有溶液
B.滴定终点读数时仰视刻度线
C.达终点时滴定管尖嘴有标准液悬挂
D.盛装待测液的锥形瓶未润洗
E.摇动锥形瓶时有液体溅出
(1)盐碱地(含较多
 、NaCl)不利于植物生长,盐碱地呈碱性的原因:
、NaCl)不利于植物生长,盐碱地呈碱性的原因:(2)D元素的正三价离子的3d轨道为半充满,其基态原子的价层电子排布式为
(3)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,其基态原子的简化电子排布式为
(4)
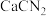 是离子化合物,各原子均满足8电子稳定结构,
是离子化合物,各原子均满足8电子稳定结构,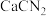 的电子式是
的电子式是(5)Xe是第五周期的稀有气体元素,与F形成的
 室温下易升华。下列对
室温下易升华。下列对 中心原子杂化方式推断合理的是
中心原子杂化方式推断合理的是| A.sp | B. | C. | D. |
 消毒剂样品中含氯量,用
消毒剂样品中含氯量,用 溶液滴定该样品溶液,操作如下:
溶液滴定该样品溶液,操作如下:a.取样:取20.00 mL样品溶液置于锥形瓶,加入稀硫酸酸化,发生反应:
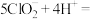
 (
( 极易溶于水);
极易溶于水);b.氧化:加入足量碘化钾溶液,振荡充分反应;
c.滴定:加入淀粉作指示剂,在锥形瓶下垫一张白纸,用0.1000 mol/L
 标准溶液滴定碘单质(已知:
标准溶液滴定碘单质(已知: );
);d.重复上述操作三次。
滴定终点现象为:加入最后半滴
 溶液后,溶液
溶液后,溶液测得的实验数据如下表:
| 实验序号 | 待测液体积(mL) |  标准溶液 标准溶液 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 20.00 | 0.06 | 20.60 |
| 2 | 20.00 | 6.00 | 25.95 |
| 3 | 20.00 | 1.40 | 23.20 |
| 4 | 20.00 | 1.00 | 21.05 |
 计)
计)A.取样时用25.00 mL的滴定管液面在5.00 mL处放出所有溶液
B.滴定终点读数时仰视刻度线
C.达终点时滴定管尖嘴有标准液悬挂
D.盛装待测液的锥形瓶未润洗
E.摇动锥形瓶时有液体溅出
您最近半年使用:0次
解题方法
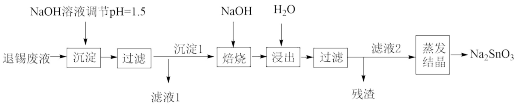
10 . 电子印制工业产生的某退锡废液含硝酸、锡化合物及少量Fe3+和Cu2+等,对其处理的流程如图。
(1)Na2SnO3的回收
①产品Na2SnO3中Sn的化合价是___________ 。
②退锡工艺是利用稀HNO3与Sn反应生成Sn2+,且无气体生成,则生成的硝酸盐是___________ ,废液中的Sn2+易转化成SnO2·xH2O。
③沉淀1的主要成分是SnO2,焙烧时,与NaOH反应的化学方程式为___________ 。
(2)滤液1的处理
①滤液1中Fe3+和Cu2+的浓度相近,加入NaOH溶液,先得到的沉淀是___________ 。
②25℃时,为了使Cu2+沉淀完全,需调节溶液H+浓度不大于___________ mol•L-1.
(3)产品中锡含量的测定
称取产品1.500g,用大量盐酸溶解,在CO2保护下,先用Al片将Sn4+还原为Sn2+,再用0.1000mol•L-1KIO3标准溶液滴定,以淀粉作指示剂滴定过程中IO 被还原为I—,终点时消耗KIO3溶液20.00mL。
被还原为I—,终点时消耗KIO3溶液20.00mL。
终点时的现象为___________ ,产生I2的离子反应方程式为___________ 。
| 化学式 | Sn(OH)4(或SnO2·2H2O) | Fe(OH)3 | Cu(OH)2 |
| 溶度积 | 1.0×10-56 | 4×10-38 | 2.5×10-20 |
①产品Na2SnO3中Sn的化合价是
②退锡工艺是利用稀HNO3与Sn反应生成Sn2+,且无气体生成,则生成的硝酸盐是
③沉淀1的主要成分是SnO2,焙烧时,与NaOH反应的化学方程式为
(2)滤液1的处理
①滤液1中Fe3+和Cu2+的浓度相近,加入NaOH溶液,先得到的沉淀是
②25℃时,为了使Cu2+沉淀完全,需调节溶液H+浓度不大于
(3)产品中锡含量的测定
称取产品1.500g,用大量盐酸溶解,在CO2保护下,先用Al片将Sn4+还原为Sn2+,再用0.1000mol•L-1KIO3标准溶液滴定,以淀粉作指示剂滴定过程中IO
 被还原为I—,终点时消耗KIO3溶液20.00mL。
被还原为I—,终点时消耗KIO3溶液20.00mL。终点时的现象为
您最近半年使用:0次



