1 . 阅读如下资料:
i.乙烯可在加热条件下催化氧化制得环氧乙烷( );具有强穿透力的环氧乙烷在常温下能杀灭微生物。
);具有强穿透力的环氧乙烷在常温下能杀灭微生物。
ii.环氧乙烷与水在加压、加热的条件下化合为乙二醇;乙二醇的熔点为-12.9℃,沸点197.3℃;能与水、丙酮等互溶。
iii.汽车铝制水箱(即散热器)中盛装的某防冻液(乙二醇与水是主要成分,体积比约1:1),沸点为108℃,冰点为-38℃;其中常加入适量NaH2PO4,用来消除水箱中严生的碱性水垢,从而提高散热效果。
iv.25℃ H3PO4Ka1=6.9×10-3,Ka2=6.2×10-8,Ka3=4.8×10-13。
结合题干信息,请按要求回答下列问题:
(1)环氧乙烷的分子式:____ ,其含有的官能团名称:____ 。
(2)乙二醇能与丙酮互溶的原因可能是乙二醇与丙酮都是极性分子,符合“相似相溶”的规律,还可能是____ 。
(3)结合ii、iii、iv中数据信息解释如下问题。
①NaH2PO4能除水垢的原因为____ ;故NaH2PO4水溶液显弱酸性,可消除碱性水垢。
②防冻液在使用一段时间后pH会降低的可能原因为____ 。
(4)结合已学知识及i、ii中信息,将如下两种合成乙二醇的路线补充完整(方框内填有机产物,箭头上填无机试剂及其反应条件)
①CH2=CH2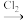
 →CH2OHCH2OH
→CH2OHCH2OH____
②CH2=CH2→ →CH2OHCH2OH
→CH2OHCH2OH____
生产乙二醇常采用路线②而不采用路线①,其可能原因(写出一种)是____ 。
i.乙烯可在加热条件下催化氧化制得环氧乙烷(
 );具有强穿透力的环氧乙烷在常温下能杀灭微生物。
);具有强穿透力的环氧乙烷在常温下能杀灭微生物。ii.环氧乙烷与水在加压、加热的条件下化合为乙二醇;乙二醇的熔点为-12.9℃,沸点197.3℃;能与水、丙酮等互溶。
iii.汽车铝制水箱(即散热器)中盛装的某防冻液(乙二醇与水是主要成分,体积比约1:1),沸点为108℃,冰点为-38℃;其中常加入适量NaH2PO4,用来消除水箱中严生的碱性水垢,从而提高散热效果。
iv.25℃ H3PO4Ka1=6.9×10-3,Ka2=6.2×10-8,Ka3=4.8×10-13。
结合题干信息,请按要求回答下列问题:
(1)环氧乙烷的分子式:
(2)乙二醇能与丙酮互溶的原因可能是乙二醇与丙酮都是极性分子,符合“相似相溶”的规律,还可能是
(3)结合ii、iii、iv中数据信息解释如下问题。
①NaH2PO4能除水垢的原因为
②防冻液在使用一段时间后pH会降低的可能原因为
(4)结合已学知识及i、ii中信息,将如下两种合成乙二醇的路线补充完整(方框内填有机产物,箭头上填无机试剂及其反应条件)
①CH2=CH2
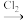
 →CH2OHCH2OH
→CH2OHCH2OH②CH2=CH2→
 →CH2OHCH2OH
→CH2OHCH2OH生产乙二醇常采用路线②而不采用路线①,其可能原因(写出一种)是
您最近一年使用:0次
2022-03-13更新
|
184次组卷
|
2卷引用:天津市河西区2021-2022学年高三上学期期末考试 化学试题
解题方法
2 . 高中化学涉及的平衡理论主要包括:化学平衡、电离平衡、水解平衡和沉淀溶解平衡等,它们在工农业生产中都有广泛的应用。请回答下列问题:
Ⅰ.化学平衡
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3(g)+CO2(g) CO(NH2)2(1)+H2O(l)
CO(NH2)2(1)+H2O(l)
(1)将2 mol NH3和1 mol CO2投到一个温度恒定、体积恒定的容器中进行上述反应,一段时间后可判断该可逆反应达到化学平衡状态的标志是_______ (填字母)。
a.2υ正(NH3) = υ逆(CO2)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d. CO2、NH3的体积分数均不再改变
(2)取一定量的NH3和CO2放在一个带活塞的密闭真空容器中在一定温度 下反应达平衡,若在恒温、恒压下充入气体He, CO(NH2)2(l)的质量_______ (填“增加”“减小”或“不变”)。
Ⅱ.电离平衡、水解平衡
(3)某温度下,纯水中c(H+)=2.0 ×10−7 mol∙L−1, 该温度下,0.09 mol∙L−1NaOH溶液与0.01 mol∙L−1 HCl溶液等体积混合(不考虑溶液体积变化)后,溶液的pH=_______ 。
(4)H2A是一种二元弱酸,25℃时不同pH,H2A、HA-、A2−的物种分布如图所示:

①向0.1 mol∙L−1H2A的溶液中逐滴滴加NaOH溶液,写出pH由3~5时所发生反应的离子方程式:_______ 。
②pH=2.2时,溶液c(H2A):c(HA-)=_______ 。
③0.1 mol∙L−1NaHA溶液显_______ (填“酸性 ”碱性”或“中性”) 。
Ⅲ.沉淀溶解平衡
(5)如图为某温度下,PbS(s)、 ZnS(s)、 FeS(s)分 别在溶液中达到沉淀溶解平衡后,溶液c(S2−)、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是_______ (填化学式)。

(6)已知常温下,FeS的Ksp= 6.3 ×10−18, H2S的饱和溶液中c(H+)与c(S2−)之间存在如下关系: c2(H+)·c(S2−)=1.0×10−22,将适量FeS投入到氢硫酸饱和溶液中,欲使溶液中c(Fe2+)达到0.063 mol∙L−1,应调节溶液的pH=_______ 。
Ⅰ.化学平衡
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3(g)+CO2(g)
 CO(NH2)2(1)+H2O(l)
CO(NH2)2(1)+H2O(l)(1)将2 mol NH3和1 mol CO2投到一个温度恒定、体积恒定的容器中进行上述反应,一段时间后可判断该可逆反应达到化学平衡状态的标志是
a.2υ正(NH3) = υ逆(CO2)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d. CO2、NH3的体积分数均不再改变
(2)取一定量的NH3和CO2放在一个带活塞的密闭真空容器中在一定温度 下反应达平衡,若在恒温、恒压下充入气体He, CO(NH2)2(l)的质量
Ⅱ.电离平衡、水解平衡
(3)某温度下,纯水中c(H+)=2.0 ×10−7 mol∙L−1, 该温度下,0.09 mol∙L−1NaOH溶液与0.01 mol∙L−1 HCl溶液等体积混合(不考虑溶液体积变化)后,溶液的pH=
(4)H2A是一种二元弱酸,25℃时不同pH,H2A、HA-、A2−的物种分布如图所示:

①向0.1 mol∙L−1H2A的溶液中逐滴滴加NaOH溶液,写出pH由3~5时所发生反应的离子方程式:
②pH=2.2时,溶液c(H2A):c(HA-)=
③0.1 mol∙L−1NaHA溶液显
Ⅲ.沉淀溶解平衡
(5)如图为某温度下,PbS(s)、 ZnS(s)、 FeS(s)分 别在溶液中达到沉淀溶解平衡后,溶液c(S2−)、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是

(6)已知常温下,FeS的Ksp= 6.3 ×10−18, H2S的饱和溶液中c(H+)与c(S2−)之间存在如下关系: c2(H+)·c(S2−)=1.0×10−22,将适量FeS投入到氢硫酸饱和溶液中,欲使溶液中c(Fe2+)达到0.063 mol∙L−1,应调节溶液的pH=
您最近一年使用:0次



