1 . 常温下,用 盐酸滴定
盐酸滴定 氨水的滴定曲线如图所示。下列说法错误的是
氨水的滴定曲线如图所示。下列说法错误的是
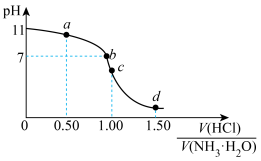
 盐酸滴定
盐酸滴定 氨水的滴定曲线如图所示。下列说法错误的是
氨水的滴定曲线如图所示。下列说法错误的是
A. 时, 时,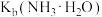 的数量级为 的数量级为 |
B. 点溶液中: 点溶液中: |
C.水的电离程度: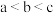 |
D. 点溶液中: 点溶液中: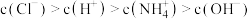 |
您最近一年使用:0次
2023-12-13更新
|
128次组卷
|
2卷引用:广东省深圳市富源学校2023-2024学年高二上学期模拟预测化学试题
解题方法
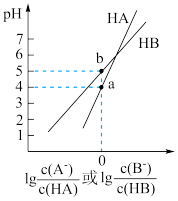
2 . 常温下,将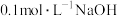 溶液分别滴加到等体积、等浓度的HA、HB两种弱酸溶液中,两溶液的pH与粒子浓度比值的对数关系如图所示。下列说法错误的是
溶液分别滴加到等体积、等浓度的HA、HB两种弱酸溶液中,两溶液的pH与粒子浓度比值的对数关系如图所示。下列说法错误的是
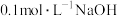 溶液分别滴加到等体积、等浓度的HA、HB两种弱酸溶液中,两溶液的pH与粒子浓度比值的对数关系如图所示。下列说法错误的是
溶液分别滴加到等体积、等浓度的HA、HB两种弱酸溶液中,两溶液的pH与粒子浓度比值的对数关系如图所示。下列说法错误的是
A. |
B.加入 溶液的体积:b<a 溶液的体积:b<a |
C.常温下,相同浓度的两种溶液的 : : |
D.a点时,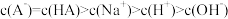 |
您最近一年使用:0次
名校
3 . 下列关于电离常数(K)的说法正确的是
| A.电离常数只与温度有关,升高温度,K值减小 |
| B.电离常数K与温度无关 |
| C.相同温度下,电离常数(K)越小,表示弱电解质的电离能力越弱 |
D.多元弱酸各步电离常数大小关系为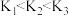 |
您最近一年使用:0次
2021-10-14更新
|
377次组卷
|
8卷引用:新疆维吾尔自治区兵团第二师华山中学2018-2019学年高二上学期第一次调研考试化学试题
新疆维吾尔自治区兵团第二师华山中学2018-2019学年高二上学期第一次调研考试化学试题【全国百强校】内蒙古集宁一中(西校区)2018-2019学年高二上学期第一次月考理科综合化学试题鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第2节 弱电解质的电离 盐类的水解 课时1 弱电解质的电离平衡(已下线)高中化学《新教材变化解读与考法剖析》第三章 水溶液中的离子反应与平衡(人教版2019选择性必修1)(已下线)3.2.2 电离平衡常数(教师版)-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)四川省江油中学2022-2023学年高二下学期第一次阶段考试化学试题北京市中关村中学2021-2022学年高二上学期期中考试化学试题广西壮族自治区贺州市平桂区平桂高级中学2019届高三摸底考试化学试题
名校
解题方法
4 . 结合下表回答下列问题(均为常温下的数据):
请回答下列问题:
(1)同浓度的CH3COO-、 、
、 、
、 、ClO-、S2-中结合H+的能力最弱的是
、ClO-、S2-中结合H+的能力最弱的是_____________ 。
(2)常温下0.1mol•L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是_____________ (填字母)。
A.c(H+) B. C.
C. D.c(OH-)
D.c(OH-)
(3)pH相同的NaClO和CH3COOK溶液,其溶液的物质的量浓度的大小关系是CH3COOK_____________ NaClO,两溶液中:c(Na+)-c(ClO)_____________ c(K+)-c(CH3COO-)(填“>”“<”或“=”)。
(4)向0.1mol•L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5∶9,此时溶液pH=_____________ 。
| 酸 | 电离常数(Ka) |
| CH3COOH | 1.8×10-5 |
| HClO | 3×10-8 |
| H2CO3 | K1=4.4×10-7 K2=4.7×10-11 |
| H2C2O4 | K1=5.4×10-2 K2=5.4×10-5 |
| H2S | K1=1.3×10-7 K2=7.1×10-15 |
请回答下列问题:
(1)同浓度的CH3COO-、
 、
、 、
、 、ClO-、S2-中结合H+的能力最弱的是
、ClO-、S2-中结合H+的能力最弱的是(2)常温下0.1mol•L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是
A.c(H+) B.
 C.
C. D.c(OH-)
D.c(OH-)(3)pH相同的NaClO和CH3COOK溶液,其溶液的物质的量浓度的大小关系是CH3COOK
(4)向0.1mol•L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5∶9,此时溶液pH=
您最近一年使用:0次
名校
5 .  的电离方程式为
的电离方程式为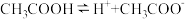 ,25℃时,
,25℃时, 溶液的
溶液的 。下列说法正确的是( )
。下列说法正确的是( )
 的电离方程式为
的电离方程式为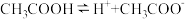 ,25℃时,
,25℃时, 溶液的
溶液的 。下列说法正确的是( )
。下列说法正确的是( )A.向该溶液中滴加几滴浓盐酸,平衡逆向移动, 减小 减小 |
B.向该溶液中加少量 固体,平衡正向移动 固体,平衡正向移动 |
C.该温度下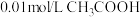 溶液的 溶液的 |
D.升高温度, 增大, 增大, 变大 变大 |
您最近一年使用:0次
2020-09-17更新
|
633次组卷
|
16卷引用:新疆维吾尔自治区兵团第二师华山中学2018-2019学年高二上学期第一次调研考试化学试题
新疆维吾尔自治区兵团第二师华山中学2018-2019学年高二上学期第一次调研考试化学试题【全国区级联考】北京市朝阳区2017-2018学年高二下学期期末考试化学试题【全国百强校】内蒙古集宁一中(西校区)2018-2019学年高二上学期第一次月考理科综合化学试题【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高二(理)上学期期中考试化学试题【全国百强校】江西省南昌市第二中学2018-2019学年高二上学期期中考试化学试题江西省南康中学2019-2020学年高二上学期期中考试化学试题江西省新余市八校2019-2020学年高二上学期期中考试化学试题甘肃省兰州大学附属中学(33中)2019-2020学年高二上学期期中考试化学试题鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第2节 弱电解质的电离盐类的水解人教版(2019)高二化学选择性必修1第三章 水溶液中的离子反应与平衡 第一节 电离平衡 课时2 电离平衡常数贵州省北师大遵义附属高级中学2020-2021学年高二上学期期中考试化学试题福建省南安市柳城中学2020-2021学年高二上学期第二次月考化学试题云南省丽江市第一中学2020-2021学年高二下学期期中考试化学试题选择性必修1(SJ)专题3第一单元课时2 电离平衡常数辽宁省辽河油田第二高级中学2021-2022学年高二上学期开学考试化学试题山东省济南市商河县第一中学2020-2021学年高二10月月考化学试题
名校
6 . 25℃时,已知醋酸的电离常数为1.8×10-5。向20mL 2.0mol/LCH3COOH溶液中逐滴加入2.0mol/LNaOH溶液,溶液中水电离出的c(H+)在此滴定过程中变化曲线如下图所示。下列说法不正确的是


A.a点溶液中:c(H+)=6.0 10-3mol 10-3mol L-1 L-1 |
| B.b点溶液中:c(CH3COOH)>c(Na+)>c(CH3COO-) |
| C.c点溶液中:c(OH-)=c(CH3COOH)+ c(H+) |
| D.d点溶液中:c(Na+)=2c(CH3COO-)+2c(CH3COOH) |
您最近一年使用:0次
2019-05-18更新
|
2148次组卷
|
9卷引用:四川省成都市第七中学2019-2020学年高二下学期零诊模拟考试化学
四川省成都市第七中学2019-2020学年高二下学期零诊模拟考试化学【市级联考】安徽省合肥市2019届高三下学期第三次教学质量检测理科综合化学试题四川省凉山州2020-2021学年高二上学期期末考试化学试题四川省仁寿第一中学校南校区2020-2021学年高二下学期开学考试化学试题福建省福州高级中学2021-2022学年高二上学期期末化学考试题广东省深圳市南山区2021-2022学年高二上学期期末教学质量监测化学试题四川省绵阳市南山中学实验学校2020届高三上学期11月月考理科综合化学试题(已下线)第18讲 弱电解质的电离-2021年高考化学一轮复习名师精讲练江西省吉安市2021届高三上学期期末教学质量检测化学试题
名校
7 . 已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
(1)物质的量浓度均为0.1mol•L﹣1的四种溶液:pH由小到大排列的顺序是___________ (用编号填写)。
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1mol•L﹣1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是_________ 。
A. c(H+) B. C. c(H+)•c(OH﹣) D.
C. c(H+)•c(OH﹣) D.  E.
E. 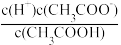
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:___________ 。
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO﹣)﹣c(Na+)=___________ (填准确数值)。
(5)25℃时,将a mol•L﹣1的醋酸与b mol•L﹣1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为___________ 。
(6)标准状况下,将1.12L CO2通入100mL 1mol•L﹣1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式: c(OH﹣)=2c(H2CO3)+___________ 。
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.8×10﹣5 | Ka1=4.3×10﹣7 Ka2=5.6×10﹣11 | Ka=3.0×10﹣8 |
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1mol•L﹣1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是
A. c(H+) B.
 C. c(H+)•c(OH﹣) D.
C. c(H+)•c(OH﹣) D.  E.
E. 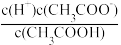
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO﹣)﹣c(Na+)=
(5)25℃时,将a mol•L﹣1的醋酸与b mol•L﹣1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为
(6)标准状况下,将1.12L CO2通入100mL 1mol•L﹣1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式: c(OH﹣)=2c(H2CO3)+
您最近一年使用:0次
2019-03-16更新
|
1818次组卷
|
6卷引用:【校级联考】湖南省浏阳一中、醴陵一中2018-2019学年高二上学期12月联考化学试题
名校
8 . 已知常温下部分弱电解质的电离平衡常数如下表:
(1)常温下,物质的量溶度相同的三种溶液①NaF溶液 ②NaClO溶液 ③Na2CO3溶液,其PH由大到小的顺序是___________ (填序号)
(2)25°C时,PH=4的NH4Cl溶液中各离子浓度的大小关系为___________________
(3)NaClO溶液中的电荷守恒关系为_________________
(4)向NaClO溶液中通入少量的CO2,所发生的离子方程式为_________
(5)常温下,0.1mol/L的氨水和0.1mol/L的NH4Cl溶液等体积混合,判断混合溶液的酸碱性____________ (填“酸性”“碱性”“中性”)
| 化学式 | HF | HClO | H2CO3 | NH3·H2O |
| 电离常数 | 6.8×10−4 | 4.7×10−8 | K1=4.3×10−7 K2=5.6×10−11 | Kb=1.7×10−5 |
(1)常温下,物质的量溶度相同的三种溶液①NaF溶液 ②NaClO溶液 ③Na2CO3溶液,其PH由大到小的顺序是
(2)25°C时,PH=4的NH4Cl溶液中各离子浓度的大小关系为
(3)NaClO溶液中的电荷守恒关系为
(4)向NaClO溶液中通入少量的CO2,所发生的离子方程式为
(5)常温下,0.1mol/L的氨水和0.1mol/L的NH4Cl溶液等体积混合,判断混合溶液的酸碱性
您最近一年使用:0次
9 . 一定温度下,下列溶液的离子浓度关系式正确的是
| A.pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5mol·L-1 |
| B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 |
| C.常温下,0.1mol/LpH=7.82的NH4HCO3溶液中:c(HCO3-)>c(NH4+)>c(OH-)>c(H+) |
| D.pH相同的①CH3COONa ②NaHCO3 ③NaClO三种溶液的c(Na+):①>②>③ |
您最近一年使用:0次
10 . 已知t ℃时,水的离子积为KW,该温度下,将a mol·L-1氨水溶液和b mol·L-1 HCl溶液等体积混合,下列判断一定正确的是
| A.若溶液呈酸性,则a<b |
B.若a>b,则混合液中的c( )大于c(Cl-) )大于c(Cl-) |
C.若c(OH-)=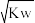 mol·L-1,则混合液一定呈中性 mol·L-1,则混合液一定呈中性 |
| D.混合液中c(Cl-)=c(NH4+)+c(NH3·H2O) |
您最近一年使用:0次



