名校
1 . I.铁镁合金是一种性能优异的储氢材料。关于铁镁两种元素,请回答下列问题:
(1)同周期元素中,第一电离能小于镁的元素有_______ 种。
(2)基态Fe原子的简化电子排布式为_______ ,空间运动状态有_______ 种,Fe位于元周期表的_______ 区,基态原子的电子有_______ 种伸展方向。
(3)与Fe元素同周期,基态原子有2个未成对电子的金属元素有_______ 种,下列状态的铁中,电离最外层一个电子所需能量最大的是_______ (填标号)。
a.[Ar] b.[Ar]
b.[Ar]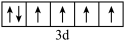
c.[Ar] d.[Ar]
d.[Ar]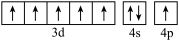
(4)试从结构角度解释 易被氧化为
易被氧化为
_______ 。
(5)对于呋喃: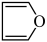 和吡咯:
和吡咯: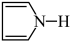 )所含的元素中,电负性最大的是
)所含的元素中,电负性最大的是_______ ,最小的是_______ ;第一电离能最大的是_______ 。
Ⅱ. 在食品、医药、电子工业中用途广泛。回答下列问题:
在食品、医药、电子工业中用途广泛。回答下列问题:
(6) 可做净水剂,其理由是
可做净水剂,其理由是_______ (用离子方程式表示)。
(7)下图是0.1mol/L电解质溶液的pH随温度变化的图像。其中符合0.1mol/L 溶液的是
溶液的是_______ (填罗马数字)。
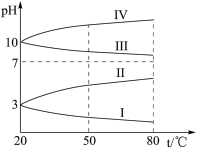
(8)20℃时,0.1mol/L 溶液中,
溶液中, =
=_______ mol/L(写出准确数值)。
Ⅲ、某同学用酸性KMnO4溶液测定绿矾产品中Fe2+含量:请回答下列问题:
反应原理为: (Mn2+在溶液中为无色)
(Mn2+在溶液中为无色)
a.称取11.5g绿矾产品,溶解,配制成1000mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点
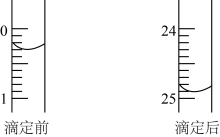
(9)若甲学生在实验过程中,记录滴定前后滴定管内液面读数如图所示,则此时消耗标准溶液的体积为_______ mL。
(10)此滴定实验达到终点的颜色变化为_______ 。
(11)重复滴定4次,每次消耗酸性KMnO4标准溶液的体积如表所示:
计算上述样品中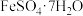 的质量分数为
的质量分数为_______ 。( ,小数点后保留一位)
,小数点后保留一位)
(12)若滴定前平视读数,滴定终点时仰视读数,则所测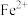 含量:
含量:_______ 。(填“无影响”、“偏高”或“偏低”)。
(1)同周期元素中,第一电离能小于镁的元素有
(2)基态Fe原子的简化电子排布式为
(3)与Fe元素同周期,基态原子有2个未成对电子的金属元素有
a.[Ar]
 b.[Ar]
b.[Ar]
c.[Ar]
 d.[Ar]
d.[Ar]
(4)试从结构角度解释
 易被氧化为
易被氧化为
(5)对于呋喃:
 和吡咯:
和吡咯: )所含的元素中,电负性最大的是
)所含的元素中,电负性最大的是Ⅱ.
 在食品、医药、电子工业中用途广泛。回答下列问题:
在食品、医药、电子工业中用途广泛。回答下列问题:(6)
 可做净水剂,其理由是
可做净水剂,其理由是(7)下图是0.1mol/L电解质溶液的pH随温度变化的图像。其中符合0.1mol/L
 溶液的是
溶液的是

(8)20℃时,0.1mol/L
 溶液中,
溶液中, =
=Ⅲ、某同学用酸性KMnO4溶液测定绿矾产品中Fe2+含量:请回答下列问题:
反应原理为:
 (Mn2+在溶液中为无色)
(Mn2+在溶液中为无色)a.称取11.5g绿矾产品,溶解,配制成1000mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点
(9)若甲学生在实验过程中,记录滴定前后滴定管内液面读数如图所示,则此时消耗标准溶液的体积为
(10)此滴定实验达到终点的颜色变化为
(11)重复滴定4次,每次消耗酸性KMnO4标准溶液的体积如表所示:
| 第一次 | 第二次 | 第三次 | 第四次 | |
| V(KMnO4溶液)/mL | 17.10 | 19.98 | 20.00 | 20.02 |
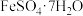 的质量分数为
的质量分数为 ,小数点后保留一位)
,小数点后保留一位)(12)若滴定前平视读数,滴定终点时仰视读数,则所测
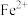 含量:
含量:
您最近一年使用:0次
2 . 草酸钠( )常用作还原剂。已知常温下,草酸的电离常数
)常用作还原剂。已知常温下,草酸的电离常数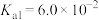 ,
,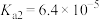 ,碳酸的电离常数
,碳酸的电离常数 ,
, 。回答下列问题:
。回答下列问题:
(1) 发生第一步水解的离子方程式为
发生第一步水解的离子方程式为___________ 。
(2)相同条件下,同浓度的① ,②
,② ,③
,③ ,④
,④ 四种溶液的pH由大到小的顺序为
四种溶液的pH由大到小的顺序为___________ (用编号表示)。
(3)将等浓度、等体积的 溶液与盐酸混合,溶液显酸性。混合后所得溶液中下列关系成立的是
溶液与盐酸混合,溶液显酸性。混合后所得溶液中下列关系成立的是___________ 。
a.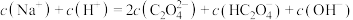
b.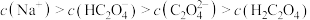
c.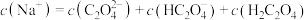
d.
(4) 溶液常用作氧化还原滴定的标准液。实验室欲配制250mL0.10mol⋅L-1的
溶液常用作氧化还原滴定的标准液。实验室欲配制250mL0.10mol⋅L-1的 溶液。
溶液。
①需称取 固体
固体___________ g。
②配制溶液时,需要的玻璃仪器除烧杯、玻璃棒、量筒外还应有___________ 。
(5)用 标准液测定某高锰酸钾样品的纯度:
标准液测定某高锰酸钾样品的纯度:
步骤I:称取2.0g高锰酸钾样品,配成100mL溶液,取20mL溶液于锥形瓶中,并加入少量硫酸酸化。
步骤Ⅱ:用(4)中配制的 标准液进行滴定,平行滴定三次,记录消耗
标准液进行滴定,平行滴定三次,记录消耗 溶液的体积如下表:
溶液的体积如下表:
①滴定终点判断的依据是___________ 。
②平均消耗 溶液的体积为
溶液的体积为_________ mL,样品中 的质量分数为
的质量分数为_________ 。
③若(4)中称取的 固体已部分吸水潮解,会使测得的样品中
固体已部分吸水潮解,会使测得的样品中 的质量分数
的质量分数_________ (填“偏高”、“偏低”或“不变”)。
 )常用作还原剂。已知常温下,草酸的电离常数
)常用作还原剂。已知常温下,草酸的电离常数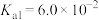 ,
,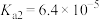 ,碳酸的电离常数
,碳酸的电离常数 ,
, 。回答下列问题:
。回答下列问题:(1)
 发生第一步水解的离子方程式为
发生第一步水解的离子方程式为(2)相同条件下,同浓度的①
 ,②
,② ,③
,③ ,④
,④ 四种溶液的pH由大到小的顺序为
四种溶液的pH由大到小的顺序为(3)将等浓度、等体积的
 溶液与盐酸混合,溶液显酸性。混合后所得溶液中下列关系成立的是
溶液与盐酸混合,溶液显酸性。混合后所得溶液中下列关系成立的是a.
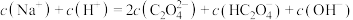
b.
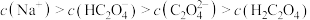
c.
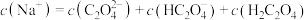
d.

(4)
 溶液常用作氧化还原滴定的标准液。实验室欲配制250mL0.10mol⋅L-1的
溶液常用作氧化还原滴定的标准液。实验室欲配制250mL0.10mol⋅L-1的 溶液。
溶液。①需称取
 固体
固体②配制溶液时,需要的玻璃仪器除烧杯、玻璃棒、量筒外还应有
(5)用
 标准液测定某高锰酸钾样品的纯度:
标准液测定某高锰酸钾样品的纯度:步骤I:称取2.0g高锰酸钾样品,配成100mL溶液,取20mL溶液于锥形瓶中,并加入少量硫酸酸化。
步骤Ⅱ:用(4)中配制的
 标准液进行滴定,平行滴定三次,记录消耗
标准液进行滴定,平行滴定三次,记录消耗 溶液的体积如下表:
溶液的体积如下表:| 第1次 | 第2次 | 第3次 | |
消耗 溶液的体积/mL 溶液的体积/mL | 49.80 | 46.75 | 50.20 |
②平均消耗
 溶液的体积为
溶液的体积为 的质量分数为
的质量分数为③若(4)中称取的
 固体已部分吸水潮解,会使测得的样品中
固体已部分吸水潮解,会使测得的样品中 的质量分数
的质量分数
您最近一年使用:0次
名校
解题方法
3 . 用NA代表阿伏加德罗常数的值,下列叙述正确的是
| A.1mol HC≡CH分子中所含σ键数为5NA |
| B.1mol碘蒸气和1mol氢气在密闭容器中充分反应,生成的碘化氢分子数等于2 NA |
| C.100g质量分数为46%的乙醇(C2H6O)水溶液含氧原于数目为NA |
D.1L1mol•L-1溴化铵水溶液中NH 与H+离子数之和大于NA 与H+离子数之和大于NA |
您最近一年使用:0次
4 . CH3COONa和Na2CO3都可用作医药媒染剂、缓冲剂等。
(1)一定温度下,向1 L0.1 mol· L-1CH3COOH溶液中加入0.1 mol CH3COONa固体,则溶液中
_______ (填“增大”“不变”或“减小”);写出表示该混合溶液中所有离子浓度之间电荷守恒的一个等式:_______ 。
(2)土壤的pH一般在4~9之间。土壤中Na2CO3含量较高时,pH可高达10. 5,试用离子方程式解释土壤呈碱性的原因:________ 。加入石膏(CaSO4·2H2O)可以使土壤碱性降低,有关反应的化学方程式为_______ 。
(3)常温下在20 mL0.1 mol· L-1Na2CO3溶液中逐滴加入0.1 mol· L-1的HC1溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)的物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。

①在同一溶液中,H2CO3、 、
、
_______ (填“ 能”或“不能”)大量共存。
②当pH=7时,溶液中含碳元素的主要微粒为_______ 。
(1)一定温度下,向1 L0.1 mol· L-1CH3COOH溶液中加入0.1 mol CH3COONa固体,则溶液中

(2)土壤的pH一般在4~9之间。土壤中Na2CO3含量较高时,pH可高达10. 5,试用离子方程式解释土壤呈碱性的原因:
(3)常温下在20 mL0.1 mol· L-1Na2CO3溶液中逐滴加入0.1 mol· L-1的HC1溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)的物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。

①在同一溶液中,H2CO3、
 、
、
②当pH=7时,溶液中含碳元素的主要微粒为
您最近一年使用:0次
2022-09-11更新
|
143次组卷
|
2卷引用:青海省西宁市大通回族土族自治县2021-2022学年高二上学期期末考试化学试题
名校
解题方法
5 . 某同学查阅资料发现,人体血液里由于存在重要的酸碱平衡:CO2+ H2O H2CO3
H2CO3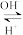 HCO
HCO ,使血液pH范围保持在7.35 ~ 7.45,否则就会发生酸中毒或碱中毒。
,使血液pH范围保持在7.35 ~ 7.45,否则就会发生酸中毒或碱中毒。
(1)人体血液发生酸中毒时,可注射 ___________缓解(填字母)。
(2)已知25°C时,CO 水解反应的平衡常数Kh=2×10 −4 mol∙L−1,当溶液中c (HCO
水解反应的平衡常数Kh=2×10 −4 mol∙L−1,当溶液中c (HCO ):c(CO
):c(CO )=2:1时,溶液的pH=
)=2:1时,溶液的pH=___________ 。
(3)亚砷酸(H3AsO3)可用于治疗白血病,亚砷酸(H3AsO3)在溶液中存在多种微粒形态,各种微粒的物质的量分数与溶液pH关系如下图所示。

①NaH2AsO3溶液呈___________ (填 “酸”、“碱”或“中”)性:写出NaH2AsO3水解的离子方程式___________ 。
②将KOH溶液滴入H3AsO3溶液中,当pH从13调节至14时,所发生反应的离子方程式为___________ 。
③下列说法正确的是___________ (填字母)。
a. H3AsO3的电离平衡常数Ka1∙Ka2= 10a+b
b. H3AsO3溶液中: c(H2AsO ) + 2c(HAsO
) + 2c(HAsO ) + 3c(AsO
) + 3c(AsO ) + c(OH-) = c(H+)
) + c(OH-) = c(H+)
c. K3AsO3溶液中: c(K+)=3c (AsO ) +3c (HAsO
) +3c (HAsO )+3c (H2AsO
)+3c (H2AsO )
)
(4)医学研究表明,砷的化合物会影响人体代谢和免疫功能造成砷中毒。某工业废水中砷含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,向废水中先加入适量漂白粉,再加入生石灰调节pH,将砷元素转化为Ca3(AsO4)2沉淀。则要除去AsO ,溶液中的c(Ca2+)至少为
,溶液中的c(Ca2+)至少为___________ mol∙L−1。
{已知: Ksp[Ca3(AsO4)2]=8 × 10−19 mol5∙L−5,当残留在溶液中的离子浓度≤1 ×10−5 mol∙L−1,可认为沉淀完全}。
 H2CO3
H2CO3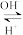 HCO
HCO ,使血液pH范围保持在7.35 ~ 7.45,否则就会发生酸中毒或碱中毒。
,使血液pH范围保持在7.35 ~ 7.45,否则就会发生酸中毒或碱中毒。(1)人体血液发生酸中毒时,可注射 ___________缓解(填字母)。
| A.NaOH溶液 | B.NaHCO3溶液 | C.NaCl溶液 | D.Na2SO4溶液 |
 水解反应的平衡常数Kh=2×10 −4 mol∙L−1,当溶液中c (HCO
水解反应的平衡常数Kh=2×10 −4 mol∙L−1,当溶液中c (HCO ):c(CO
):c(CO )=2:1时,溶液的pH=
)=2:1时,溶液的pH=(3)亚砷酸(H3AsO3)可用于治疗白血病,亚砷酸(H3AsO3)在溶液中存在多种微粒形态,各种微粒的物质的量分数与溶液pH关系如下图所示。

①NaH2AsO3溶液呈
②将KOH溶液滴入H3AsO3溶液中,当pH从13调节至14时,所发生反应的离子方程式为
③下列说法正确的是
a. H3AsO3的电离平衡常数Ka1∙Ka2= 10a+b
b. H3AsO3溶液中: c(H2AsO
 ) + 2c(HAsO
) + 2c(HAsO ) + 3c(AsO
) + 3c(AsO ) + c(OH-) = c(H+)
) + c(OH-) = c(H+)c. K3AsO3溶液中: c(K+)=3c (AsO
 ) +3c (HAsO
) +3c (HAsO )+3c (H2AsO
)+3c (H2AsO )
)(4)医学研究表明,砷的化合物会影响人体代谢和免疫功能造成砷中毒。某工业废水中砷含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,向废水中先加入适量漂白粉,再加入生石灰调节pH,将砷元素转化为Ca3(AsO4)2沉淀。则要除去AsO
 ,溶液中的c(Ca2+)至少为
,溶液中的c(Ca2+)至少为{已知: Ksp[Ca3(AsO4)2]=8 × 10−19 mol5∙L−5,当残留在溶液中的离子浓度≤1 ×10−5 mol∙L−1,可认为沉淀完全}。
您最近一年使用:0次
2022-01-22更新
|
341次组卷
|
2卷引用:山东省菏泽市2021-2022学年高二上学期期末教学质量检测化学试题
解题方法
6 . 弱电解质的电离平衡、盐类的水解平衡和难溶物的沉淀溶解平衡均属于化学平衡。
I.已知 在水中存在以下平衡:
在水中存在以下平衡: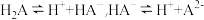 。
。
(1)常温下, 溶液的
溶液的
______ (填字母序号),原因是______ (填离子方程式)。
A.大于7 B.小于7 C.等于7 D.无法确定
(2)常温下,若向 的
的 溶液中逐滴滴加
溶液中逐滴滴加
 溶液至溶液呈中性。此时该混合溶液中的下列关系一定正确的是
溶液至溶液呈中性。此时该混合溶液中的下列关系一定正确的是______ (填字母序号)。
A.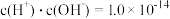 B.
B.
C.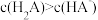 D.
D.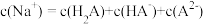
(3)常温下, 的饱和溶液中存在以下平衡:
的饱和溶液中存在以下平衡: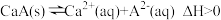 ,若要使该溶液中
,若要使该溶液中 浓度增大,可采取的措施有
浓度增大,可采取的措施有______ (填字母序号)。
A.升高温度 B.降低温度 C.加入少量蒸馏水 D.加入 固体
固体
Ⅱ.化学沉淀法是除去酸性废水中 的主要方法。根据其原理不同可以分为氢氧化物沉淀法、硫化物沉淀法等。水样中各形态铅的百分含量X与溶液
的主要方法。根据其原理不同可以分为氢氧化物沉淀法、硫化物沉淀法等。水样中各形态铅的百分含量X与溶液 变化的关系如图所示。向含
变化的关系如图所示。向含 的溶液中逐滴滴加
的溶液中逐滴滴加 溶液,溶液变浑浊,继续滴加
溶液,溶液变浑浊,继续滴加 溶液又变澄清。
溶液又变澄清。
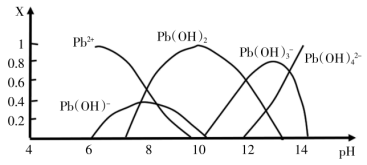
(4)若采用氢氧化物沉淀法除溶液中的 ,应将溶液的
,应将溶液的 调至约为
调至约为______ ; 时,溶液中发生的主要离子方程式为
时,溶液中发生的主要离子方程式为______ 。
(5)向酸性含铅废水中加 可将
可将 转化为
转化为 沉淀除去。若某工厂处理过的废水中
沉淀除去。若某工厂处理过的废水中 浓度为
浓度为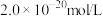 ,则
,则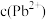 为
为______ 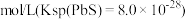 。
。
I.已知
 在水中存在以下平衡:
在水中存在以下平衡: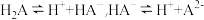 。
。(1)常温下,
 溶液的
溶液的
A.大于7 B.小于7 C.等于7 D.无法确定
(2)常温下,若向
 的
的 溶液中逐滴滴加
溶液中逐滴滴加
 溶液至溶液呈中性。此时该混合溶液中的下列关系一定正确的是
溶液至溶液呈中性。此时该混合溶液中的下列关系一定正确的是A.
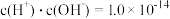 B.
B.
C.
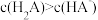 D.
D.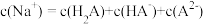
(3)常温下,
 的饱和溶液中存在以下平衡:
的饱和溶液中存在以下平衡: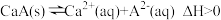 ,若要使该溶液中
,若要使该溶液中 浓度增大,可采取的措施有
浓度增大,可采取的措施有A.升高温度 B.降低温度 C.加入少量蒸馏水 D.加入
 固体
固体Ⅱ.化学沉淀法是除去酸性废水中
 的主要方法。根据其原理不同可以分为氢氧化物沉淀法、硫化物沉淀法等。水样中各形态铅的百分含量X与溶液
的主要方法。根据其原理不同可以分为氢氧化物沉淀法、硫化物沉淀法等。水样中各形态铅的百分含量X与溶液 变化的关系如图所示。向含
变化的关系如图所示。向含 的溶液中逐滴滴加
的溶液中逐滴滴加 溶液,溶液变浑浊,继续滴加
溶液,溶液变浑浊,继续滴加 溶液又变澄清。
溶液又变澄清。
(4)若采用氢氧化物沉淀法除溶液中的
 ,应将溶液的
,应将溶液的 调至约为
调至约为 时,溶液中发生的主要离子方程式为
时,溶液中发生的主要离子方程式为(5)向酸性含铅废水中加
 可将
可将 转化为
转化为 沉淀除去。若某工厂处理过的废水中
沉淀除去。若某工厂处理过的废水中 浓度为
浓度为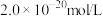 ,则
,则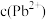 为
为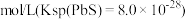 。
。
您最近一年使用:0次
2021-01-30更新
|
397次组卷
|
2卷引用:湖南省怀化市2020-2021学年高二上学期期末考试化学试题



