解题方法
1 . 常温下, 溶液、
溶液、 溶液的
溶液的 均大于7。下列关于这两种溶液的说法正确的是
均大于7。下列关于这两种溶液的说法正确的是
 溶液、
溶液、 溶液的
溶液的 均大于7。下列关于这两种溶液的说法正确的是
均大于7。下列关于这两种溶液的说法正确的是A. 溶液中存在平衡: 溶液中存在平衡: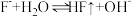 |
B.加热, 溶液的碱性增强 溶液的碱性增强 |
C. 溶液中: 溶液中: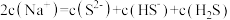 |
D. 溶液中: 溶液中: |
您最近半年使用:0次
2 . NA为阿伏加德罗常数的值,下列说法不正确的是
| A.1molHCN中含π键的数目为NA |
| B.6.5gZn与一定量浓硫酸反应完全溶解,转移的电子数为0.2NA |
C.将1molNH4CI溶于稀氨水中使溶液呈中性,溶液中 数目为NA 数目为NA |
| D.23gNa与O2充分反应生成Na2O和Na2O2的混合物,消耗O2的分子数在0.25NA和0.5NA之间 |
您最近半年使用:0次
解题方法
3 . 已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
(1)物质的量浓度均为0.1mol/L的下列四种溶液:pH由小到大排列的顺序是___________ 。
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1mol/LCH3COOH溶液加水稀释过程中,下列表达式的数据变大的是________ (填序号)。
A. B.
B.  C.
C. 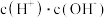 D.
D.  E.
E. 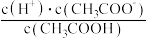
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:_____________ 。
(4)25℃时,将amol/L的醋酸溶液与bmol/L氢氧化钠溶液等体积混合,反应后溶液恰好显中性,表示醋酸的电离平衡常数Ka=_________ (用含a、b的代数式表示)。
(5)标准状况下将1.12LCO2通入100mL1mol/LNaOH溶液中,用溶液中微粒的浓度符号完成下列等式:c(OH-)=2c(H2CO3)+___________ 。
(6)将碳酸钠溶液与次氯酸溶液混合,________ (填“是”或“否”)发生反应,若反应请写出反应的离子方程式:_______________ 。(不反应此问不答)
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1mol/LCH3COOH溶液加水稀释过程中,下列表达式的数据变大的是
A.
 B.
B.  C.
C. 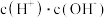 D.
D.  E.
E. 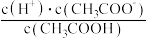
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:
(4)25℃时,将amol/L的醋酸溶液与bmol/L氢氧化钠溶液等体积混合,反应后溶液恰好显中性,表示醋酸的电离平衡常数Ka=
(5)标准状况下将1.12LCO2通入100mL1mol/LNaOH溶液中,用溶液中微粒的浓度符号完成下列等式:c(OH-)=2c(H2CO3)+
(6)将碳酸钠溶液与次氯酸溶液混合,
您最近半年使用:0次
4 . 下列有关电解质溶液的说法不正确的是
A.向0.1 的氨水中加入少量水,溶液中 的氨水中加入少量水,溶液中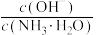 增大 增大 |
B.将 溶液从20℃升温至30℃,溶液中 溶液从20℃升温至30℃,溶液中 增大 增大 |
C.向氢氧化钠溶液中加入醋酸溶液至中性,溶液中 |
D.向 的饱和溶液中加入 的饱和溶液中加入 固体,溶液中的 固体,溶液中的 |
您最近半年使用:0次
5 . 常温下,向0.1 的
的 溶液中加入一定量的NaOH溶液,当溶液中存在
溶液中加入一定量的NaOH溶液,当溶液中存在
 时,溶液中的主要溶质为
时,溶液中的主要溶质为
 的
的 溶液中加入一定量的NaOH溶液,当溶液中存在
溶液中加入一定量的NaOH溶液,当溶液中存在
 时,溶液中的主要溶质为
时,溶液中的主要溶质为A. | B.NaHS | C.NaHS和 | D. 和NaOH 和NaOH |
您最近半年使用:0次
解题方法
6 .  为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是A.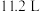 乙烯气体中含有 乙烯气体中含有 键数目为 键数目为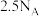 |
B.常温柠檬水的 , ,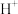 数目为 数目为 |
C. 与 与 加热充分反应,气体的分子数小于 加热充分反应,气体的分子数小于 |
D.某 溶液中含 溶液中含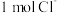 ,则 ,则 与 与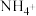 数目一共为 数目一共为 |
您最近半年使用:0次
名校
7 . 25℃,用浓度为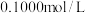 的
的 溶液滴定
溶液滴定 浓度为
浓度为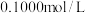 的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是
的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是
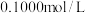 的
的 溶液滴定
溶液滴定 浓度为
浓度为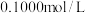 的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是
的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是
| A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX |
B. 时,三种溶液中 时,三种溶液中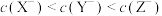 |
C.将上述HX、HY溶液等体积混合后用 溶液滴定至HX恰好完全反应时,溶液存在: 溶液滴定至HX恰好完全反应时,溶液存在: |
D.若进行HZ浓度测定,洗净碱式滴定管后直接取标准 溶液进行滴定,则测定结果偏低 溶液进行滴定,则测定结果偏低 |
您最近半年使用:0次
2024-02-29更新
|
142次组卷
|
2卷引用:山西省运城市2023-2024学年高二上学期1月期末考试化学试题
名校
8 . I.铁镁合金是一种性能优异的储氢材料。关于铁镁两种元素,请回答下列问题:
(1)同周期元素中,第一电离能小于镁的元素有_______ 种。
(2)基态Fe原子的简化电子排布式为_______ ,空间运动状态有_______ 种,Fe位于元周期表的_______ 区,基态原子的电子有_______ 种伸展方向。
(3)与Fe元素同周期,基态原子有2个未成对电子的金属元素有_______ 种,下列状态的铁中,电离最外层一个电子所需能量最大的是_______ (填标号)。
a.[Ar] b.[Ar]
b.[Ar]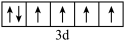
c.[Ar] d.[Ar]
d.[Ar]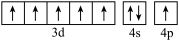
(4)试从结构角度解释 易被氧化为
易被氧化为
_______ 。
(5)对于呋喃: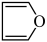 和吡咯:
和吡咯: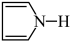 )所含的元素中,电负性最大的是
)所含的元素中,电负性最大的是_______ ,最小的是_______ ;第一电离能最大的是_______ 。
Ⅱ. 在食品、医药、电子工业中用途广泛。回答下列问题:
在食品、医药、电子工业中用途广泛。回答下列问题:
(6) 可做净水剂,其理由是
可做净水剂,其理由是_______ (用离子方程式表示)。
(7)下图是0.1mol/L电解质溶液的pH随温度变化的图像。其中符合0.1mol/L 溶液的是
溶液的是_______ (填罗马数字)。
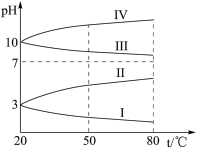
(8)20℃时,0.1mol/L 溶液中,
溶液中, =
=_______ mol/L(写出准确数值)。
Ⅲ、某同学用酸性KMnO4溶液测定绿矾产品中Fe2+含量:请回答下列问题:
反应原理为: (Mn2+在溶液中为无色)
(Mn2+在溶液中为无色)
a.称取11.5g绿矾产品,溶解,配制成1000mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点
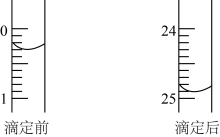
(9)若甲学生在实验过程中,记录滴定前后滴定管内液面读数如图所示,则此时消耗标准溶液的体积为_______ mL。
(10)此滴定实验达到终点的颜色变化为_______ 。
(11)重复滴定4次,每次消耗酸性KMnO4标准溶液的体积如表所示:
计算上述样品中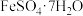 的质量分数为
的质量分数为_______ 。( ,小数点后保留一位)
,小数点后保留一位)
(12)若滴定前平视读数,滴定终点时仰视读数,则所测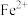 含量:
含量:_______ 。(填“无影响”、“偏高”或“偏低”)。
(1)同周期元素中,第一电离能小于镁的元素有
(2)基态Fe原子的简化电子排布式为
(3)与Fe元素同周期,基态原子有2个未成对电子的金属元素有
a.[Ar]
 b.[Ar]
b.[Ar]
c.[Ar]
 d.[Ar]
d.[Ar]
(4)试从结构角度解释
 易被氧化为
易被氧化为
(5)对于呋喃:
 和吡咯:
和吡咯: )所含的元素中,电负性最大的是
)所含的元素中,电负性最大的是Ⅱ.
 在食品、医药、电子工业中用途广泛。回答下列问题:
在食品、医药、电子工业中用途广泛。回答下列问题:(6)
 可做净水剂,其理由是
可做净水剂,其理由是(7)下图是0.1mol/L电解质溶液的pH随温度变化的图像。其中符合0.1mol/L
 溶液的是
溶液的是

(8)20℃时,0.1mol/L
 溶液中,
溶液中, =
=Ⅲ、某同学用酸性KMnO4溶液测定绿矾产品中Fe2+含量:请回答下列问题:
反应原理为:
 (Mn2+在溶液中为无色)
(Mn2+在溶液中为无色)a.称取11.5g绿矾产品,溶解,配制成1000mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点
(9)若甲学生在实验过程中,记录滴定前后滴定管内液面读数如图所示,则此时消耗标准溶液的体积为
(10)此滴定实验达到终点的颜色变化为
(11)重复滴定4次,每次消耗酸性KMnO4标准溶液的体积如表所示:
| 第一次 | 第二次 | 第三次 | 第四次 | |
| V(KMnO4溶液)/mL | 17.10 | 19.98 | 20.00 | 20.02 |
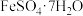 的质量分数为
的质量分数为 ,小数点后保留一位)
,小数点后保留一位)(12)若滴定前平视读数,滴定终点时仰视读数,则所测
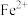 含量:
含量:
您最近半年使用:0次
9 . 化学上的缓冲溶液就是外加少量酸、碱后而pH基本不变的溶液。现有25℃时浓度均为0.10 mol•L-1的CH3COOH和CH3COONa的缓冲溶液,pH=4.76。已知:Ka(CH3COOH)=1.75×10-5,Kb为盐的水解常数,回答下列问题:
(1)该缓冲溶液中存在的两个主要平衡是_______ 、_______ (用电离方程式和离子方程式表示)。
(2)该缓冲溶液中离子浓度由大到小的顺序是_______ 。
(3)人体血液存在H2CO3(CO2)和NaHCO3的缓冲体系,能有效除掉人体正常代谢产生的酸、碱,保持pH的稳定,有关机理说法正确的是_______ (填写选项字母)。
a.代谢产生的H+被HCO 结合形成H2CO3
结合形成H2CO3
b.代谢产生的碱被H+中和,H+又由H2CO3电离
c.血液中的缓冲体系可抵抗大量酸、碱的影响
(4)写出表达式:Ka(CH3COOH)=_______ ,Kb(CH3COO-)=_______ 。
(5)25℃时,Ka (CH3COOH)_______ Kb (CH3COO- )(填“>”、“<”或“=”)。向1.0L上述0.10mol•L-1的CH3COOH和CH3COONa的缓冲溶液中滴加几滴NaOH稀溶液(忽略溶液体积的变化),反应后溶液中c(H+)=_______ mol•L-1。
(6)含有一定量的NH3•H2O和NH4Cl的溶液也具有缓冲作用,写出在此溶液中加入酸或碱时发生反应的离子方程式:加入少量强酸时,_______ 。加入少量强碱时,_______ 。
(1)该缓冲溶液中存在的两个主要平衡是
(2)该缓冲溶液中离子浓度由大到小的顺序是
(3)人体血液存在H2CO3(CO2)和NaHCO3的缓冲体系,能有效除掉人体正常代谢产生的酸、碱,保持pH的稳定,有关机理说法正确的是
a.代谢产生的H+被HCO
 结合形成H2CO3
结合形成H2CO3b.代谢产生的碱被H+中和,H+又由H2CO3电离
c.血液中的缓冲体系可抵抗大量酸、碱的影响
(4)写出表达式:Ka(CH3COOH)=
(5)25℃时,Ka (CH3COOH)
(6)含有一定量的NH3•H2O和NH4Cl的溶液也具有缓冲作用,写出在此溶液中加入酸或碱时发生反应的离子方程式:加入少量强酸时,
您最近半年使用:0次
10 . 草酸钠( )常用作还原剂。已知常温下,草酸的电离常数
)常用作还原剂。已知常温下,草酸的电离常数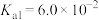 ,
,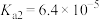 ,碳酸的电离常数
,碳酸的电离常数 ,
, 。回答下列问题:
。回答下列问题:
(1) 发生第一步水解的离子方程式为
发生第一步水解的离子方程式为___________ 。
(2)相同条件下,同浓度的① ,②
,② ,③
,③ ,④
,④ 四种溶液的pH由大到小的顺序为
四种溶液的pH由大到小的顺序为___________ (用编号表示)。
(3)将等浓度、等体积的 溶液与盐酸混合,溶液显酸性。混合后所得溶液中下列关系成立的是
溶液与盐酸混合,溶液显酸性。混合后所得溶液中下列关系成立的是___________ 。
a.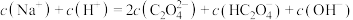
b.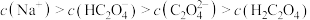
c.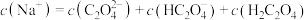
d.
(4) 溶液常用作氧化还原滴定的标准液。实验室欲配制250mL0.10mol⋅L-1的
溶液常用作氧化还原滴定的标准液。实验室欲配制250mL0.10mol⋅L-1的 溶液。
溶液。
①需称取 固体
固体___________ g。
②配制溶液时,需要的玻璃仪器除烧杯、玻璃棒、量筒外还应有___________ 。
(5)用 标准液测定某高锰酸钾样品的纯度:
标准液测定某高锰酸钾样品的纯度:
步骤I:称取2.0g高锰酸钾样品,配成100mL溶液,取20mL溶液于锥形瓶中,并加入少量硫酸酸化。
步骤Ⅱ:用(4)中配制的 标准液进行滴定,平行滴定三次,记录消耗
标准液进行滴定,平行滴定三次,记录消耗 溶液的体积如下表:
溶液的体积如下表:
①滴定终点判断的依据是___________ 。
②平均消耗 溶液的体积为
溶液的体积为_________ mL,样品中 的质量分数为
的质量分数为_________ 。
③若(4)中称取的 固体已部分吸水潮解,会使测得的样品中
固体已部分吸水潮解,会使测得的样品中 的质量分数
的质量分数_________ (填“偏高”、“偏低”或“不变”)。
 )常用作还原剂。已知常温下,草酸的电离常数
)常用作还原剂。已知常温下,草酸的电离常数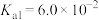 ,
,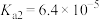 ,碳酸的电离常数
,碳酸的电离常数 ,
, 。回答下列问题:
。回答下列问题:(1)
 发生第一步水解的离子方程式为
发生第一步水解的离子方程式为(2)相同条件下,同浓度的①
 ,②
,② ,③
,③ ,④
,④ 四种溶液的pH由大到小的顺序为
四种溶液的pH由大到小的顺序为(3)将等浓度、等体积的
 溶液与盐酸混合,溶液显酸性。混合后所得溶液中下列关系成立的是
溶液与盐酸混合,溶液显酸性。混合后所得溶液中下列关系成立的是a.
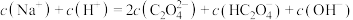
b.
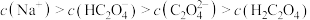
c.
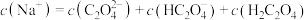
d.

(4)
 溶液常用作氧化还原滴定的标准液。实验室欲配制250mL0.10mol⋅L-1的
溶液常用作氧化还原滴定的标准液。实验室欲配制250mL0.10mol⋅L-1的 溶液。
溶液。①需称取
 固体
固体②配制溶液时,需要的玻璃仪器除烧杯、玻璃棒、量筒外还应有
(5)用
 标准液测定某高锰酸钾样品的纯度:
标准液测定某高锰酸钾样品的纯度:步骤I:称取2.0g高锰酸钾样品,配成100mL溶液,取20mL溶液于锥形瓶中,并加入少量硫酸酸化。
步骤Ⅱ:用(4)中配制的
 标准液进行滴定,平行滴定三次,记录消耗
标准液进行滴定,平行滴定三次,记录消耗 溶液的体积如下表:
溶液的体积如下表:| 第1次 | 第2次 | 第3次 | |
消耗 溶液的体积/mL 溶液的体积/mL | 49.80 | 46.75 | 50.20 |
②平均消耗
 溶液的体积为
溶液的体积为 的质量分数为
的质量分数为③若(4)中称取的
 固体已部分吸水潮解,会使测得的样品中
固体已部分吸水潮解,会使测得的样品中 的质量分数
的质量分数
您最近半年使用:0次



