名校
1 . I.铁镁合金是一种性能优异的储氢材料。关于铁镁两种元素,请回答下列问题:
(1)同周期元素中,第一电离能小于镁的元素有_______ 种。
(2)基态Fe原子的简化电子排布式为_______ ,空间运动状态有_______ 种,Fe位于元周期表的_______ 区,基态原子的电子有_______ 种伸展方向。
(3)与Fe元素同周期,基态原子有2个未成对电子的金属元素有_______ 种,下列状态的铁中,电离最外层一个电子所需能量最大的是_______ (填标号)。
a.[Ar] b.[Ar]
b.[Ar]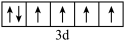
c.[Ar] d.[Ar]
d.[Ar]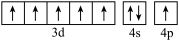
(4)试从结构角度解释 易被氧化为
易被氧化为
_______ 。
(5)对于呋喃: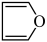 和吡咯:
和吡咯: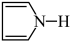 )所含的元素中,电负性最大的是
)所含的元素中,电负性最大的是_______ ,最小的是_______ ;第一电离能最大的是_______ 。
Ⅱ. 在食品、医药、电子工业中用途广泛。回答下列问题:
在食品、医药、电子工业中用途广泛。回答下列问题:
(6) 可做净水剂,其理由是
可做净水剂,其理由是_______ (用离子方程式表示)。
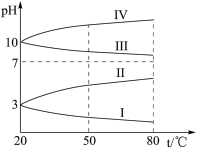
(7)下图是0.1mol/L电解质溶液的pH随温度变化的图像。其中符合0.1mol/L 溶液的是
溶液的是_______ (填罗马数字)。
(8)20℃时,0.1mol/L 溶液中,
溶液中, =
=_______ mol/L(写出准确数值)。
Ⅲ、某同学用酸性KMnO4溶液测定绿矾产品中Fe2+含量:请回答下列问题:
反应原理为: (Mn2+在溶液中为无色)
(Mn2+在溶液中为无色)
a.称取11.5g绿矾产品,溶解,配制成1000mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点
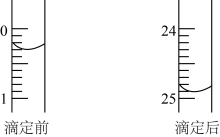
(9)若甲学生在实验过程中,记录滴定前后滴定管内液面读数如图所示,则此时消耗标准溶液的体积为_______ mL。
(10)此滴定实验达到终点的颜色变化为_______ 。
(11)重复滴定4次,每次消耗酸性KMnO4标准溶液的体积如表所示:
计算上述样品中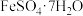 的质量分数为
的质量分数为_______ 。( ,小数点后保留一位)
,小数点后保留一位)
(12)若滴定前平视读数,滴定终点时仰视读数,则所测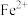 含量:
含量:_______ 。(填“无影响”、“偏高”或“偏低”)。
(1)同周期元素中,第一电离能小于镁的元素有
(2)基态Fe原子的简化电子排布式为
(3)与Fe元素同周期,基态原子有2个未成对电子的金属元素有
a.[Ar]
 b.[Ar]
b.[Ar]
c.[Ar]
 d.[Ar]
d.[Ar]
(4)试从结构角度解释
 易被氧化为
易被氧化为
(5)对于呋喃:
 和吡咯:
和吡咯: )所含的元素中,电负性最大的是
)所含的元素中,电负性最大的是Ⅱ.
 在食品、医药、电子工业中用途广泛。回答下列问题:
在食品、医药、电子工业中用途广泛。回答下列问题:(6)
 可做净水剂,其理由是
可做净水剂,其理由是(7)下图是0.1mol/L电解质溶液的pH随温度变化的图像。其中符合0.1mol/L
 溶液的是
溶液的是

(8)20℃时,0.1mol/L
 溶液中,
溶液中, =
=Ⅲ、某同学用酸性KMnO4溶液测定绿矾产品中Fe2+含量:请回答下列问题:
反应原理为:
 (Mn2+在溶液中为无色)
(Mn2+在溶液中为无色)a.称取11.5g绿矾产品,溶解,配制成1000mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点
(9)若甲学生在实验过程中,记录滴定前后滴定管内液面读数如图所示,则此时消耗标准溶液的体积为
(10)此滴定实验达到终点的颜色变化为
(11)重复滴定4次,每次消耗酸性KMnO4标准溶液的体积如表所示:
| 第一次 | 第二次 | 第三次 | 第四次 | |
| V(KMnO4溶液)/mL | 17.10 | 19.98 | 20.00 | 20.02 |
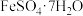 的质量分数为
的质量分数为 ,小数点后保留一位)
,小数点后保留一位)(12)若滴定前平视读数,滴定终点时仰视读数,则所测
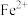 含量:
含量:
您最近一年使用:0次
2 . 草酸钠( )常用作还原剂。已知常温下,草酸的电离常数
)常用作还原剂。已知常温下,草酸的电离常数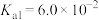 ,
,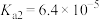 ,碳酸的电离常数
,碳酸的电离常数 ,
, 。回答下列问题:
。回答下列问题:
(1) 发生第一步水解的离子方程式为
发生第一步水解的离子方程式为___________ 。
(2)相同条件下,同浓度的① ,②
,② ,③
,③ ,④
,④ 四种溶液的pH由大到小的顺序为
四种溶液的pH由大到小的顺序为___________ (用编号表示)。
(3)将等浓度、等体积的 溶液与盐酸混合,溶液显酸性。混合后所得溶液中下列关系成立的是
溶液与盐酸混合,溶液显酸性。混合后所得溶液中下列关系成立的是___________ 。
a.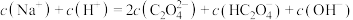
b.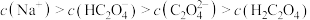
c.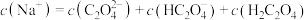
d.
(4) 溶液常用作氧化还原滴定的标准液。实验室欲配制250mL0.10mol⋅L-1的
溶液常用作氧化还原滴定的标准液。实验室欲配制250mL0.10mol⋅L-1的 溶液。
溶液。
①需称取 固体
固体___________ g。
②配制溶液时,需要的玻璃仪器除烧杯、玻璃棒、量筒外还应有___________ 。
(5)用 标准液测定某高锰酸钾样品的纯度:
标准液测定某高锰酸钾样品的纯度:
步骤I:称取2.0g高锰酸钾样品,配成100mL溶液,取20mL溶液于锥形瓶中,并加入少量硫酸酸化。
步骤Ⅱ:用(4)中配制的 标准液进行滴定,平行滴定三次,记录消耗
标准液进行滴定,平行滴定三次,记录消耗 溶液的体积如下表:
溶液的体积如下表:
①滴定终点判断的依据是___________ 。
②平均消耗 溶液的体积为
溶液的体积为_________ mL,样品中 的质量分数为
的质量分数为_________ 。
③若(4)中称取的 固体已部分吸水潮解,会使测得的样品中
固体已部分吸水潮解,会使测得的样品中 的质量分数
的质量分数_________ (填“偏高”、“偏低”或“不变”)。
 )常用作还原剂。已知常温下,草酸的电离常数
)常用作还原剂。已知常温下,草酸的电离常数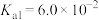 ,
,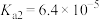 ,碳酸的电离常数
,碳酸的电离常数 ,
, 。回答下列问题:
。回答下列问题:(1)
 发生第一步水解的离子方程式为
发生第一步水解的离子方程式为(2)相同条件下,同浓度的①
 ,②
,② ,③
,③ ,④
,④ 四种溶液的pH由大到小的顺序为
四种溶液的pH由大到小的顺序为(3)将等浓度、等体积的
 溶液与盐酸混合,溶液显酸性。混合后所得溶液中下列关系成立的是
溶液与盐酸混合,溶液显酸性。混合后所得溶液中下列关系成立的是a.
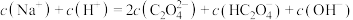
b.
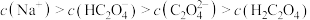
c.
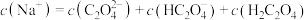
d.

(4)
 溶液常用作氧化还原滴定的标准液。实验室欲配制250mL0.10mol⋅L-1的
溶液常用作氧化还原滴定的标准液。实验室欲配制250mL0.10mol⋅L-1的 溶液。
溶液。①需称取
 固体
固体②配制溶液时,需要的玻璃仪器除烧杯、玻璃棒、量筒外还应有
(5)用
 标准液测定某高锰酸钾样品的纯度:
标准液测定某高锰酸钾样品的纯度:步骤I:称取2.0g高锰酸钾样品,配成100mL溶液,取20mL溶液于锥形瓶中,并加入少量硫酸酸化。
步骤Ⅱ:用(4)中配制的
 标准液进行滴定,平行滴定三次,记录消耗
标准液进行滴定,平行滴定三次,记录消耗 溶液的体积如下表:
溶液的体积如下表:| 第1次 | 第2次 | 第3次 | |
消耗 溶液的体积/mL 溶液的体积/mL | 49.80 | 46.75 | 50.20 |
②平均消耗
 溶液的体积为
溶液的体积为 的质量分数为
的质量分数为③若(4)中称取的
 固体已部分吸水潮解,会使测得的样品中
固体已部分吸水潮解,会使测得的样品中 的质量分数
的质量分数
您最近一年使用:0次
3 . Ⅰ.已知25℃时部分弱电解质的电离平衡常数如下表所示,请回答下列问题:
(1)25℃时 溶液显
溶液显___________ (填“酸性”、“碱性”或“中性”)。
(2)25℃时物质的量浓度均为0.1mol/L的 、NaClO、
、NaClO、 三种溶液中pH最小的是
三种溶液中pH最小的是___________ (填化学式)。
(3)常温下,向HCN溶液中加入等体积、等浓度的NaCN溶液,所得混合溶液中所有离子的浓度由大到小的顺序为___________ 。
(4)25℃时,向 溶液中加入NaOH固体到pH=7,则
溶液中加入NaOH固体到pH=7,则
___________ 。
Ⅱ.某科研单位利用NO-空气质子交换膜燃料电池制备高纯铬和硫酸的简单装置如下图所示:

(5)①Pt(Ⅰ)电极上发生的电极反应式为___________ 。
②X膜为___________ 离子交换膜(填“阴”或“阳”)。
③理论上,若Pt(Ⅱ)电极上参加反应的NO在标况下的体积为4.48L,则Cr棒增重___________ g。
| 化学式 |  |  |  |  |  |
| 电离常数 |  |  |  |  |   |
(1)25℃时
 溶液显
溶液显(2)25℃时物质的量浓度均为0.1mol/L的
 、NaClO、
、NaClO、 三种溶液中pH最小的是
三种溶液中pH最小的是(3)常温下,向HCN溶液中加入等体积、等浓度的NaCN溶液,所得混合溶液中所有离子的浓度由大到小的顺序为
(4)25℃时,向
 溶液中加入NaOH固体到pH=7,则
溶液中加入NaOH固体到pH=7,则
Ⅱ.某科研单位利用NO-空气质子交换膜燃料电池制备高纯铬和硫酸的简单装置如下图所示:

(5)①Pt(Ⅰ)电极上发生的电极反应式为
②X膜为
③理论上,若Pt(Ⅱ)电极上参加反应的NO在标况下的体积为4.48L,则Cr棒增重
您最近一年使用:0次
名校
解题方法
4 . 请根据要求填写:
Ⅰ.电化学:如图为燃料电池简单示意图,其中两电极均为石墨电极。若a处通入CH4,b处通入O2;
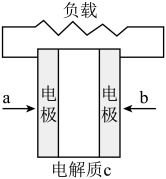
(1)若电解质溶液为KOH溶液,则负极电极反应式为:___________
(2)若电解质为熔融K2CO3,则负极电极反应式为:___________
(3)若电解质为熔融氧化物(Y2O3),则负极电极反应式为:___________
(4)请写出用惰性电极电解CuSO4溶液的电极反应方程式阴极:___________ ;阳极:___________ ;总反应方程式:___________
Ⅱ.回答下列问题
(5)常温下,pH=3的NH4Cl溶液中,由水电离出的氢离子浓度___________ ,溶液中氢氧根离子浓度为___________
(6)将一定浓度和体积的氨水与氯化铵溶液混合后pH=7,则离子浓度大小关系为___________
(7)某溶液中n(Na2CO3):n(NaHCO3)=1:2,写出该溶液中含钠微粒与含碳微粒之间的物料守恒式___________
(8)等NH 浓度的下列溶液中,溶质浓度的大小关系为:
浓度的下列溶液中,溶质浓度的大小关系为:___________
①NH4Cl ②CH3COONH4 ③(NH4)2SO4 ④(NH4)2CO3
Ⅰ.电化学:如图为燃料电池简单示意图,其中两电极均为石墨电极。若a处通入CH4,b处通入O2;

(1)若电解质溶液为KOH溶液,则负极电极反应式为:
(2)若电解质为熔融K2CO3,则负极电极反应式为:
(3)若电解质为熔融氧化物(Y2O3),则负极电极反应式为:
(4)请写出用惰性电极电解CuSO4溶液的电极反应方程式阴极:
Ⅱ.回答下列问题
(5)常温下,pH=3的NH4Cl溶液中,由水电离出的氢离子浓度
(6)将一定浓度和体积的氨水与氯化铵溶液混合后pH=7,则离子浓度大小关系为
(7)某溶液中n(Na2CO3):n(NaHCO3)=1:2,写出该溶液中含钠微粒与含碳微粒之间的物料守恒式
(8)等NH
 浓度的下列溶液中,溶质浓度的大小关系为:
浓度的下列溶液中,溶质浓度的大小关系为:①NH4Cl ②CH3COONH4 ③(NH4)2SO4 ④(NH4)2CO3
您最近一年使用:0次
名校
解题方法
5 . 某实验小组同学探究常温下氨水和醋酸的性质,查阅资料: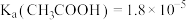 ,
,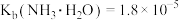 ,该小组同学在实验室进行如下实验操作。回答下列问题:
,该小组同学在实验室进行如下实验操作。回答下列问题:
(1)用pH试纸测定 氨水的pH约为11,用化学用语说明氨水显碱性的原因:
氨水的pH约为11,用化学用语说明氨水显碱性的原因:_______ ,测定 醋酸的pH约为
醋酸的pH约为_______ 。
(2)将 氨水与
氨水与 醋酸混合,充分反应后测定溶液的pH
醋酸混合,充分反应后测定溶液的pH_______ (填“>”“=”“<”)7,说明原因:_______ 。
(3)测定 溶液的
溶液的
_______ 。向 醋酸中滴加
醋酸中滴加 溶液,所得溶液的pH
溶液,所得溶液的pH_______ (填“>”“=”“<”)7,用化学用语说明原因:_______ ,将所得溶液中的离子浓度从大到小排列:_______ 。
(4)若向氨水中加入稀硫酸至溶液的 ,此时溶液中
,此时溶液中 ,则
,则
_______ 。
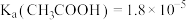 ,
,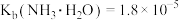 ,该小组同学在实验室进行如下实验操作。回答下列问题:
,该小组同学在实验室进行如下实验操作。回答下列问题:(1)用pH试纸测定
 氨水的pH约为11,用化学用语说明氨水显碱性的原因:
氨水的pH约为11,用化学用语说明氨水显碱性的原因: 醋酸的pH约为
醋酸的pH约为(2)将
 氨水与
氨水与 醋酸混合,充分反应后测定溶液的pH
醋酸混合,充分反应后测定溶液的pH(3)测定
 溶液的
溶液的
 醋酸中滴加
醋酸中滴加 溶液,所得溶液的pH
溶液,所得溶液的pH(4)若向氨水中加入稀硫酸至溶液的
 ,此时溶液中
,此时溶液中 ,则
,则
您最近一年使用:0次
名校
解题方法
6 . 痛风是以关节炎反复发作及产生肾结石为特征的一类疾病,关节炎的原因归结于在关节滑液中形成了尿酸钠(NaUr)晶体,有关平衡如下:① ,②
,②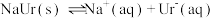 。已知:37℃时,
。已知:37℃时,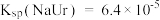 。
。
(1)关节炎发作大多在脚趾和手指的关节处,夏天症状减轻,冬天症状加重,说明反应②是
(2)下列事实可以证明尿酸是弱电解质的是___________
| A.HUr溶液可使石蕊溶液变红 | B.NaUr溶液显碱性 |
| C.常温下,等体积的尿酸溶液导电性比盐酸弱 | D.室温下测10mL0.01mol·L—1HUr溶液pH>2 |
A.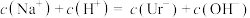 | B.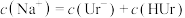 |
C.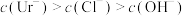 | D.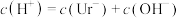 |
 。当向其中加入NaCl(s)至
。当向其中加入NaCl(s)至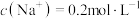 时,NaUr晶体
时,NaUr晶体
您最近一年使用:0次
2023-06-19更新
|
168次组卷
|
3卷引用:上海市嘉定区第一中学2022-2023学年高二上学期期末(等级)考试化学试题
上海市嘉定区第一中学2022-2023学年高二上学期期末(等级)考试化学试题(已下线)专题06 酸碱中和与盐类水解及难溶电解质的沉淀溶解平衡-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(上海专用)陕西省汉中市南郑区铁佛中学2023-2024学年高二上学期12月月考化学试题
7 . 醋酸是日常生活中一种重要的调味品,也是一种重要的化学原料,某科学兴趣小组对醋酸进行如下实验探究,请根据实验结果及相关信息回答下列问题:
(1)常压下,取不同浓度、不同温度的醋酸进行各项内容的测定,得到下表实验数据。
已知:电离度 。
。
①温度升高, 的电离平衡向右移动,能支持该结论的表中数据是
的电离平衡向右移动,能支持该结论的表中数据是_______ (填字母)。
a. b.电离度 c.电离常数 d.
b.电离度 c.电离常数 d.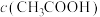
②表中 基本不变的原因是
基本不变的原因是_______ 。
③常温下,在醋酸溶液中加入纯醋酸,醋酸的电离度_______ (填“增大”“减小”或“不变”)。
(2)电解质溶液的电导率越大,导电能力越强。用 的NaOH溶液分别滴定10.00mL浓度均为
的NaOH溶液分别滴定10.00mL浓度均为 的盐酸和
的盐酸和 溶液。利用传感器测得滴定过程中溶液的电导率如图所示。
溶液。利用传感器测得滴定过程中溶液的电导率如图所示。

①曲线②代表滴定_______ (填“HCl”或“ ”)溶液的曲线,
”)溶液的曲线,
_______ 。
②A点溶液中:
_______ 。
③若 ,曲线①B点溶液中离子浓度由大到小的顺序:
,曲线①B点溶液中离子浓度由大到小的顺序:_______ 。
(1)常压下,取不同浓度、不同温度的醋酸进行各项内容的测定,得到下表实验数据。
| 温度/℃ |  | 电离常数 | 电离度/% |  |
| 0 | 16.06 | 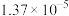 | 9.098 | 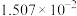 |
| 10 | 15.16 | 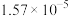 | 10.18 | 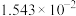 |
| 20 | 13.63 | 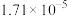 | 11.2 | 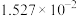 |
已知:电离度
 。
。①温度升高,
 的电离平衡向右移动,能支持该结论的表中数据是
的电离平衡向右移动,能支持该结论的表中数据是a.
 b.电离度 c.电离常数 d.
b.电离度 c.电离常数 d.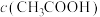
②表中
 基本不变的原因是
基本不变的原因是③常温下,在醋酸溶液中加入纯醋酸,醋酸的电离度
(2)电解质溶液的电导率越大,导电能力越强。用
 的NaOH溶液分别滴定10.00mL浓度均为
的NaOH溶液分别滴定10.00mL浓度均为 的盐酸和
的盐酸和 溶液。利用传感器测得滴定过程中溶液的电导率如图所示。
溶液。利用传感器测得滴定过程中溶液的电导率如图所示。
①曲线②代表滴定
 ”)溶液的曲线,
”)溶液的曲线,
②A点溶液中:

③若
 ,曲线①B点溶液中离子浓度由大到小的顺序:
,曲线①B点溶液中离子浓度由大到小的顺序:
您最近一年使用:0次
名校
8 . 回答下列问题:
(1)已知 时,水的离子积常数
时,水的离子积常数 ,该温度下测得
,该温度下测得 溶液的
溶液的 。则
。则
_______ 25℃(填“>”、“<”或“=”)。 在水溶液中的电离方程式为
在水溶液中的电离方程式为_______ 。
(2)已知氢氟酸、次氯酸、碳酸在室温下的电离常数分别为:
根据上述数据,回答下列问题:
①比较同浓度的 、
、 溶液的
溶液的 值大小:
值大小:
_______  。
。
②少量的 通入
通入 溶液中,写出反应的离子方程式
溶液中,写出反应的离子方程式_______ 。
(3)用标准 溶液对测定白醋中醋酸的浓度,完全反应时所得溶液的
溶液对测定白醋中醋酸的浓度,完全反应时所得溶液的 大致为9。
大致为9。
①该实验应选用_______ 作指示剂:判断酸碱中和滴定反应到达滴定终点时的现象为_______ 。
②为减小实验误差,一共进行了三次实验,假设每次所取白醋体积均为 ,
, 标准液浓度为
标准液浓度为 ,三次实验结果记录如表:
,三次实验结果记录如表:
从上表可以看出,第一次实验中记录消耗 溶液的体积明显多于后两次,其原因可能是
溶液的体积明显多于后两次,其原因可能是_______ 。
A.实验结束时,俯视刻度线读取滴定终点时 溶液的体积
溶液的体积
B.滴定前碱式滴定管尖嘴有气泡,滴定结束尖嘴部分充满溶液
C.盛装白醋溶液的滴定管用蒸馏水洗过,未用白醋溶液润洗
D.锥形瓶预先用食用白醋润洗过
E.滴加 溶液时,未充分振荡,刚看到溶液变色,立刻停止滴定
溶液时,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)25℃时,有 的一组
的一组 、
、 混合溶液,溶液中
混合溶液,溶液中 和
和 与溶液
与溶液 的关系如图所示。下列说法错误的是_______。
的关系如图所示。下列说法错误的是_______。

(1)已知
 时,水的离子积常数
时,水的离子积常数 ,该温度下测得
,该温度下测得 溶液的
溶液的 。则
。则
 在水溶液中的电离方程式为
在水溶液中的电离方程式为(2)已知氢氟酸、次氯酸、碳酸在室温下的电离常数分别为:
 | 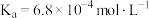 |
 |  |
 |   |
根据上述数据,回答下列问题:
①比较同浓度的
 、
、 溶液的
溶液的 值大小:
值大小:
 。
。②少量的
 通入
通入 溶液中,写出反应的离子方程式
溶液中,写出反应的离子方程式(3)用标准
 溶液对测定白醋中醋酸的浓度,完全反应时所得溶液的
溶液对测定白醋中醋酸的浓度,完全反应时所得溶液的 大致为9。
大致为9。①该实验应选用
②为减小实验误差,一共进行了三次实验,假设每次所取白醋体积均为
 ,
, 标准液浓度为
标准液浓度为 ,三次实验结果记录如表:
,三次实验结果记录如表:| 实验次数 | 第一次 | 第二次 | 第三次 |
消耗 溶液体积/ 溶液体积/ | 26.02 | 25.35 | 25.30 |
从上表可以看出,第一次实验中记录消耗
 溶液的体积明显多于后两次,其原因可能是
溶液的体积明显多于后两次,其原因可能是A.实验结束时,俯视刻度线读取滴定终点时
 溶液的体积
溶液的体积B.滴定前碱式滴定管尖嘴有气泡,滴定结束尖嘴部分充满溶液
C.盛装白醋溶液的滴定管用蒸馏水洗过,未用白醋溶液润洗
D.锥形瓶预先用食用白醋润洗过
E.滴加
 溶液时,未充分振荡,刚看到溶液变色,立刻停止滴定
溶液时,未充分振荡,刚看到溶液变色,立刻停止滴定(4)25℃时,有
 的一组
的一组 、
、 混合溶液,溶液中
混合溶液,溶液中 和
和 与溶液
与溶液 的关系如图所示。下列说法错误的是_______。
的关系如图所示。下列说法错误的是_______。
A.曲线Ⅰ表示 |
B. 的数量级为 的数量级为 |
C. 时, 时,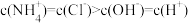 |
D. 时, 时, |
您最近一年使用:0次
2022-03-24更新
|
220次组卷
|
3卷引用:吉林省长春希望高中2021-2022学年高二上学期期末考试化学试题
9 . 回答下列问题:
(1)Ⅰ.已知:在相同条件下醋酸与氨水电离程度相同,现有浓度均为 的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵、⑧氨水。
的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵、⑧氨水。
①、②、③、④四种溶液中由水电离出的 浓度由大到小的顺序是(填序号)
浓度由大到小的顺序是(填序号) ___ ;
④、⑤、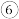 、⑦、⑧五种溶液中
、⑦、⑧五种溶液中 浓度由大到小的顺序是(填序号)
浓度由大到小的顺序是(填序号) ___ 。
Ⅱ.已知 时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
(2)物质的量浓度均为 的四种溶液:
的四种溶液: 由小到大排列的顺序是
由小到大排列的顺序是___ (用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:___
(4)25℃时, 与
与 的混合溶液,若测得混合液
的混合溶液,若测得混合液 ,则溶液中
,则溶液中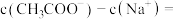
_____ (填准确数值)。
(5)25℃时,将 的醋酸与
的醋酸与 氢氧化钠等体积混合,反应后溶液恰好显中性,用
氢氧化钠等体积混合,反应后溶液恰好显中性,用 、
、 表示醋酸的电离平衡常数为
表示醋酸的电离平衡常数为___
(6)标准状况下,将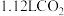 通入
通入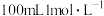 的
的 溶液中,用溶液中微粒的浓度符号完成下列等式:
溶液中,用溶液中微粒的浓度符号完成下列等式: 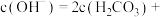
___________
(1)Ⅰ.已知:在相同条件下醋酸与氨水电离程度相同,现有浓度均为
 的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵、⑧氨水。
的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵、⑧氨水。①、②、③、④四种溶液中由水电离出的
 浓度由大到小的顺序是(填序号)
浓度由大到小的顺序是(填序号) ④、⑤、
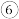 、⑦、⑧五种溶液中
、⑦、⑧五种溶液中 浓度由大到小的顺序是(填序号)
浓度由大到小的顺序是(填序号) Ⅱ.已知
 时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:| 化学式 |  |  |  |
| 电离平衡常数 |  | 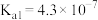  | 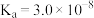 |
 的四种溶液:
的四种溶液: 由小到大排列的顺序是
由小到大排列的顺序是a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:
(4)25℃时,
 与
与 的混合溶液,若测得混合液
的混合溶液,若测得混合液 ,则溶液中
,则溶液中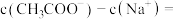
(5)25℃时,将
 的醋酸与
的醋酸与 氢氧化钠等体积混合,反应后溶液恰好显中性,用
氢氧化钠等体积混合,反应后溶液恰好显中性,用 、
、 表示醋酸的电离平衡常数为
表示醋酸的电离平衡常数为(6)标准状况下,将
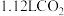 通入
通入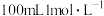 的
的 溶液中,用溶液中微粒的浓度符号完成下列等式:
溶液中,用溶液中微粒的浓度符号完成下列等式: 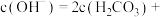
您最近一年使用:0次
解题方法
10 . 某学习小组为了探究 的电离情况,进行了如下实验。
的电离情况,进行了如下实验。
(1)配制并测定醋酸溶液中 的浓度
的浓度
将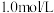 醋酸进行稀释,并用
醋酸进行稀释,并用 标准溶液滴定
标准溶液滴定 稀释后的溶液。4次滴定所消耗
稀释后的溶液。4次滴定所消耗 溶液的体积如下表:
溶液的体积如下表:
①用 溶液滴定醋酸溶液时,需要的玻璃仪器除了酸式滴定管、锥形瓶、烧杯、胶头滴管,还有
溶液滴定醋酸溶液时,需要的玻璃仪器除了酸式滴定管、锥形瓶、烧杯、胶头滴管,还有___________ ;
②该稀释后的醋酸溶液的物质的量浓度为___________ 。
(2)探究浓度对电离程度的影响:下表为 时不同浓度醋酸溶液的
时不同浓度醋酸溶液的
①据表中数据可以得出结论;随着溶液中 浓度的减小,
浓度的减小, 的电离程度将
的电离程度将___________ (填“增大”、“减小”或“不变”);
②已知 时
时 ,此时
,此时 的醋酸溶液中
的醋酸溶液中 的物质的量浓度约为
的物质的量浓度约为___________ mol∙L−1 (保留两位小数,忽略水的电离)。
(3) 标准溶液常用邻苯二甲酸氢钾(可用
标准溶液常用邻苯二甲酸氢钾(可用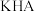 表示)标定。
表示)标定。 时,在某浓度的邻苯二甲酸氢钾溶液中滴加
时,在某浓度的邻苯二甲酸氢钾溶液中滴加 溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。
溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。

已知邻苯二甲酸(可用 表示)
表示) 时
时 ,下列叙述正确的是______。
,下列叙述正确的是______。
 的电离情况,进行了如下实验。
的电离情况,进行了如下实验。(1)配制并测定醋酸溶液中
 的浓度
的浓度将
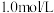 醋酸进行稀释,并用
醋酸进行稀释,并用 标准溶液滴定
标准溶液滴定 稀释后的溶液。4次滴定所消耗
稀释后的溶液。4次滴定所消耗 溶液的体积如下表:
溶液的体积如下表:| 实验次数 | 1 | 2 | 3 | 4 |
所消耗 溶液的体积/ 溶液的体积/ | 20.02 | 20.00 | 22.00 | 19.98 |
 溶液滴定醋酸溶液时,需要的玻璃仪器除了酸式滴定管、锥形瓶、烧杯、胶头滴管,还有
溶液滴定醋酸溶液时,需要的玻璃仪器除了酸式滴定管、锥形瓶、烧杯、胶头滴管,还有②该稀释后的醋酸溶液的物质的量浓度为
(2)探究浓度对电离程度的影响:下表为
 时不同浓度醋酸溶液的
时不同浓度醋酸溶液的
| 浓度/( mol∙L−1) | 0.2000 | 0.1000 | 0.0100 | 0.0010 |
 | 2.83 | 2.88 | 3.38 | 3.88 |
 浓度的减小,
浓度的减小, 的电离程度将
的电离程度将②已知
 时
时 ,此时
,此时 的醋酸溶液中
的醋酸溶液中 的物质的量浓度约为
的物质的量浓度约为(3)
 标准溶液常用邻苯二甲酸氢钾(可用
标准溶液常用邻苯二甲酸氢钾(可用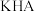 表示)标定。
表示)标定。 时,在某浓度的邻苯二甲酸氢钾溶液中滴加
时,在某浓度的邻苯二甲酸氢钾溶液中滴加 溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。
溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。
已知邻苯二甲酸(可用
 表示)
表示) 时
时 ,下列叙述正确的是______。
,下列叙述正确的是______。| A.混合溶液的导电能力与离子种类及浓度有关 |
B.浓度相同时, 与 与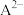 的导电能力之和大于 的导电能力之和大于 的 的 |
C.b点的混合溶液 |
D.c点的混合溶液中: |
您最近一年使用:0次
2022-01-21更新
|
123次组卷
|
2卷引用:浙江省湖州市2021-2022学年高二上学期期末考试化学试题



