辽宁省本溪市第一中学2022-2023学年高二上学期期末考试化学试题
辽宁
高二
期末
2023-01-08
487次
整体难度:
适中
考查范围:
化学反应原理、有机化学基础、认识化学科学、常见无机物及其应用、化学实验基础
辽宁省本溪市第一中学2022-2023学年高二上学期期末考试化学试题
辽宁
高二
期末
2023-01-08
487次
整体难度:
适中
考查范围:
化学反应原理、有机化学基础、认识化学科学、常见无机物及其应用、化学实验基础
一、单选题 添加题型下试题
单选题
|
较易(0.85)
1. 用 的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如图所示,正确的读数为:
的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如图所示,正确的读数为:
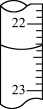
 的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如图所示,正确的读数为:
的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如图所示,正确的读数为:
| A.22.20mL | B.22.35mL | C.23.65mL | D.23.90mL |
【知识点】 酸碱中和滴定实验相关仪器解读
您最近一年使用:0次
2021-11-12更新
|
529次组卷
|
31卷引用:2010-2011年云南省玉溪一中高二下学期期末考试化学试卷
(已下线)2010-2011年云南省玉溪一中高二下学期期末考试化学试卷(已下线)2011-2012学年河南省卫辉市第一中学高二上学期期中考试化学试卷(已下线)2011-2012学年广东省汕头市金山中学高二12月月考化学试卷(已下线)2011-2012学年河北省元氏一中高二上学期期中考试化学试卷(已下线)2012年人教版高中化学选修6 3.2 物质含量的测定练习卷(已下线)2012年鲁科版高中化学选修6 3.2 物质中某组分含量的测定练习卷(已下线)2014年化学高考总复习课时演练 11-1化学实验仪器和基本操作练习卷(已下线)2014届黑龙江省哈师大附中高二上学期期末考试化学试卷(已下线)2015安徽望江中学同步课时练(人教选修4)3.2.3 酸碱中和滴定2015-2016学年内蒙古巴彦淖尔一中高二上期中化学试卷2015-2016学年内蒙古巴彦淖尔一中高二普通班上期中化学试卷2016-2017学年贵州省遵义四中高二上月考二化学试卷甘肃省兰州市第四中学2017-2018学年高二上学期期末考试化学试题湖南省双峰县第一中学2018-2019学年高二上学期第一次月考化学试题河南省正阳高中2018-2019学年高二上学期期中素质检测化学试题(已下线)浙江省宁波市北仑中学2018-2019学年高二下学期期中考试化学试题陕西省榆林市第十二中学2021届高三上学期第二次月考化学试题人教版(2019)高二化学选择性必修1第三章 水溶液中的离子反应与平衡 第二节 水的电离和溶液的pH 课时3 酸碱中和滴定(已下线)练习12 酸碱中和滴定-2020-2021学年【补习教材·寒假作业】高二化学(苏教版)甘肃省武威市民勤县第四中学2020-2021学年高二上学期期末考试(普通班)化学试题甘肃省武威市民勤县第四中学2020-2021学年高二上学期期末考试(实验班)化学试题吉林市第五十五中学2020-2021学年高二上学期期末考试化学试题浙江省宁波市北仑中学2020-2021学年高二下学期期中考试化学(1班)试题2011年普通高等学校招生全国统一考试化学(海南卷)江苏省镇江第一中学2020-2021学年高二下学期期中考试化学试题选择性必修1(SJ)专题3第二单元课时2 酸碱中和滴定浙江省杭州八校联盟2021-2022学年高二上学期期中联考化学试题鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第4节 离子反应贵州省贵州铜仁伟才学校2022-2023学年高二上学期12月月考化学试题辽宁省本溪市第一中学2022-2023学年高二上学期期末考试化学试题3.2.2酸碱中和滴定 课中
2. 化学与生活密切相关,下列说法正确的是
| A.K2FeO4可用于饮水的消毒净化 | B.电解氯化镁溶液可制备单质镁 |
| C.氢能、生物质能是可再生的一次能源 | D.使用加酶洗衣粉时,温度越高效果越好 |
您最近一年使用:0次
2022-01-24更新
|
175次组卷
|
2卷引用:山西省运城市康杰中学2021-2022学年高二上学期期末考试化学试题
单选题
|
适中(0.65)
名校
3. 下列溶液一定呈中性的是
| A.pH=7的溶液 |
| B.c(H+)=c(OH-)=10-6 mol·L-1的溶液 |
| C.c(H+)水=c(OH-)水的溶液 |
| D.常温下pH=2的盐酸与pH=12的氨水等体积混合后的溶液 |
您最近一年使用:0次
2022-03-08更新
|
334次组卷
|
6卷引用:河南省范县第一中学等学校2021-2022学年高二上学期联考检测化学试题
单选题
|
适中(0.65)
4. 在一定条件下,将2molCO和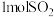 充入一恒容密闭容器中,发生反应:
充入一恒容密闭容器中,发生反应: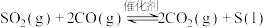
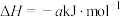 ,当达到平衡状态时,下列说法中正确的是
,当达到平衡状态时,下列说法中正确的是
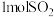 充入一恒容密闭容器中,发生反应:
充入一恒容密闭容器中,发生反应: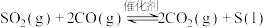
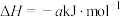 ,当达到平衡状态时,下列说法中正确的是
,当达到平衡状态时,下列说法中正确的是A.生成 | B.放出a kJ热量 |
| C.含有3mol氧原子 | D.CO和 共有2mol 共有2mol |
【知识点】 可逆反应及反应限度解读 化学平衡状态本质及特征解读
您最近一年使用:0次
2023-01-06更新
|
208次组卷
|
2卷引用:辽宁省本溪市第一中学2022-2023学年高二上学期期末考试化学试题
单选题
|
适中(0.65)
名校
解题方法
5. 反应X(s)+Y(g)=3Z(g)的能量变化如图所示。下列判断错误的是
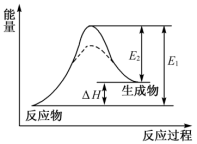

| A.加入催化剂,活化分子的百分数增大,E1和E2均减小 |
| B.△H=+(E1-E2)kJ·mol-1 |
| C.该反应在低温下能自发进行 |
| D.升高温度,活化分子的百分数增大 |
您最近一年使用:0次
2021-01-31更新
|
290次组卷
|
5卷引用:河南省九师联盟2020-2021学年高二上学期1月联考化学试题
单选题
|
适中(0.65)
名校
解题方法
6. 室温下,下列溶液中c( )最大的是
)最大的是
 )最大的是
)最大的是| A.0.1mol·L-1的NH4HSO4溶液 | B.0.1mol·L-1的氨水 |
| C.0.1mol·L-1的NH4HCO3溶液 | D.0.1mol·L-1的NH4Cl溶液 |
【知识点】 弱电解质的电离平衡 盐溶液中离子浓度大小的比较解读
您最近一年使用:0次
2021-01-31更新
|
195次组卷
|
4卷引用:河南省九师联盟2020-2021学年高二上学期1月联考化学试题
单选题
|
适中(0.65)
7. 下列事实不能用勒夏特列原理解释的是
A.重铬酸钾溶液中滴加NaOH溶液,溶液由橙色变黄色[重铬酸钾溶液中存在: ] ] |
B.向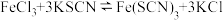 平衡体系中加入少量KSCN固体,溶液颜色加深 平衡体系中加入少量KSCN固体,溶液颜色加深 |
| C.氯水宜保存在低温、避光条件下 |
| D.加入催化剂,加快氮气和氢气转化为氨气的速率 |
您最近一年使用:0次
2021-08-07更新
|
376次组卷
|
4卷引用:选择性必修1 专题2 第三单元 课时1 影响化学平衡的因素
单选题
|
适中(0.65)
名校
解题方法
8. 某化学兴趣小组组装了如图所示的实验装置,电极I为Al,电极II、IV为石墨,电极III为铜,盐桥中含KCl,下列说法正确的是
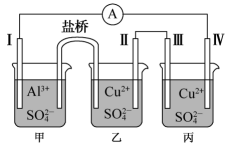

| A.电流方向:电极I→电极IV |
| B.盐桥中的K+向电极I作定向移动 |
| C.电极III为阳极,电极反应式为Cu2++2e-=Cu |
| D.乙池中c(Cu2+)浓度减小,丙池中c(Cu2+)浓度不变 |
您最近一年使用:0次
2021-01-31更新
|
241次组卷
|
4卷引用:河南省九师联盟2020-2021学年高二上学期1月联考化学试题
单选题
|
适中(0.65)
解题方法
9. 一定条件下进行反应: 。向2.0L恒容密闭容器中充入1.0mol
。向2.0L恒容密闭容器中充入1.0mol ,反应过程中测得的有关数据见表:
,反应过程中测得的有关数据见表:
下列说法不正确的是
 。向2.0L恒容密闭容器中充入1.0mol
。向2.0L恒容密闭容器中充入1.0mol ,反应过程中测得的有关数据见表:
,反应过程中测得的有关数据见表:| t/s | 0 | 2 | 4 | 6 | 8 |
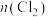 /mol /mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
A.0~2s生成 的平均反应速率比2~4s生成 的平均反应速率比2~4s生成 的平均反应速率快 的平均反应速率快 |
B.0~2s 的平均分解速率为 的平均分解速率为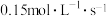 |
| C.6s时,反应已达到最大限度 |
D.若起始时充入2.0mol ,则 ,则 的平衡转化率小于40% 的平衡转化率小于40% |
您最近一年使用:0次
2023-01-06更新
|
277次组卷
|
2卷引用:辽宁省本溪市第一中学2022-2023学年高二上学期期末考试化学试题
单选题
|
较难(0.4)
名校
10. 常温下, 的二元酸
的二元酸 的溶液与等浓度的
的溶液与等浓度的 溶液等体积混合(忽略混合后体积的变化),所得溶液中
溶液等体积混合(忽略混合后体积的变化),所得溶液中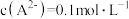 。则混合溶液的
。则混合溶液的 为
为
 的二元酸
的二元酸 的溶液与等浓度的
的溶液与等浓度的 溶液等体积混合(忽略混合后体积的变化),所得溶液中
溶液等体积混合(忽略混合后体积的变化),所得溶液中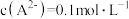 。则混合溶液的
。则混合溶液的 为
为| A.1 | B.2 | C.3 | D.无法计算 |
您最近一年使用:0次
2021-01-05更新
|
693次组卷
|
16卷引用:安徽省名校2020-2021学年高二上学期12月联考化学试题
安徽省名校2020-2021学年高二上学期12月联考化学试题河南省九师联盟2020-2021学年高二上学期1月联考化学试题河南省顶尖名校联盟2020-2021学年高二12月联考化学试题湖南省长沙市雅礼中学2020-2021学年高二下学期开学考化学试题广西北海市2020-2021学年高二下学期期末教学质量检测化学试题河南省洛阳市豫西名校2021-2022学年高二上学期第一次联考化学试题山西省运城市康杰中学2021-2022学年高二上学期期中化学试题山西省三重教育2021-2022学年高二上学期名校联考化学试题 湖南省临澧县第一中学2021-2022学年高二上学期期中段考化学试题湖南省常德市临澧县第一中学2021-2022学年高二上学期期中考试化学试题山西省运城市康杰中学2021-2022学年高二上学期期末考试化学试题辽宁省营口开发区第一高级中学2022-2023学年高二上学期11月月考化学试题内蒙古兴安盟乌兰浩特市第一中学2022-2023学年高二上学期期中考试化学试题山西省太原师范学院附属中学2022-2023学年高二上学期12月月考化学试题黑龙江省绥化市绥棱县第一中学2022-2023学年高二上学期期中考试化学试题辽宁省本溪市第一中学2022-2023学年高二上学期期末考试化学试题
单选题
|
适中(0.65)
解题方法
11. 下列用来表示物质变化的化学用语中,正确的是
A.明矾水解的离子方程式: |
B.用 溶液做导电实验,灯泡发光: 溶液做导电实验,灯泡发光: |
C.以石墨作电极电解氯化镁溶液: |
D.表示氢气燃烧热的热化学方程式: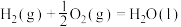 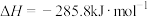 |
您最近一年使用:0次
12. 25℃时,用 的NaCl溶液滴定25.00mL
的NaCl溶液滴定25.00mL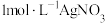 溶液的滴定曲线如图所示,
溶液的滴定曲线如图所示,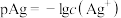 ,
,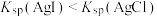 。下列有关叙述错误的是
。下列有关叙述错误的是

 的NaCl溶液滴定25.00mL
的NaCl溶液滴定25.00mL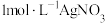 溶液的滴定曲线如图所示,
溶液的滴定曲线如图所示,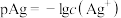 ,
,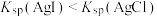 。下列有关叙述错误的是
。下列有关叙述错误的是
A.25℃时, |
| B.x点的横坐标为12.5 |
C.当滴入25.00mLNaCl溶液时,溶液中 |
D.相同条件下,若改为 的NaI溶液,反应终点的纵坐标值会增大 的NaI溶液,反应终点的纵坐标值会增大 |
【知识点】 难溶电解质的溶解平衡 溶度积常数相关计算解读
您最近一年使用:0次
单选题
|
适中(0.65)
名校
解题方法
13. 室温下,某实验小组的同学将0.1mol·L-1的HNO2溶液和0.1mol·L-1的KOH溶液混合(忽略体积变化),实验数据如表所示:
下列判断正确的是
| 实验编号 | 溶液体积(mL) | 混合后溶液的pH | |
| HNO2 | KOH | ||
| ① | 10 | 10 | 9 |
| ② | 10 | a | 7 |
| ③ | 20 | 10 | 4 |
| A.水电离的c(H+):③>①>② |
B.实验②所得的混合溶液中:c(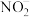 )=c(K+),且a>10 )=c(K+),且a>10 |
C.实验②所得的混合溶液中:c(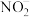 )+c(HNO2)=0.1mol·L-1 )+c(HNO2)=0.1mol·L-1 |
D.实验③所得的混合溶液中:c(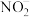 )>c(K+)>c(HNO2)>c(H+)>c(OH-) )>c(K+)>c(HNO2)>c(H+)>c(OH-) |
您最近一年使用:0次
2021-01-31更新
|
193次组卷
|
5卷引用:河南省九师联盟2020-2021学年高二上学期1月联考化学试题
单选题
|
适中(0.65)
名校
解题方法
14. 以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备次氯酸钠,装置如图所示,其中P端通入CO2。则下列说法中不正确的是
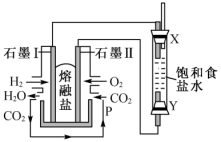

| A.通入标准状况下44.8LO2,理论上可得到149gNaClO |
| B.X端为阴极,电极反应式为2H2O+2e-=H2↑+2OH- |
| C.Y端为阳极,发生氧化反应,有氯气生成 |
D.石墨I电极反应式为H2-2e-+ =CO2+H2O =CO2+H2O |
您最近一年使用:0次
2021-01-31更新
|
296次组卷
|
5卷引用:河南省九师联盟2020-2021学年高二上学期1月联考化学试题
单选题
|
适中(0.65)
名校
解题方法
15. 常温下,各微粒H2A、HA-和A2-存在于H2A和NaOH溶液反应后的溶液中,它们的分布系数δ[如δ(HA-)=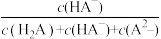 ]与溶液pH的关系如图所示。下列说法错误的是
]与溶液pH的关系如图所示。下列说法错误的是
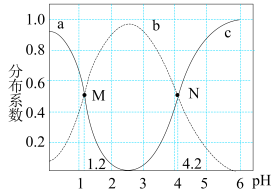
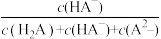 ]与溶液pH的关系如图所示。下列说法错误的是
]与溶液pH的关系如图所示。下列说法错误的是
| A.图中曲线b为δ(HA-) |
| B.常温下,H2A的Ka2=10-4.2 |
| C.等浓度的Na2A和NaHA的混合溶液:c(H+)<c(OH-) |
| D.N点时,c(Na+)+c(H+)=c(OH-)+3c(A2-) |
您最近一年使用:0次
2021-01-31更新
|
387次组卷
|
6卷引用:河南省九师联盟2020-2021学年高二上学期1月联考化学试题
二、解答题 添加题型下试题
解答题-实验探究题
|
较难(0.4)
名校
解题方法
16. 亚硝酸钠( )是一种工业盐,外观与食盐非常相似,但有毒。某化学兴趣小组欲测定某
)是一种工业盐,外观与食盐非常相似,但有毒。某化学兴趣小组欲测定某 样品的纯度,并对NaCl与
样品的纯度,并对NaCl与 进行鉴别。
进行鉴别。
I.甲组同学测定 样品的纯度。
样品的纯度。
称取mg试样于锥形瓶中,加入适量水溶解,然后用 的
的 溶液(适量稀
溶液(适量稀 酸化)进行滴定,并重复上述操作3次。已知:
酸化)进行滴定,并重复上述操作3次。已知: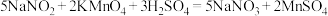
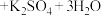 。
。
(1)甲组同学在滴定时应选用的滴定装置是_______ (填“A”或“B”)。

(2)滴定达到终点的现象是_______ 。
(3)若滴定至终点时平均消耗VmL标准溶液,则该产品的纯度为_______ (用含c、m、V的代数式表示)。
II.乙组同学设计实验鉴别NaCl和 。
。
(4)常温下,用pH试纸分别测定 两种盐溶液的pH,测得
两种盐溶液的pH,测得 溶液的pH=9,即
溶液的pH=9,即 溶液呈碱性,其原因是
溶液呈碱性,其原因是_______ (用离子方程式表示); 溶液中各离子浓度的大小关系为
溶液中各离子浓度的大小关系为_______ 。
(5)已知: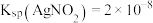 ,
, 。分别向同浓度的两种盐溶液中滴入同浓度的
。分别向同浓度的两种盐溶液中滴入同浓度的 溶液,先出现沉淀的是
溶液,先出现沉淀的是_______ (填“NaCl”或“ ”)溶液。
”)溶液。
 )是一种工业盐,外观与食盐非常相似,但有毒。某化学兴趣小组欲测定某
)是一种工业盐,外观与食盐非常相似,但有毒。某化学兴趣小组欲测定某 样品的纯度,并对NaCl与
样品的纯度,并对NaCl与 进行鉴别。
进行鉴别。I.甲组同学测定
 样品的纯度。
样品的纯度。称取mg试样于锥形瓶中,加入适量水溶解,然后用
 的
的 溶液(适量稀
溶液(适量稀 酸化)进行滴定,并重复上述操作3次。已知:
酸化)进行滴定,并重复上述操作3次。已知: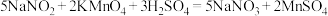
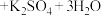 。
。(1)甲组同学在滴定时应选用的滴定装置是

(2)滴定达到终点的现象是
(3)若滴定至终点时平均消耗VmL标准溶液,则该产品的纯度为
II.乙组同学设计实验鉴别NaCl和
 。
。(4)常温下,用pH试纸分别测定
 两种盐溶液的pH,测得
两种盐溶液的pH,测得 溶液的pH=9,即
溶液的pH=9,即 溶液呈碱性,其原因是
溶液呈碱性,其原因是 溶液中各离子浓度的大小关系为
溶液中各离子浓度的大小关系为(5)已知:
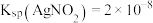 ,
, 。分别向同浓度的两种盐溶液中滴入同浓度的
。分别向同浓度的两种盐溶液中滴入同浓度的 溶液,先出现沉淀的是
溶液,先出现沉淀的是 ”)溶液。
”)溶液。
您最近一年使用:0次
2022-11-19更新
|
270次组卷
|
3卷引用:辽宁省朝阳市建平县实验中学2022-2023学年高二上学期期中考试化学试题
解答题-原理综合题
|
较难(0.4)
解题方法
17. CO是生产羰基化学品的基本原料。对于以水煤气为原料提取C.的工艺,如果氢气未能充分利用,则提高了CO生产成本,所以在煤化工中常需研究不同温度下的平衡常数、投料比及热值问题。反应 的平衡常数随温度的变化如下表:
的平衡常数随温度的变化如下表:
回答下列问题:
(1)上述反应的平衡常数表达式为K=_______ ;该反应是_______ (填“放热”或“吸热”)反应。
(2)已知在一定温度下: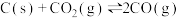
 ;
;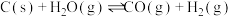
 ;
;
 。则K与
。则K与 、
、 之间的关系是
之间的关系是_______ 。
(3)800℃时,在2L的恒容密闭容器中,充入2.0molCO(g)和3.0mol ,保持温度不变进行反应:
,保持温度不变进行反应: ,4min时反应达到平衡,测得CO的转化率为60%。
,4min时反应达到平衡,测得CO的转化率为60%。
①0~4min内, 的平均反应速率为
的平均反应速率为_______  ,800℃时a=
,800℃时a=_______ 。
②800℃时四个不同容器中发生上述反应,测得各物质的浓度( )如下表,其中达到平衡的是
)如下表,其中达到平衡的是_______ (填字母)。
③上述反应过程中 的物质的量随时间变化的图像如图所示,画出加入催化剂后
的物质的量随时间变化的图像如图所示,画出加入催化剂后 的物质的量的变化图(用虚线表示)
的物质的量的变化图(用虚线表示) _______ 。

 的平衡常数随温度的变化如下表:
的平衡常数随温度的变化如下表:| 温度/℃ | 400 | 500 | 800 |
平衡常数 | 9.94 | 9 | a |
回答下列问题:
(1)上述反应的平衡常数表达式为K=
(2)已知在一定温度下:
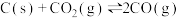
 ;
;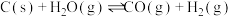
 ;
;
 。则K与
。则K与 、
、 之间的关系是
之间的关系是(3)800℃时,在2L的恒容密闭容器中,充入2.0molCO(g)和3.0mol
 ,保持温度不变进行反应:
,保持温度不变进行反应: ,4min时反应达到平衡,测得CO的转化率为60%。
,4min时反应达到平衡,测得CO的转化率为60%。①0~4min内,
 的平均反应速率为
的平均反应速率为 ,800℃时a=
,800℃时a=②800℃时四个不同容器中发生上述反应,测得各物质的浓度(
 )如下表,其中达到平衡的是
)如下表,其中达到平衡的是| 编号 浓度 | A | B | C | D |
 | 3 | 1 | 0.8 | 1 |
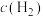 | 2 | 1 | 0.8 | 1 |
 | 1 | 2 | 3 | 0.5 |
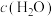 | 2 | 2 | 3 | 2 |
③上述反应过程中
 的物质的量随时间变化的图像如图所示,画出加入催化剂后
的物质的量随时间变化的图像如图所示,画出加入催化剂后 的物质的量的变化图(用虚线表示)
的物质的量的变化图(用虚线表示) 
您最近一年使用:0次
解答题-原理综合题
|
较易(0.85)
18. 醋酸是日常生活中一种重要的调味品,也是一种重要的化学原料,某科学兴趣小组对醋酸进行如下实验探究,请根据实验结果及相关信息回答下列问题:
(1)常压下,取不同浓度、不同温度的醋酸进行各项内容的测定,得到下表实验数据。
已知:电离度 。
。
①温度升高, 的电离平衡向右移动,能支持该结论的表中数据是
的电离平衡向右移动,能支持该结论的表中数据是_______ (填字母)。
a. b.电离度 c.电离常数 d.
b.电离度 c.电离常数 d.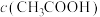
②表中 基本不变的原因是
基本不变的原因是_______ 。
③常温下,在醋酸溶液中加入纯醋酸,醋酸的电离度_______ (填“增大”“减小”或“不变”)。
(2)电解质溶液的电导率越大,导电能力越强。用 的NaOH溶液分别滴定10.00mL浓度均为
的NaOH溶液分别滴定10.00mL浓度均为 的盐酸和
的盐酸和 溶液。利用传感器测得滴定过程中溶液的电导率如图所示。
溶液。利用传感器测得滴定过程中溶液的电导率如图所示。

①曲线②代表滴定_______ (填“HCl”或“ ”)溶液的曲线,
”)溶液的曲线,
_______ 。
②A点溶液中:
_______ 。
③若 ,曲线①B点溶液中离子浓度由大到小的顺序:
,曲线①B点溶液中离子浓度由大到小的顺序:_______ 。
(1)常压下,取不同浓度、不同温度的醋酸进行各项内容的测定,得到下表实验数据。
| 温度/℃ |  | 电离常数 | 电离度/% |  |
| 0 | 16.06 | 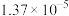 | 9.098 | 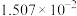 |
| 10 | 15.16 | 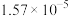 | 10.18 | 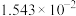 |
| 20 | 13.63 | 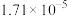 | 11.2 | 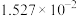 |
已知:电离度
 。
。①温度升高,
 的电离平衡向右移动,能支持该结论的表中数据是
的电离平衡向右移动,能支持该结论的表中数据是a.
 b.电离度 c.电离常数 d.
b.电离度 c.电离常数 d.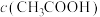
②表中
 基本不变的原因是
基本不变的原因是③常温下,在醋酸溶液中加入纯醋酸,醋酸的电离度
(2)电解质溶液的电导率越大,导电能力越强。用
 的NaOH溶液分别滴定10.00mL浓度均为
的NaOH溶液分别滴定10.00mL浓度均为 的盐酸和
的盐酸和 溶液。利用传感器测得滴定过程中溶液的电导率如图所示。
溶液。利用传感器测得滴定过程中溶液的电导率如图所示。
①曲线②代表滴定
 ”)溶液的曲线,
”)溶液的曲线,
②A点溶液中:

③若
 ,曲线①B点溶液中离子浓度由大到小的顺序:
,曲线①B点溶液中离子浓度由大到小的顺序:
您最近一年使用:0次
19. 工业上利用废镍催化剂(主要成分为NiO,还含有一定量的ZnO、Fe2O3、SiO2、CaO等)制备一水合氢氧化氧镍(2NiOOH·H2O)的工艺流程如图:
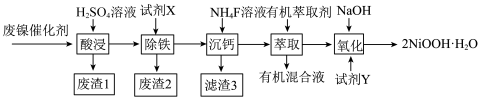
相关金属离子[c0(Xn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:
回答下列问题:
(1)写出一种能提高“酸浸”速率的措施:___ ;滤渣1的成分是___ (填化学式)。
(2)试剂X用于调节溶液的pH,则调控pH的范围是___ 。
(3)已知“除铁”后所得100mL溶液中c(Ca2+)=0.01mol·L-1,加入100mLNH4F溶液(忽略混合后溶液体积的变化),使Ca2+恰好沉淀完全[此时c(Ca2+)=1×10-5mol·L-1],则所加溶液c(NH4F)=___ mol·L-1[已知实验条件下,Ksp(CaF2)=4×10-9,不考虑F-的水解]。
(4)“氧化”过程中加入的试剂Y可以是NaClO、K2S2O8、KMnO4等,写出加入K2S2O8反应生成一水合氢氧化氧镍(2NiOOH·H2O)的离子方程式:___ 。
(5)加入有机萃取剂的作用是___ 。
(6)已知工业上也可以用Ni(OH)2作为阳极、NaOH溶液为电解质溶液,通过电解氧化法制备NiOOH,其阳极的电极反应式为___ 。

相关金属离子[c0(Xn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Ca2+ | Zn2+ | Ni2+ | Fe3+ |
| 开始沉淀时的pH | 10.6 | 7.6 | 7.1 | 1.5 |
| 完全沉淀时的pH | 13.1 | 8.3 | 9.2 | 2.8 |
(1)写出一种能提高“酸浸”速率的措施:
(2)试剂X用于调节溶液的pH,则调控pH的范围是
(3)已知“除铁”后所得100mL溶液中c(Ca2+)=0.01mol·L-1,加入100mLNH4F溶液(忽略混合后溶液体积的变化),使Ca2+恰好沉淀完全[此时c(Ca2+)=1×10-5mol·L-1],则所加溶液c(NH4F)=
(4)“氧化”过程中加入的试剂Y可以是NaClO、K2S2O8、KMnO4等,写出加入K2S2O8反应生成一水合氢氧化氧镍(2NiOOH·H2O)的离子方程式:
(5)加入有机萃取剂的作用是
(6)已知工业上也可以用Ni(OH)2作为阳极、NaOH溶液为电解质溶液,通过电解氧化法制备NiOOH,其阳极的电极反应式为
您最近一年使用:0次
2021-01-31更新
|
319次组卷
|
5卷引用:河南省九师联盟2020-2021学年高二上学期1月联考化学试题
试卷分析
整体难度:适中
考查范围:化学反应原理、有机化学基础、认识化学科学、常见无机物及其应用、化学实验基础
试卷题型(共 19题)
题型
数量
单选题
15
解答题
4
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 酸碱中和滴定实验相关仪器 | |
| 2 | 0.65 | 常见能量转化形式 温度对化学反应速率的影响 电解原理的理解及判断 蛋白质的变性 | |
| 3 | 0.65 | 水的离子积常数 溶液的酸碱性与pH的关系 酸碱混合时的定性判断及计算 | |
| 4 | 0.65 | 可逆反应及反应限度 化学平衡状态本质及特征 | |
| 5 | 0.65 | 根据△H=生成物的总能量之和-反应物的总能量之和进行计算 反应进行方向判据的应用 | |
| 6 | 0.65 | 弱电解质的电离平衡 盐溶液中离子浓度大小的比较 | |
| 7 | 0.65 | 勒夏特列原理的应用 | |
| 8 | 0.65 | 原电池电子流向判断及应用 原电池正负极判断 原电池、电解池综合考查 电解池电极反应式及化学方程式的书写与判断 | |
| 9 | 0.65 | 化学反应速率计算 化学平衡的移动及其影响因素 化学平衡状态的判断方法 | |
| 10 | 0.4 | pH定义式及计算 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 | |
| 11 | 0.65 | 离子方程式的书写 明矾的净水作用及原理 表示燃烧热的热化学方程式书写 电解原理的应用 | |
| 12 | 0.65 | 难溶电解质的溶解平衡 溶度积常数相关计算 | |
| 13 | 0.65 | 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 | |
| 14 | 0.65 | 电化学计算 电解池电极反应式及化学方程式的书写与判断 电解原理的应用实验 | |
| 15 | 0.65 | 电离平衡常数及影响因素 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 | |
| 二、解答题 | |||
| 16 | 0.4 | 盐类水解规律理解及应用 溶度积规则及其应用 探究物质组成或测量物质的含量 | 实验探究题 |
| 17 | 0.4 | 化学平衡的有关计算 化学平衡图像分析 化学平衡常数的影响因素及应用 转化率的相关计算及判断 | 原理综合题 |
| 18 | 0.85 | 弱电解质电离平衡的影响因素 电离平衡常数及影响因素 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 | 原理综合题 |
| 19 | 0.65 | 溶度积常数相关计算 电解池电极反应式及化学方程式的书写与判断 物质分离、提纯综合应用 | 工业流程题 |



