1 . 某实验小组根据以下装置制备84消毒液,并探究84消毒液的性质。 ,若温度超过
,若温度超过 ,会生成
,会生成 杂质。
杂质。
回答下列问题:
I.84消毒液的制备
(1)仪器a的名称为___________ 。
(2)装置A中反应的离子方程式为___________ 。
(3)装置B的作用是___________ (任写一个即可)。
(4)制备 溶液时,为减少
溶液时,为减少 杂质的产生,应采取的措施是
杂质的产生,应采取的措施是___________ (写两条)。
(5)为探究 性质,设计如图所示装置,在A处通入未经干燥的氯气。当关闭K处弹簧夹时,C处红布条看不到明显现象;当打开K处的弹簧夹后,C处红布条逐渐褪色。则B瓶内液体可能是___________。
性质,设计如图所示装置,在A处通入未经干燥的氯气。当关闭K处弹簧夹时,C处红布条看不到明显现象;当打开K处的弹簧夹后,C处红布条逐渐褪色。则B瓶内液体可能是___________。
Ⅱ.探究84消毒液的性质
84消毒液和医用酒精均为重要的消毒剂且二者不能混用,某小组对84消毒液与医用酒精的反应产物进行了探究。
【提出假设】医用酒精中的 被氧化为
被氧化为
【实验方案】实验方案及现象如下:
【实验结论1】
(6)产物中有乙醛,且乙醛会被转化为其它物质。补充①的实验现象:___________ 。
【查阅资料】混合体系中可能发生以下反应:

 (卤化反应)
(卤化反应)
【实验设计】取2份 84消毒液,缓慢滴加医用酒精或蒸馏水各
84消毒液,缓慢滴加医用酒精或蒸馏水各 ,通过测定过程中
,通过测定过程中 变化判断是否发生卤化反应(忽略过程中的热效应对
变化判断是否发生卤化反应(忽略过程中的热效应对 的影响)。实验结果如图。
的影响)。实验结果如图。 增大,说明乙醛发生了卤化反应。
增大,说明乙醛发生了卤化反应。
【查阅资料】某同学查阅资料后认为结论2不严谨,原因是工业上为了稳定 ,在84消毒液中添加了少量
,在84消毒液中添加了少量 ,且由于乙醇的“锁水”效应也会使
,且由于乙醇的“锁水”效应也会使 增大(提示:乙醇与
增大(提示:乙醇与 不反应)。
不反应)。
【数据分析】②已知上述实验:84消毒液中 。
。
(7)通过计算证明84消毒液中添加了少量 ,写出计算过程
,写出计算过程___________ 。
【优化实验】③该同学增加了对照实验,证明反应生成了 。
。
(8)请简述方案和结果:___________ 。
实验总结:医用酒精中的乙醇能被84消毒液氧化为乙醛,乙醛能进一步发生卤化反应。

 ,若温度超过
,若温度超过 ,会生成
,会生成 杂质。
杂质。回答下列问题:
I.84消毒液的制备
(1)仪器a的名称为
(2)装置A中反应的离子方程式为
(3)装置B的作用是
(4)制备
 溶液时,为减少
溶液时,为减少 杂质的产生,应采取的措施是
杂质的产生,应采取的措施是(5)为探究
 性质,设计如图所示装置,在A处通入未经干燥的氯气。当关闭K处弹簧夹时,C处红布条看不到明显现象;当打开K处的弹簧夹后,C处红布条逐渐褪色。则B瓶内液体可能是___________。
性质,设计如图所示装置,在A处通入未经干燥的氯气。当关闭K处弹簧夹时,C处红布条看不到明显现象;当打开K处的弹簧夹后,C处红布条逐渐褪色。则B瓶内液体可能是___________。
A.饱和 溶液 溶液 | B. 溶液 溶液 | C. | D.浓硫酸 |
Ⅱ.探究84消毒液的性质
84消毒液和医用酒精均为重要的消毒剂且二者不能混用,某小组对84消毒液与医用酒精的反应产物进行了探究。
【提出假设】医用酒精中的
 被氧化为
被氧化为
【实验方案】实验方案及现象如下:
| 实验操作 | 取样检测时间点 | 实验现象 |
常温下将 医用酒精和 医用酒精和 84消毒液混合,在不同反应时间点,分别取 84消毒液混合,在不同反应时间点,分别取 反应后的溶液滴加到新制氢氧化铜悬浊液中加热 反应后的溶液滴加到新制氢氧化铜悬浊液中加热 |  | ① |
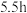 | 橙黄色沉淀 | |
 | 黑色沉淀 |
(6)产物中有乙醛,且乙醛会被转化为其它物质。补充①的实验现象:
【查阅资料】混合体系中可能发生以下反应:

 (卤化反应)
(卤化反应)【实验设计】取2份
 84消毒液,缓慢滴加医用酒精或蒸馏水各
84消毒液,缓慢滴加医用酒精或蒸馏水各 ,通过测定过程中
,通过测定过程中 变化判断是否发生卤化反应(忽略过程中的热效应对
变化判断是否发生卤化反应(忽略过程中的热效应对 的影响)。实验结果如图。
的影响)。实验结果如图。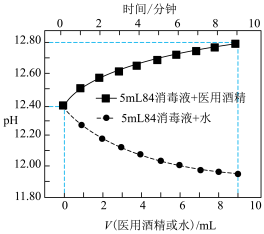
 增大,说明乙醛发生了卤化反应。
增大,说明乙醛发生了卤化反应。【查阅资料】某同学查阅资料后认为结论2不严谨,原因是工业上为了稳定
 ,在84消毒液中添加了少量
,在84消毒液中添加了少量 ,且由于乙醇的“锁水”效应也会使
,且由于乙醇的“锁水”效应也会使 增大(提示:乙醇与
增大(提示:乙醇与 不反应)。
不反应)。【数据分析】②已知上述实验:84消毒液中
 。
。(7)通过计算证明84消毒液中添加了少量
 ,写出计算过程
,写出计算过程【优化实验】③该同学增加了对照实验,证明反应生成了
 。
。(8)请简述方案和结果:
实验总结:医用酒精中的乙醇能被84消毒液氧化为乙醛,乙醛能进一步发生卤化反应。
您最近一年使用:0次
名校
2 . 二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向。
(1)CO2的电子式是_____________ ,所含化学键的类型是______________ 。
(2)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
2CH3OH(g) CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
①写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式___________________ 。
②一定条件下,上述合成二甲醚的的反应达到平衡状态后,若改变反应的某个条件,下列变化能说明平衡一定向正反应方向移动的是(只有一个选项符合题意)_________ (填字母代号)。
a.逆反应速率先增大后减小
b.H2的转化率增大
c.CO2的体积百分含量减小
d.容器中c(H2)/c(CO2)的值减小
③在某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的平衡转化率如右图所示。T1温度下,将6 molCO2和12 molH2充入2 L的密闭容器中,5 min后反应达到平衡状态,则0~5 min内的平均反应速率v(CH3OCH3)=___________ ;KA、KB、KC三者之间的大小关系为__________________ 。

(3)CO2溶于水形成H2CO3。已知常温下H2CO3的电离平衡常数K1=4.4×10-7,K2=4.7×10-11,NH3·H2O的电离平衡常数K=1.75×10-5。常温下,用氨水吸收CO2可得到NH4HCO3溶液,NH4HCO3溶液显________ ;(填“酸性”、“中性”或“碱性”);请计算反应NH4++HCO3-+H2O NH3·H2O+H2CO3的平衡常数K=
NH3·H2O+H2CO3的平衡常数K=_________ 。
(1)CO2的电子式是
(2)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-12CH3OH(g)
 CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1①写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式
②一定条件下,上述合成二甲醚的的反应达到平衡状态后,若改变反应的某个条件,下列变化能说明平衡一定向正反应方向移动的是(只有一个选项符合题意)
a.逆反应速率先增大后减小
b.H2的转化率增大
c.CO2的体积百分含量减小
d.容器中c(H2)/c(CO2)的值减小
③在某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的平衡转化率如右图所示。T1温度下,将6 molCO2和12 molH2充入2 L的密闭容器中,5 min后反应达到平衡状态,则0~5 min内的平均反应速率v(CH3OCH3)=

(3)CO2溶于水形成H2CO3。已知常温下H2CO3的电离平衡常数K1=4.4×10-7,K2=4.7×10-11,NH3·H2O的电离平衡常数K=1.75×10-5。常温下,用氨水吸收CO2可得到NH4HCO3溶液,NH4HCO3溶液显
 NH3·H2O+H2CO3的平衡常数K=
NH3·H2O+H2CO3的平衡常数K=
您最近一年使用:0次
2016-12-09更新
|
552次组卷
|
2卷引用:2016届广东省韶关市高三1月调研测试理综化学试卷
名校
解题方法
3 . 二氧化碳和氨是重要的化工产品,是纯碱工业、制造硝酸、铵盐和氮肥等的原料。
(1)CO2的电子式是________________ 。
(2)以NH3与CO2为原料合成尿素[化学式为CO(NH2)2]的主要反应如下:
① 2NH3(g)+CO2(g) = NH2CO2NH4(s) △H=-l59.5 kJ·mol-1
② NH2CO2NH4(s) CO(NH2)2(s)+H2O(g) △H="+116.5" kJ·mol-1
CO(NH2)2(s)+H2O(g) △H="+116.5" kJ·mol-1
③ H2O(1) =H2O(g) △H=+44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式_______________ ;
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:
4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H=-905kJ·mol-1
4NO(g)+6H2O(g) △H=-905kJ·mol-1
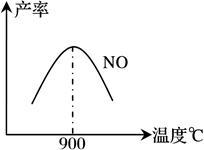
不同温度下NO产率如下图1所示,由此图可知温度对NO产率的影响规律为______________ ,请用化学反应速率和化学平衡理论解释其原因:____________________ 。
(4)以NO2、O2、熔融NaNO3组成的燃料电池装置如图2所示,在使用过程中石墨I电极反应生成一种氧化物Y,有关石墨I电极反应可表示为_______________ 。
(1)CO2的电子式是
(2)以NH3与CO2为原料合成尿素[化学式为CO(NH2)2]的主要反应如下:
① 2NH3(g)+CO2(g) = NH2CO2NH4(s) △H=-l59.5 kJ·mol-1
② NH2CO2NH4(s)
 CO(NH2)2(s)+H2O(g) △H="+116.5" kJ·mol-1
CO(NH2)2(s)+H2O(g) △H="+116.5" kJ·mol-1③ H2O(1) =H2O(g) △H=+44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:
4NH3(g)+5O2(g)
 4NO(g)+6H2O(g) △H=-905kJ·mol-1
4NO(g)+6H2O(g) △H=-905kJ·mol-1不同温度下NO产率如下图1所示,由此图可知温度对NO产率的影响规律为
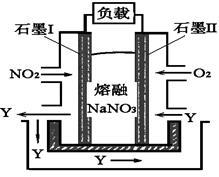
(4)以NO2、O2、熔融NaNO3组成的燃料电池装置如图2所示,在使用过程中石墨I电极反应生成一种氧化物Y,有关石墨I电极反应可表示为
(5)已知常温下NH3·H2O的电离平衡常数K=1.75×10-5,H2CO3的电离平衡常数K1=4.4×10-7,K2=4.7×10-11。 常温下,用氨水吸收CO2可得到NH4HCO3溶液,NH4HCO3溶液显 NH3·H2O+H2CO3的平衡常数K=
NH3·H2O+H2CO3的平衡常数K=
您最近一年使用:0次
2016-12-09更新
|
537次组卷
|
3卷引用:2016届广东省清远市高三上学期期末考试化学试卷



