1 . 某实验小组根据以下装置制备84消毒液,并探究84消毒液的性质。 ,若温度超过
,若温度超过 ,会生成
,会生成 杂质。
杂质。
回答下列问题:
I.84消毒液的制备
(1)仪器a的名称为___________ 。
(2)装置A中反应的离子方程式为___________ 。
(3)装置B的作用是___________ (任写一个即可)。
(4)制备 溶液时,为减少
溶液时,为减少 杂质的产生,应采取的措施是
杂质的产生,应采取的措施是___________ (写两条)。
(5)为探究 性质,设计如图所示装置,在A处通入未经干燥的氯气。当关闭K处弹簧夹时,C处红布条看不到明显现象;当打开K处的弹簧夹后,C处红布条逐渐褪色。则B瓶内液体可能是___________。
性质,设计如图所示装置,在A处通入未经干燥的氯气。当关闭K处弹簧夹时,C处红布条看不到明显现象;当打开K处的弹簧夹后,C处红布条逐渐褪色。则B瓶内液体可能是___________。
Ⅱ.探究84消毒液的性质
84消毒液和医用酒精均为重要的消毒剂且二者不能混用,某小组对84消毒液与医用酒精的反应产物进行了探究。
【提出假设】医用酒精中的 被氧化为
被氧化为
【实验方案】实验方案及现象如下:
【实验结论1】
(6)产物中有乙醛,且乙醛会被转化为其它物质。补充①的实验现象:___________ 。
【查阅资料】混合体系中可能发生以下反应:

 (卤化反应)
(卤化反应)
【实验设计】取2份 84消毒液,缓慢滴加医用酒精或蒸馏水各
84消毒液,缓慢滴加医用酒精或蒸馏水各 ,通过测定过程中
,通过测定过程中 变化判断是否发生卤化反应(忽略过程中的热效应对
变化判断是否发生卤化反应(忽略过程中的热效应对 的影响)。实验结果如图。
的影响)。实验结果如图。 增大,说明乙醛发生了卤化反应。
增大,说明乙醛发生了卤化反应。
【查阅资料】某同学查阅资料后认为结论2不严谨,原因是工业上为了稳定 ,在84消毒液中添加了少量
,在84消毒液中添加了少量 ,且由于乙醇的“锁水”效应也会使
,且由于乙醇的“锁水”效应也会使 增大(提示:乙醇与
增大(提示:乙醇与 不反应)。
不反应)。
【数据分析】②已知上述实验:84消毒液中 。
。
(7)通过计算证明84消毒液中添加了少量 ,写出计算过程
,写出计算过程___________ 。
【优化实验】③该同学增加了对照实验,证明反应生成了 。
。
(8)请简述方案和结果:___________ 。
实验总结:医用酒精中的乙醇能被84消毒液氧化为乙醛,乙醛能进一步发生卤化反应。

 ,若温度超过
,若温度超过 ,会生成
,会生成 杂质。
杂质。回答下列问题:
I.84消毒液的制备
(1)仪器a的名称为
(2)装置A中反应的离子方程式为
(3)装置B的作用是
(4)制备
 溶液时,为减少
溶液时,为减少 杂质的产生,应采取的措施是
杂质的产生,应采取的措施是(5)为探究
 性质,设计如图所示装置,在A处通入未经干燥的氯气。当关闭K处弹簧夹时,C处红布条看不到明显现象;当打开K处的弹簧夹后,C处红布条逐渐褪色。则B瓶内液体可能是___________。
性质,设计如图所示装置,在A处通入未经干燥的氯气。当关闭K处弹簧夹时,C处红布条看不到明显现象;当打开K处的弹簧夹后,C处红布条逐渐褪色。则B瓶内液体可能是___________。
A.饱和 溶液 溶液 | B. 溶液 溶液 | C. | D.浓硫酸 |
Ⅱ.探究84消毒液的性质
84消毒液和医用酒精均为重要的消毒剂且二者不能混用,某小组对84消毒液与医用酒精的反应产物进行了探究。
【提出假设】医用酒精中的
 被氧化为
被氧化为
【实验方案】实验方案及现象如下:
| 实验操作 | 取样检测时间点 | 实验现象 |
常温下将 医用酒精和 医用酒精和 84消毒液混合,在不同反应时间点,分别取 84消毒液混合,在不同反应时间点,分别取 反应后的溶液滴加到新制氢氧化铜悬浊液中加热 反应后的溶液滴加到新制氢氧化铜悬浊液中加热 |  | ① |
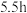 | 橙黄色沉淀 | |
 | 黑色沉淀 |
(6)产物中有乙醛,且乙醛会被转化为其它物质。补充①的实验现象:
【查阅资料】混合体系中可能发生以下反应:

 (卤化反应)
(卤化反应)【实验设计】取2份
 84消毒液,缓慢滴加医用酒精或蒸馏水各
84消毒液,缓慢滴加医用酒精或蒸馏水各 ,通过测定过程中
,通过测定过程中 变化判断是否发生卤化反应(忽略过程中的热效应对
变化判断是否发生卤化反应(忽略过程中的热效应对 的影响)。实验结果如图。
的影响)。实验结果如图。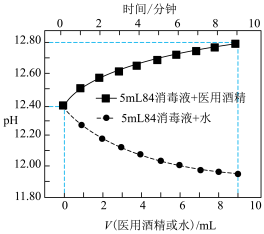
 增大,说明乙醛发生了卤化反应。
增大,说明乙醛发生了卤化反应。【查阅资料】某同学查阅资料后认为结论2不严谨,原因是工业上为了稳定
 ,在84消毒液中添加了少量
,在84消毒液中添加了少量 ,且由于乙醇的“锁水”效应也会使
,且由于乙醇的“锁水”效应也会使 增大(提示:乙醇与
增大(提示:乙醇与 不反应)。
不反应)。【数据分析】②已知上述实验:84消毒液中
 。
。(7)通过计算证明84消毒液中添加了少量
 ,写出计算过程
,写出计算过程【优化实验】③该同学增加了对照实验,证明反应生成了
 。
。(8)请简述方案和结果:
实验总结:医用酒精中的乙醇能被84消毒液氧化为乙醛,乙醛能进一步发生卤化反应。
您最近一年使用:0次
解题方法
2 . 甲酸铵常用于电解、电容器行业。25℃时,用HCl或NaOH固体改变0.1 mol/L的HCOONH4溶液的pH,1gc(HCOOH)、1gc(NH3·H2O)、1gc(H+)和1gc(OH-)随pH变化的关系如图所示。下列说法错误的是
[已知:Ka(HCOOH)=1.8×10-4,Kb(NH3·H2O)=1.8×10-5]

[已知:Ka(HCOOH)=1.8×10-4,Kb(NH3·H2O)=1.8×10-5]

| A.Q点对应溶液pH=7 |
| B.曲线①代表lgc(H+),曲线③代表1gc(NH3·H2O) |
| C.0.1 mol/LHCOONH4溶液中,c(H+)+c(HCOOH)=c(OH-)+c(NH3·H2O) |
| D.P点存在c(NH3·H2O)>c(OH-)=c(HCOOH)>c(H+) |
您最近一年使用:0次
2022高三·全国·专题练习
解题方法
3 . 室温下,向10mL0.1mol·L-1HA溶液中滴加0.1mol·L-1的NaOH溶液,溶液的酸度(AG)与NaOH溶液体积的关系如图所示。已知:AG=lg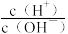 。
。
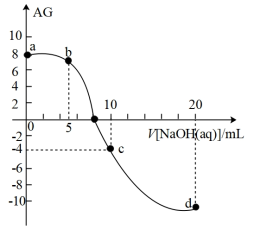
下列说法错误的是
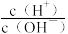 。
。
下列说法错误的是
| A.在a、b、c、d点对应的溶液中,c点时水的电离程度最大 |
| B.b点对应的溶液中:c(A-)>c(Na+)>c(H+)>c(OH-) |
| C.d点对应的溶液中:c(OH-)=c(H+)+c(HA)+c(A-) |
| D.室温下,HA的电离常数Ka约为1.0×10-4 |
您最近一年使用:0次
2022-04-30更新
|
354次组卷
|
3卷引用:广东省韶关市2021-2022学年高三上学期期中考试化学试题
广东省韶关市2021-2022学年高三上学期期中考试化学试题(已下线)押新高考卷13题 水溶液中的离子平衡-备战2022年高考化学临考题号押题(新高考通版)河北省保定市部分学校2021-2022学年高三上学期期中考试化学试题
名校
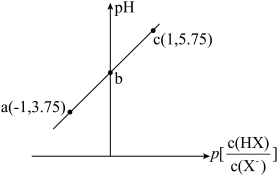
4 . 已知: 。室温下,向0.10mol/LHX溶液中滴加0.10mol/LNaOH溶液,溶液pH随
。室温下,向0.10mol/LHX溶液中滴加0.10mol/LNaOH溶液,溶液pH随 变化关系如图所示。下列说法错误的是
变化关系如图所示。下列说法错误的是
 。室温下,向0.10mol/LHX溶液中滴加0.10mol/LNaOH溶液,溶液pH随
。室温下,向0.10mol/LHX溶液中滴加0.10mol/LNaOH溶液,溶液pH随 变化关系如图所示。下列说法错误的是
变化关系如图所示。下列说法错误的是
| A.溶液中水的电离程度:a<b<c |
B.b点溶液中: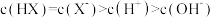 |
C.c点溶液中: |
D.室温下NaX的水解平衡常数为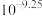 |
您最近一年使用:0次
5 . 草酸(H2C2O4)及其化合物在医药、印染、塑料等方面扮演着重要角色,同时广泛应用于化学实验中。
(1)氧化还原滴定法是以溶液中氧化剂和还原剂之间的电子转移为基础的一种滴定分析方法,应用非常广泛。某草酸亚铁( )样品中含有草酸,某化学兴趣小组想用氧化还原滴定法测定该样品中
)样品中含有草酸,某化学兴趣小组想用氧化还原滴定法测定该样品中 的含量。实验方案如下:
的含量。实验方案如下:
Ⅰ.称量0.50g样品于锥形瓶中,加入适量稀硫酸溶解,水浴加热至70℃,加入足量 溶液,使其充分反应。
溶液,使其充分反应。
Ⅱ.向反应后的溶液中加入过量锌粉与稀硫酸,煮沸且完全反应后,用KSCN在点滴板上检验至溶液不变红,过滤至另一洁净的锥形瓶中,用0.0200mol/L的酸性高锰酸钾标准液滴定该溶液至终点,消耗高锰酸钾标准液16.00mL。
请回答下列问题:
①高锰酸钾标准液用___________ (填“酸式”或“碱式”)滴定管盛装,达到滴定终点的现象是___________ 。
②下列关于实验误差的说法正确的是___________ (填标号)。
A.步骤Ⅰ中,若加入的 溶液的量不足,则测得的
溶液的量不足,则测得的 含量偏高
含量偏高
B.步骤Ⅱ中,滴定前读数正确,滴定终点时仰视读数,测得的 含量偏低
含量偏低
C.步骤Ⅱ中,锥形瓶中有少量水未干燥,测得的 含量偏低
含量偏低
D.步骤Ⅱ中,过滤时间过长,可能导致测得的 含量偏低
含量偏低
③0.50g该样品中 的质量分数为
的质量分数为___________ (不考虑损耗)。
(2)常温下,改变0.1mol/L的 溶液的pH,溶液中
溶液的pH,溶液中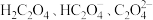 的物质的量分数(
的物质的量分数( )溶液pH的关系如图所示。回答下列问题:
)溶液pH的关系如图所示。回答下列问题:
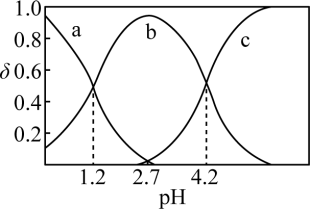
①曲线___________ (填“a”、“b”或“c”)代表 ,
, 时,溶液中
时,溶液中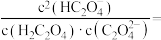
___________ 。
②pH从1.2增大至4.2的过程中,水的电离程度___________ (填“增大”、“减小”或“不变”)。
③ 溶液中存在的离子浓度大小关系为
溶液中存在的离子浓度大小关系为___________ 。
(1)氧化还原滴定法是以溶液中氧化剂和还原剂之间的电子转移为基础的一种滴定分析方法,应用非常广泛。某草酸亚铁(
 )样品中含有草酸,某化学兴趣小组想用氧化还原滴定法测定该样品中
)样品中含有草酸,某化学兴趣小组想用氧化还原滴定法测定该样品中 的含量。实验方案如下:
的含量。实验方案如下:Ⅰ.称量0.50g样品于锥形瓶中,加入适量稀硫酸溶解,水浴加热至70℃,加入足量
 溶液,使其充分反应。
溶液,使其充分反应。Ⅱ.向反应后的溶液中加入过量锌粉与稀硫酸,煮沸且完全反应后,用KSCN在点滴板上检验至溶液不变红,过滤至另一洁净的锥形瓶中,用0.0200mol/L的酸性高锰酸钾标准液滴定该溶液至终点,消耗高锰酸钾标准液16.00mL。
请回答下列问题:
①高锰酸钾标准液用
②下列关于实验误差的说法正确的是
A.步骤Ⅰ中,若加入的
 溶液的量不足,则测得的
溶液的量不足,则测得的 含量偏高
含量偏高B.步骤Ⅱ中,滴定前读数正确,滴定终点时仰视读数,测得的
 含量偏低
含量偏低C.步骤Ⅱ中,锥形瓶中有少量水未干燥,测得的
 含量偏低
含量偏低D.步骤Ⅱ中,过滤时间过长,可能导致测得的
 含量偏低
含量偏低③0.50g该样品中
 的质量分数为
的质量分数为(2)常温下,改变0.1mol/L的
 溶液的pH,溶液中
溶液的pH,溶液中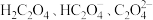 的物质的量分数(
的物质的量分数( )溶液pH的关系如图所示。回答下列问题:
)溶液pH的关系如图所示。回答下列问题:
①曲线
 ,
, 时,溶液中
时,溶液中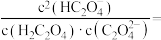
②pH从1.2增大至4.2的过程中,水的电离程度
③
 溶液中存在的离子浓度大小关系为
溶液中存在的离子浓度大小关系为
您最近一年使用:0次
2022-01-21更新
|
129次组卷
|
3卷引用:广东省湛江市2021-2022学年高二上学期期末调研考试化学试题
名校
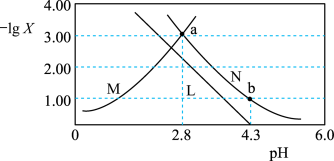
6 . 常温下,向一定浓度 溶液中加入
溶液中加入 ,保持溶液体积和温度不变,测得
,保持溶液体积和温度不变,测得 与
与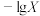 [X为
[X为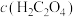 、
、 、
、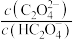 ]变化如图所示。下列说法错误的是
]变化如图所示。下列说法错误的是
 溶液中加入
溶液中加入 ,保持溶液体积和温度不变,测得
,保持溶液体积和温度不变,测得 与
与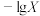 [X为
[X为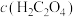 、
、 、
、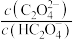 ]变化如图所示。下列说法错误的是
]变化如图所示。下列说法错误的是
A.常温下, 的 的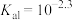 |
B.a点溶液中: |
C. 溶液中: 溶液中: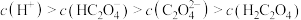 |
D.b点溶液中: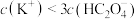 |
您最近一年使用:0次
2023-02-08更新
|
307次组卷
|
3卷引用:广东省广州市2022届高三一模考试(选择题11-16)
名校
7 . 25℃时,向20mL 0.2 MOH溶液中逐滴加入浓度为0.2
MOH溶液中逐滴加入浓度为0.2 的盐酸,溶液中
的盐酸,溶液中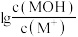 与
与 、加入盐酸的体积的变化关系如图所示。下列说法错误的是
、加入盐酸的体积的变化关系如图所示。下列说法错误的是
 MOH溶液中逐滴加入浓度为0.2
MOH溶液中逐滴加入浓度为0.2 的盐酸,溶液中
的盐酸,溶液中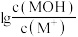 与
与 、加入盐酸的体积的变化关系如图所示。下列说法错误的是
、加入盐酸的体积的变化关系如图所示。下列说法错误的是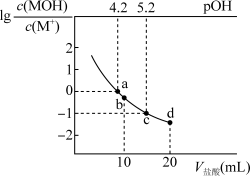
A.MCl水解平衡常数的数量级为 |
B.b点溶液中各微粒的浓度关系为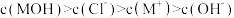 |
| C.a、b、c、d四点溶液中水的电离程度逐渐增大 |
D.d点溶液的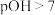 |
您最近一年使用:0次
2022-12-31更新
|
831次组卷
|
4卷引用:广东省梅州市名校2022-2023学年高三上学期期末考试化学试题
名校
解题方法
8 . 在某温度时,将n mol∙L-1氨水滴入10 mL 1.0 mol∙L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是
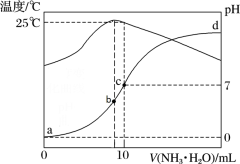

| A.a点Kw = 1.0×10-14 |
| B.b点:c(NH3∙H2O) + c(OH-) < c(H+) |
| C.25℃时,NH4Cl水解平衡常数为(n-1)×10-7(用n表示) |
| D.d点水的电离程度最大 |
您最近一年使用:0次
2021-01-07更新
|
818次组卷
|
7卷引用:广东省汕头市潮阳实验学校2021届高三下学期第二次月考化学试题
广东省汕头市潮阳实验学校2021届高三下学期第二次月考化学试题山东省济南市2021届高三上学期期中考试化学试题福建省漳州市2021届高三毕业班适应性测试(一)化学试题(已下线)学科网2021年高三1月大联考考后强化卷(新课标Ⅰ卷)(已下线)学科网2021年高三1月大联考考后强化卷(新课标Ⅲ卷)山西省阳泉市2021届高三下学期第三次教学质量检测(三模)理综化学试题河南省确山县第二高级中学2021-2022学年高三上学期期中考试化学试题
9 . 常温下,向二元弱酸H2A溶液中滴加NaOH溶液,所得混合溶液的pH与离子浓度变化的关系如图所示,下列说法错误的是
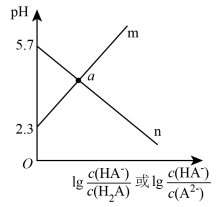

A.曲线n表示pH与lg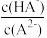 |
| B.Ka1(H2A)=10-2.3 |
| C.交点a的溶液中:c(H2A)>c(A2-) |
| D.NaHA溶液中:c(HA-)>c(A2-)>c(H2A) |
您最近一年使用:0次
2021-09-18更新
|
754次组卷
|
8卷引用:广东省清远市第一中学2021-2022学年高二上学期期中调研考试化学试题
名校
10 . 化学上常用AG表示溶液中的 。25℃时,用0.100
。25℃时,用0.100 的NaOH溶液滴定20.00mL 0.100
的NaOH溶液滴定20.00mL 0.100 HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法错误的是
HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法错误的是
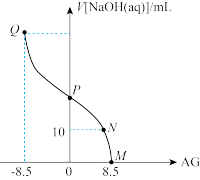
 。25℃时,用0.100
。25℃时,用0.100 的NaOH溶液滴定20.00mL 0.100
的NaOH溶液滴定20.00mL 0.100 HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法错误的是
HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法错误的是
A.Q点时,溶液中 为 为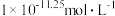 |
B.N点时, |
| C.P点时,加入NaOH溶液的体积为20.00mL |
D.25℃时,HNO2的电离常数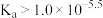 |
您最近一年使用:0次
2021-03-26更新
|
569次组卷
|
3卷引用:广东省汕头市金山中学2020-2021学年高二下学期期中考试化学试题



