名校
1 . 钪是一种稀土金属元素,在国防、航天、核能等领域具有重要应用。氯化钪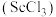 是制备钪的重要原料。工业上利用固体废料“赤泥”(含
是制备钪的重要原料。工业上利用固体废料“赤泥”(含 、
、 、
、 、
、 、
、 等)制取
等)制取 的流程如图。
的流程如图。 难溶于盐酸;②草酸可与多种金属离子形成可溶性络合物。
难溶于盐酸;②草酸可与多种金属离子形成可溶性络合物。
回答下列问题:
(1)酸浸中,滤渣的主要成分是_______ (填化学式), 溶解的离子反应方程式为
溶解的离子反应方程式为_______ 。
(2)“步骤Ⅰ”中加入 后选择合适试剂调pH,再将溶液加热煮沸一段时间,加热煮沸的目的是
后选择合适试剂调pH,再将溶液加热煮沸一段时间,加热煮沸的目的是_______ 。
(3)草酸用量过多时,钪的沉淀率反而下降,原因是_______ 。
(4)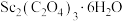 在空气中加热分解时,
在空气中加热分解时,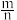 %随温度变化如图所示。
%随温度变化如图所示。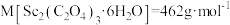 。
。
250℃时固体的主要成分是:_______ (填化学式)。
(5)传统制备 的方法是先得到
的方法是先得到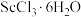 沉淀,再高温脱水得
沉淀,再高温脱水得 ,但通常含有
,但通常含有 杂质,原因是
杂质,原因是_______ 。
(6)“加热氯化”过程主要发生反应的化学方程式为:_______ 。
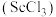 是制备钪的重要原料。工业上利用固体废料“赤泥”(含
是制备钪的重要原料。工业上利用固体废料“赤泥”(含 、
、 、
、 、
、 、
、 等)制取
等)制取 的流程如图。
的流程如图。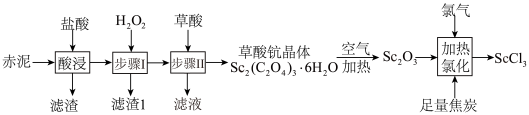
 难溶于盐酸;②草酸可与多种金属离子形成可溶性络合物。
难溶于盐酸;②草酸可与多种金属离子形成可溶性络合物。回答下列问题:
(1)酸浸中,滤渣的主要成分是
 溶解的离子反应方程式为
溶解的离子反应方程式为(2)“步骤Ⅰ”中加入
 后选择合适试剂调pH,再将溶液加热煮沸一段时间,加热煮沸的目的是
后选择合适试剂调pH,再将溶液加热煮沸一段时间,加热煮沸的目的是(3)草酸用量过多时,钪的沉淀率反而下降,原因是
(4)
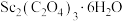 在空气中加热分解时,
在空气中加热分解时,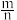 %随温度变化如图所示。
%随温度变化如图所示。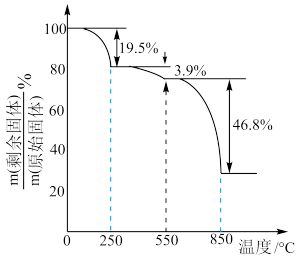
 。
。250℃时固体的主要成分是:
(5)传统制备
 的方法是先得到
的方法是先得到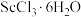 沉淀,再高温脱水得
沉淀,再高温脱水得 ,但通常含有
,但通常含有 杂质,原因是
杂质,原因是(6)“加热氯化”过程主要发生反应的化学方程式为:
您最近一年使用:0次
解题方法
2 . 钛酸钡( )可以作为防火涂料的添加剂,可提高涂层的防火性能和抗化学腐蚀性。以钛渣(主要成分是
)可以作为防火涂料的添加剂,可提高涂层的防火性能和抗化学腐蚀性。以钛渣(主要成分是 ,含少量
,含少量 、
、 、
、 等)为原料制备钛酸钡的流程如下:
等)为原料制备钛酸钡的流程如下: 如下表所示。
如下表所示。
注: 。
。
回答下列问题:
(1)浸渣的主要成分是_____ (填化学式)。
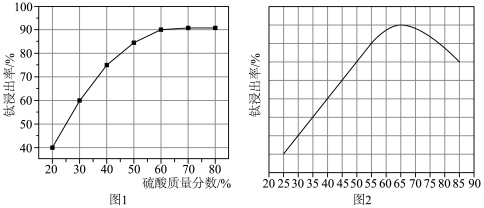
(2)“酸浸”中,其他条件相同,1h内钛浸出率与硫酸的质量分数、温度关系如图1所示。_____ 。图2中温度高于65℃,钛浸出率降低的原因可能是_____ 。
(3)“还原”时,主要反应的离子方程式为_____ ,检验“还原”后溶液中是否含 的试剂是
的试剂是_____ (填化学式)。
(4)“沉钛”中,先加入过量 溶液,后加入适量
溶液,后加入适量 溶液,如果加试剂顺序颠倒,会产生
溶液,如果加试剂顺序颠倒,会产生_____ (填化学式)杂质,影响产率。“调 ”范围为
”范围为_____ 。
(5)“氧化焙烧”发生反应的化学方程式为_____ 。工业上,还可以直接将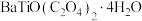 在1500℃、无氧环境下反应24h制备
在1500℃、无氧环境下反应24h制备 ,该方法的缺点是
,该方法的缺点是_____ 。
 )可以作为防火涂料的添加剂,可提高涂层的防火性能和抗化学腐蚀性。以钛渣(主要成分是
)可以作为防火涂料的添加剂,可提高涂层的防火性能和抗化学腐蚀性。以钛渣(主要成分是 ,含少量
,含少量 、
、 、
、 等)为原料制备钛酸钡的流程如下:
等)为原料制备钛酸钡的流程如下: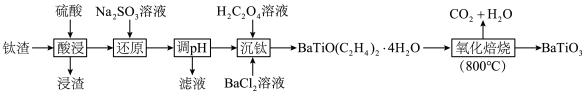
 如下表所示。
如下表所示。| 金属离子 |  |  |  |
开始沉淀/ | 1.5 | 6.3 | 0.5 |
完全沉淀/ | 2.8 | 8.3 | 2.5 |
 。
。回答下列问题:
(1)浸渣的主要成分是
(2)“酸浸”中,其他条件相同,1h内钛浸出率与硫酸的质量分数、温度关系如图1所示。
(3)“还原”时,主要反应的离子方程式为
 的试剂是
的试剂是(4)“沉钛”中,先加入过量
 溶液,后加入适量
溶液,后加入适量 溶液,如果加试剂顺序颠倒,会产生
溶液,如果加试剂顺序颠倒,会产生 ”范围为
”范围为(5)“氧化焙烧”发生反应的化学方程式为
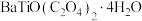 在1500℃、无氧环境下反应24h制备
在1500℃、无氧环境下反应24h制备 ,该方法的缺点是
,该方法的缺点是
您最近一年使用:0次
2024-05-12更新
|
121次组卷
|
2卷引用:2024届青海省西宁市大通县高三下学期第二次模拟考试理科综合试题-高中化学
名校
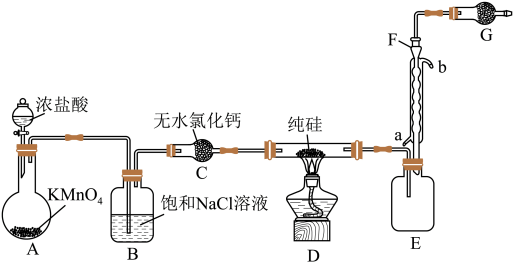
3 . 2023年9月华为推出了举世瞩目的“中国芯”——麒麟芯。“中国芯”的发展离不开单晶硅,四氯化硅是制备高纯硅的原料。某小组拟在实验室用下列装置模拟探究四氯化硅的制备和应用(夹持装置已省略)。
① ,
,
② 遇水剧烈水解,
遇水剧烈水解, 的熔点、沸点分别为―70.0℃、57.7℃。
的熔点、沸点分别为―70.0℃、57.7℃。
③电负性Cl>H>Si, 的沸点为31.8℃,熔点为―126.5℃,在空气中易自燃,遇水会剧烈反应。
的沸点为31.8℃,熔点为―126.5℃,在空气中易自燃,遇水会剧烈反应。
请回答下列问题:
(1)写出A中发生反应的离子方程式:______ 。
(2)装置B的作用是______ 。
(3)仪器F的名称是______ ,冷却水应从______ (填“a”或“b”)口通入。
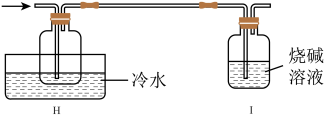
(4)有同学设计如图装置H、I替代上述E、G装置;______ 。
(5)测定产品纯度。取mg 产品溶于足量蒸馏水中(生成的HCl全部被水吸收),将混合物转入锥形瓶中,滴加甲基橙溶液,用
产品溶于足量蒸馏水中(生成的HCl全部被水吸收),将混合物转入锥形瓶中,滴加甲基橙溶液,用 标准NaOH溶液滴定至终点(终点时硅酸未参加反应),消耗滴定液VmL。则产品的纯度为
标准NaOH溶液滴定至终点(终点时硅酸未参加反应),消耗滴定液VmL。则产品的纯度为______ %(用含m、c和V的代数式表示)。若产品中溶有少量 ,则测定结果
,则测定结果______ (填“偏高”、“偏低”或“无影响”)
(6) 也是制备高纯硅的重要原料,将其通入浓NaOH溶液中,发生反应的化学方程式为
也是制备高纯硅的重要原料,将其通入浓NaOH溶液中,发生反应的化学方程式为______ 。
①
 ,
,
②
 遇水剧烈水解,
遇水剧烈水解, 的熔点、沸点分别为―70.0℃、57.7℃。
的熔点、沸点分别为―70.0℃、57.7℃。③电负性Cl>H>Si,
 的沸点为31.8℃,熔点为―126.5℃,在空气中易自燃,遇水会剧烈反应。
的沸点为31.8℃,熔点为―126.5℃,在空气中易自燃,遇水会剧烈反应。请回答下列问题:
(1)写出A中发生反应的离子方程式:
(2)装置B的作用是
(3)仪器F的名称是
(4)有同学设计如图装置H、I替代上述E、G装置;
(5)测定产品纯度。取mg
 产品溶于足量蒸馏水中(生成的HCl全部被水吸收),将混合物转入锥形瓶中,滴加甲基橙溶液,用
产品溶于足量蒸馏水中(生成的HCl全部被水吸收),将混合物转入锥形瓶中,滴加甲基橙溶液,用 标准NaOH溶液滴定至终点(终点时硅酸未参加反应),消耗滴定液VmL。则产品的纯度为
标准NaOH溶液滴定至终点(终点时硅酸未参加反应),消耗滴定液VmL。则产品的纯度为 ,则测定结果
,则测定结果(6)
 也是制备高纯硅的重要原料,将其通入浓NaOH溶液中,发生反应的化学方程式为
也是制备高纯硅的重要原料,将其通入浓NaOH溶液中,发生反应的化学方程式为
您最近一年使用:0次
2024-04-19更新
|
217次组卷
|
2卷引用:云南省曲靖市第二中学学联体2024届高三第一次联考理综-化学试卷
解题方法
4 . 资料显示,水溶液中 与
与 发生互促水解生成蓝色沉淀
发生互促水解生成蓝色沉淀 。某小组同学设计实验探究水溶液中
。某小组同学设计实验探究水溶液中 与
与 反应的产物。
反应的产物。
实验记录如下:将 溶液逐滴加入盐酸酸化的
溶液逐滴加入盐酸酸化的 溶液中,溶液蓝色变浅,有白色沉淀生成。
溶液中,溶液蓝色变浅,有白色沉淀生成。
(1) 溶液用盐酸酸化的目的是
溶液用盐酸酸化的目的是___________ 。
(2)查阅资料得知,该白色沉淀是 。写出产生
。写出产生 的离子方程式:
的离子方程式:___________ 。
(3)甲同学认为:要证明 氧化了
氧化了 ,可检验溶液中含有
,可检验溶液中含有 。操作为:取少量上层清液于试管中,
。操作为:取少量上层清液于试管中,___________ (将操作和现象补充完整)。
(4)乙同学认为:溶液中存在 不一定是
不一定是 氧化的,体系中存在的
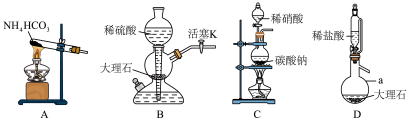
氧化的,体系中存在的 会干扰实验,于是设计了如下4个装置排除体系中的
会干扰实验,于是设计了如下4个装置排除体系中的 。其中合理的是
。其中合理的是___________ (填字母),仪器a的名称是___________ 。
(5)丙同学认为: 的还原性大
的还原性大 ,也可与盐酸酸化的
,也可与盐酸酸化的 溶液反应生成
溶液反应生成 沉淀,你认为是否合理,如果合理,简述你的实验方案,如果不合理,说明理由:
沉淀,你认为是否合理,如果合理,简述你的实验方案,如果不合理,说明理由:___________ 。
(6)称取沉淀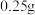 与过量氯化铁溶液反应,待样品完全溶解后,加水
与过量氯化铁溶液反应,待样品完全溶解后,加水 、邻菲啰啉溶液2滴,用
、邻菲啰啉溶液2滴,用 硫酸铈
硫酸铈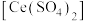 标准溶液滴定,滴定终点时消耗标准溶液
标准溶液滴定,滴定终点时消耗标准溶液 (已知:
(已知:
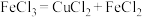 ,
, )。邻菲啰啉溶液的作用是
)。邻菲啰啉溶液的作用是___________ ,沉淀中 的质量分数为
的质量分数为___________ 。
 与
与 发生互促水解生成蓝色沉淀
发生互促水解生成蓝色沉淀 。某小组同学设计实验探究水溶液中
。某小组同学设计实验探究水溶液中 与
与 反应的产物。
反应的产物。实验记录如下:将
 溶液逐滴加入盐酸酸化的
溶液逐滴加入盐酸酸化的 溶液中,溶液蓝色变浅,有白色沉淀生成。
溶液中,溶液蓝色变浅,有白色沉淀生成。(1)
 溶液用盐酸酸化的目的是
溶液用盐酸酸化的目的是(2)查阅资料得知,该白色沉淀是
 。写出产生
。写出产生 的离子方程式:
的离子方程式:(3)甲同学认为:要证明
 氧化了
氧化了 ,可检验溶液中含有
,可检验溶液中含有 。操作为:取少量上层清液于试管中,
。操作为:取少量上层清液于试管中,(4)乙同学认为:溶液中存在
 不一定是
不一定是 氧化的,体系中存在的
氧化的,体系中存在的 会干扰实验,于是设计了如下4个装置排除体系中的
会干扰实验,于是设计了如下4个装置排除体系中的 。其中合理的是
。其中合理的是
(5)丙同学认为:
 的还原性大
的还原性大 ,也可与盐酸酸化的
,也可与盐酸酸化的 溶液反应生成
溶液反应生成 沉淀,你认为是否合理,如果合理,简述你的实验方案,如果不合理,说明理由:
沉淀,你认为是否合理,如果合理,简述你的实验方案,如果不合理,说明理由:(6)称取沉淀
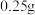 与过量氯化铁溶液反应,待样品完全溶解后,加水
与过量氯化铁溶液反应,待样品完全溶解后,加水 、邻菲啰啉溶液2滴,用
、邻菲啰啉溶液2滴,用 硫酸铈
硫酸铈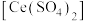 标准溶液滴定,滴定终点时消耗标准溶液
标准溶液滴定,滴定终点时消耗标准溶液 (已知:
(已知:
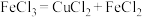 ,
, )。邻菲啰啉溶液的作用是
)。邻菲啰啉溶液的作用是 的质量分数为
的质量分数为
您最近一年使用:0次
解题方法
5 . 久置的硝酸银溶液,试剂瓶底部有黑色固体A,瓶口和瓶壁上有黑色固体B。
已知:①硝酸银见光或受热会分解,分解产物相同。
②氧化银为棕黑色粉末,难溶于水,可溶于氨水和稀硝酸,见光或200℃左右分解生成氧气。
③AgOH不稳定,极易分解生成 和
和 。
。
某兴趣小组开展以下探究活动。
Ⅰ.探究硝酸银固体受热分解的产物
利用下列装置(夹持仪器略去)进行实验。
(1)仪器e名称为___________ ,试管b的主要作用是___________ 。
(2)试管a中反应的化学方程式为___________ 。
Ⅱ.探究A、B的成分
【提出猜想】甲、乙同学猜想固体中含有Ag、 中的一种或两种。
中的一种或两种。
(3)从化学变化角度,甲、乙同学猜想固体中可能含有 的依据是
的依据是___________ 。
【进行实验】甲、乙分别对固体A、B按以下步骤进行实验。
i.取少量固体于试管中;
ii.加入过量氨水,振荡;
iii.……
【形成结论】甲得出固体A为Ag和 的混合物,乙得出固体B为Ag。
的混合物,乙得出固体B为Ag。
(4)①甲同学步骤ⅱ观察到的现象为___________ ,相应的化学方程式为___________ 。
②乙同学步骤ⅲ加入的试剂为___________ (填名称)。
【反思与应用】
(5)固体A与固体B成分不同的可能原因是___________ 。
(6)实验室保存硝酸银溶液采取的措施为___________ (写出两条)。
已知:①硝酸银见光或受热会分解,分解产物相同。
②氧化银为棕黑色粉末,难溶于水,可溶于氨水和稀硝酸,见光或200℃左右分解生成氧气。
③AgOH不稳定,极易分解生成
 和
和 。
。某兴趣小组开展以下探究活动。
Ⅰ.探究硝酸银固体受热分解的产物
利用下列装置(夹持仪器略去)进行实验。

(1)仪器e名称为
(2)试管a中反应的化学方程式为
Ⅱ.探究A、B的成分
【提出猜想】甲、乙同学猜想固体中含有Ag、
 中的一种或两种。
中的一种或两种。(3)从化学变化角度,甲、乙同学猜想固体中可能含有
 的依据是
的依据是【进行实验】甲、乙分别对固体A、B按以下步骤进行实验。
i.取少量固体于试管中;
ii.加入过量氨水,振荡;
iii.……
【形成结论】甲得出固体A为Ag和
 的混合物,乙得出固体B为Ag。
的混合物,乙得出固体B为Ag。(4)①甲同学步骤ⅱ观察到的现象为
②乙同学步骤ⅲ加入的试剂为
【反思与应用】
(5)固体A与固体B成分不同的可能原因是
(6)实验室保存硝酸银溶液采取的措施为
您最近一年使用:0次
2024-04-01更新
|
630次组卷
|
5卷引用:福建省莆田市2024届高三下学期毕业班二模考试化学试题
福建省莆田市2024届高三下学期毕业班二模考试化学试题(已下线)题型9 实验综合题(25题)-2024年高考化学常考点必杀300题(新高考通用)2024届陕西省渭南市临渭区高三下学期三模理综试题-高中化学2024届陕西省渭南市富平县高三下学期二模理综试题-高中化学(已下线)压轴题12?化学实验综合题(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)
解题方法
6 . 贵金属银有广泛用途。工业上用银锰精矿(主要含 、MnS、
、MnS、 等)制备银,同时获得二氧化锰的流程如下。
等)制备银,同时获得二氧化锰的流程如下。
(1)“浸锰”步骤中产生的浸锰液主要含有 ,生成气体的主要成分为
,生成气体的主要成分为_______ ;用惰性电极电解浸锰液制 ,写出电解总反应的化学方程式
,写出电解总反应的化学方程式_______ 。
(2)已知“浸铁”步骤中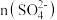 保持不变,反应中n(氧化剂):n(还原剂)=
保持不变,反应中n(氧化剂):n(还原剂)=_______ ;浸铁滤饼的主要成分为S和_______ 。
(3)“浸银”时发生反应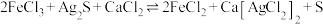 ,其中
,其中 在溶液中是一种稳定配合物。加入
在溶液中是一种稳定配合物。加入 的作用是
的作用是_______ ;结合离子方程式,从平衡角度分析选用氯化物浓溶液的原因是_______ 。
(4)“沉银”步骤中,生成单质银的离子反应方程式为_______ ,沉银液经处理可再利用,方法是向沉银液中通入_______ (写化学式),通过一步转化后循环再用。
 、MnS、
、MnS、 等)制备银,同时获得二氧化锰的流程如下。
等)制备银,同时获得二氧化锰的流程如下。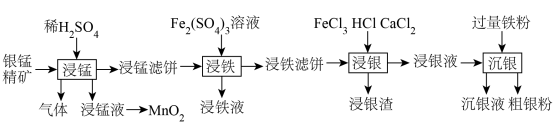
(1)“浸锰”步骤中产生的浸锰液主要含有
 ,生成气体的主要成分为
,生成气体的主要成分为 ,写出电解总反应的化学方程式
,写出电解总反应的化学方程式(2)已知“浸铁”步骤中
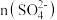 保持不变,反应中n(氧化剂):n(还原剂)=
保持不变,反应中n(氧化剂):n(还原剂)=(3)“浸银”时发生反应
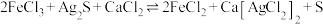 ,其中
,其中 在溶液中是一种稳定配合物。加入
在溶液中是一种稳定配合物。加入 的作用是
的作用是(4)“沉银”步骤中,生成单质银的离子反应方程式为
您最近一年使用:0次
解题方法
7 . 三草酸合铁(Ⅲ)酸钾晶体{ ,
,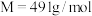 },为翠绿色单斜晶体,溶于水,难溶于乙醇,是一些有机反应的催化剂。实验室制备该晶体具体步骤如下:
},为翠绿色单斜晶体,溶于水,难溶于乙醇,是一些有机反应的催化剂。实验室制备该晶体具体步骤如下:
Ⅰ.制备
ⅰ.称 摩尔盐[
摩尔盐[ ,
, ]放入
]放入 水中。再加入
水中。再加入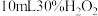 溶液,搅拌,微热。
溶液,搅拌,微热。
ⅱ.继续加入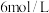 氨水(过量),加热,不断搅拌,煮沸后静置,倾去上层清液,抽滤得
氨水(过量),加热,不断搅拌,煮沸后静置,倾去上层清液,抽滤得 沉淀。
沉淀。
Ⅱ.制备
ⅲ.称取 和
和 加入盛有
加入盛有 水的烧杯中,加热使其完全溶解后,搅拌,将步骤ⅱ制取的
水的烧杯中,加热使其完全溶解后,搅拌,将步骤ⅱ制取的 加入此溶液中。加热,使
加入此溶液中。加热,使 溶解,溶液呈翠绿色。
溶解,溶液呈翠绿色。
ⅳ.过滤,将滤液浓缩。浓缩液转移至 烧杯中,后进行操作a。将得到的晶体分别用少量水和
烧杯中,后进行操作a。将得到的晶体分别用少量水和 乙醇洗涤,干燥,称量晶体质量为
乙醇洗涤,干燥,称量晶体质量为 。
。
回答下列问题:
(1)步骤ⅰ中使用部分仪器如下:

仪器A的名称是___________ ,微热时,温度不能过高的原因是___________ 。
(2)已知:二价铁在碱性介质中比酸性介质中更易氧化。摩尔盐相比硫酸亚铁不易变质的原因是___________ 。
(3)步骤ⅱ中,制备 加热煮沸的目的是
加热煮沸的目的是___________ 。
(4)步骤ⅲ中,写出将氢氧化铁加入溶液的离子方程式___________ 。
(5)已知三草酸合铁(Ⅲ)酸钾与氢氧化钾溶解性曲线如下图所示,步骤ⅰ中操作 为
为___________ 。

(6)用95%乙醇洗涤晶体的目的为___________ 。
(7)该实验的产率为___________  (保留1位小数)。
(保留1位小数)。
 ,
,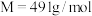 },为翠绿色单斜晶体,溶于水,难溶于乙醇,是一些有机反应的催化剂。实验室制备该晶体具体步骤如下:
},为翠绿色单斜晶体,溶于水,难溶于乙醇,是一些有机反应的催化剂。实验室制备该晶体具体步骤如下:Ⅰ.制备

ⅰ.称
 摩尔盐[
摩尔盐[ ,
, ]放入
]放入 水中。再加入
水中。再加入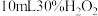 溶液,搅拌,微热。
溶液,搅拌,微热。ⅱ.继续加入
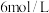 氨水(过量),加热,不断搅拌,煮沸后静置,倾去上层清液,抽滤得
氨水(过量),加热,不断搅拌,煮沸后静置,倾去上层清液,抽滤得 沉淀。
沉淀。Ⅱ.制备

ⅲ.称取
 和
和 加入盛有
加入盛有 水的烧杯中,加热使其完全溶解后,搅拌,将步骤ⅱ制取的
水的烧杯中,加热使其完全溶解后,搅拌,将步骤ⅱ制取的 加入此溶液中。加热,使
加入此溶液中。加热,使 溶解,溶液呈翠绿色。
溶解,溶液呈翠绿色。ⅳ.过滤,将滤液浓缩。浓缩液转移至
 烧杯中,后进行操作a。将得到的晶体分别用少量水和
烧杯中,后进行操作a。将得到的晶体分别用少量水和 乙醇洗涤,干燥,称量晶体质量为
乙醇洗涤,干燥,称量晶体质量为 。
。回答下列问题:
(1)步骤ⅰ中使用部分仪器如下:

仪器A的名称是
(2)已知:二价铁在碱性介质中比酸性介质中更易氧化。摩尔盐相比硫酸亚铁不易变质的原因是
(3)步骤ⅱ中,制备
 加热煮沸的目的是
加热煮沸的目的是(4)步骤ⅲ中,写出将氢氧化铁加入溶液的离子方程式
(5)已知三草酸合铁(Ⅲ)酸钾与氢氧化钾溶解性曲线如下图所示,步骤ⅰ中操作
 为
为
(6)用95%乙醇洗涤晶体的目的为
(7)该实验的产率为
 (保留1位小数)。
(保留1位小数)。
您最近一年使用:0次
名校
8 . 镍常作催化剂。以镍废料(主要成分为Ni,含 、NiO、FeO、CaO和
、NiO、FeO、CaO和 )为原料制备纯镍的流程如图所示:
)为原料制备纯镍的流程如图所示:
(1)“酸浸”得到滤渣1的主要成分是 和
和__________ (填化学式)。“酸浸”中镍浸出率与硫酸浓度的关系如图所示。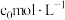 时,镍浸出率降低的可能原因是
时,镍浸出率降低的可能原因是_____________________ (答一条)。
(2)“氧化”中双氧水的作用是______________________ (用离子方程式表示)。
(3)“沉铝”中NiO的作用是________________________________________ 。
(4) 在隔绝空气条件下的热失重曲线如图所示。
在隔绝空气条件下的热失重曲线如图所示。________________________ ,c点对应的氧化物为____________ (填化学式)。
(5)Ni和Nb可组成一种合金材料,其晶胞结构如图所示。 代表阿伏加德罗常数的值,
代表阿伏加德罗常数的值,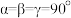 ,该晶胞中Ni、Nb的个数之比为
,该晶胞中Ni、Nb的个数之比为_____________ 。该晶体的密度为_________  (用含a、b、
(用含a、b、 的代数式表示)。
的代数式表示)。
 、NiO、FeO、CaO和
、NiO、FeO、CaO和 )为原料制备纯镍的流程如图所示:
)为原料制备纯镍的流程如图所示: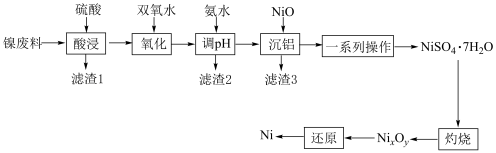
(1)“酸浸”得到滤渣1的主要成分是
 和
和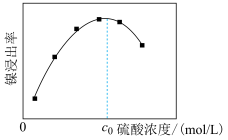
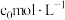 时,镍浸出率降低的可能原因是
时,镍浸出率降低的可能原因是(2)“氧化”中双氧水的作用是
(3)“沉铝”中NiO的作用是
(4)
 在隔绝空气条件下的热失重曲线如图所示。
在隔绝空气条件下的热失重曲线如图所示。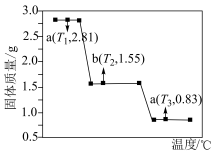
(5)Ni和Nb可组成一种合金材料,其晶胞结构如图所示。
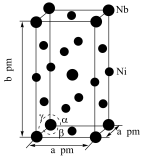
 代表阿伏加德罗常数的值,
代表阿伏加德罗常数的值,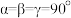 ,该晶胞中Ni、Nb的个数之比为
,该晶胞中Ni、Nb的个数之比为 (用含a、b、
(用含a、b、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
解题方法
9 . 硫化钠主要用于皮革、毛纺、高档纸张、染料等行业。回答下列问题:
Ⅰ.工业生产硫化钠大多采用无水芒硝(Na2SO4) -炭粉还原法,其流程示意图如下:
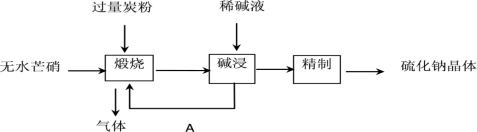
(1)①写出硫化钠的电子式___________
②上述流程中“碱浸”后,物质A必须经过___________ (填写操作名称)处理后,方可“煅烧”;若煅烧所得气体为等物质的量的 和
和 ,写出煅烧时发生的总的化学反应方程式为
,写出煅烧时发生的总的化学反应方程式为___________ 。
③上述流程中采用稀碱液比用热水更好,理由是___________ 。
Ⅱ.工业生产的硫化钠粗品中常含有一定量的煤灰及重金属硫化物等杂质。硫化钠易溶于热乙醇,重金属硫化物难溶于乙醇。实验室中常用95%乙醇重结晶纯化硫化钠粗品。溶解回流装置如下图所示,
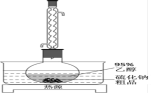
(2)回流前无需加入沸石,其原因是___________ 。回流时间不宜过长,原因是___________ ;回流结束后,需进行的操作有①停止加热②关闭冷凝水③移去水浴,正确的顺序为___________ (填标号)。
a.①②③ b.③①② c.②①③ d.①③②
(3)某毛纺厂废水中含 的硫化钠,与纸张漂白后的废水(含
的硫化钠,与纸张漂白后的废水(含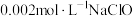 )按
)按 的体积比混合,能同时较好处理两种废水,处理后的废水中所含的主要阴离子有
的体积比混合,能同时较好处理两种废水,处理后的废水中所含的主要阴离子有___________ 。
Ⅰ.工业生产硫化钠大多采用无水芒硝(Na2SO4) -炭粉还原法,其流程示意图如下:

(1)①写出硫化钠的电子式
②上述流程中“碱浸”后,物质A必须经过
 和
和 ,写出煅烧时发生的总的化学反应方程式为
,写出煅烧时发生的总的化学反应方程式为③上述流程中采用稀碱液比用热水更好,理由是
Ⅱ.工业生产的硫化钠粗品中常含有一定量的煤灰及重金属硫化物等杂质。硫化钠易溶于热乙醇,重金属硫化物难溶于乙醇。实验室中常用95%乙醇重结晶纯化硫化钠粗品。溶解回流装置如下图所示,

(2)回流前无需加入沸石,其原因是
a.①②③ b.③①② c.②①③ d.①③②
(3)某毛纺厂废水中含
 的硫化钠,与纸张漂白后的废水(含
的硫化钠,与纸张漂白后的废水(含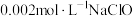 )按
)按 的体积比混合,能同时较好处理两种废水,处理后的废水中所含的主要阴离子有
的体积比混合,能同时较好处理两种废水,处理后的废水中所含的主要阴离子有
您最近一年使用:0次
解题方法
10 . 实验室利用 和亚硫酰氯(
和亚硫酰氯( )制备无水
)制备无水 的装置如图所示(加热及夹持装置略)。已知
的装置如图所示(加热及夹持装置略)。已知 沸点为76℃,遇水极易反应生成两种酸性气体。回答下列问题:
沸点为76℃,遇水极易反应生成两种酸性气体。回答下列问题:
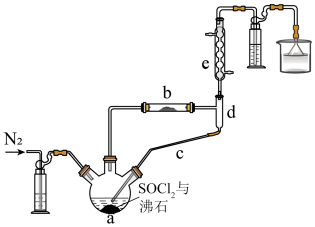
(1)仪器a的名称为________ 。
(2)实验开始时先通 ,作用是
,作用是________ ;一段时间后,先加热装置a再加热装置b,目的是________ 。
(3)加热时,装置b内发生反应的化学方程式为_________ 。
(4)f中试剂是________ 。
(5)g烧杯中的试剂可以是_________ 。
a. 溶液 b.
溶液 b. 溶液 c.浓硫酸 d.
溶液 c.浓硫酸 d. 溶液
溶液
(6)反应前,称取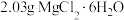 (
( 的相对分子质量为203),反应后,称得b中固体质量为
的相对分子质量为203),反应后,称得b中固体质量为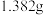 ,无水
,无水 的产率为
的产率为_______ (保留两位有效数字)。
 和亚硫酰氯(
和亚硫酰氯( )制备无水
)制备无水 的装置如图所示(加热及夹持装置略)。已知
的装置如图所示(加热及夹持装置略)。已知 沸点为76℃,遇水极易反应生成两种酸性气体。回答下列问题:
沸点为76℃,遇水极易反应生成两种酸性气体。回答下列问题:
(1)仪器a的名称为
(2)实验开始时先通
 ,作用是
,作用是(3)加热时,装置b内发生反应的化学方程式为
(4)f中试剂是
(5)g烧杯中的试剂可以是
a.
 溶液 b.
溶液 b. 溶液 c.浓硫酸 d.
溶液 c.浓硫酸 d. 溶液
溶液(6)反应前,称取
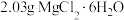 (
( 的相对分子质量为203),反应后,称得b中固体质量为
的相对分子质量为203),反应后,称得b中固体质量为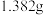 ,无水
,无水 的产率为
的产率为
您最近一年使用:0次



