 与
与 发生互促水解生成蓝色沉淀
发生互促水解生成蓝色沉淀 。某小组同学设计实验探究水溶液中
。某小组同学设计实验探究水溶液中 与
与 反应的产物。
反应的产物。实验记录如下:将
 溶液逐滴加入盐酸酸化的
溶液逐滴加入盐酸酸化的 溶液中,溶液蓝色变浅,有白色沉淀生成。
溶液中,溶液蓝色变浅,有白色沉淀生成。(1)
 溶液用盐酸酸化的目的是
溶液用盐酸酸化的目的是(2)查阅资料得知,该白色沉淀是
 。写出产生
。写出产生 的离子方程式:
的离子方程式:(3)甲同学认为:要证明
 氧化了
氧化了 ,可检验溶液中含有
,可检验溶液中含有 。操作为:取少量上层清液于试管中,
。操作为:取少量上层清液于试管中,(4)乙同学认为:溶液中存在
 不一定是
不一定是 氧化的,体系中存在的
氧化的,体系中存在的 会干扰实验,于是设计了如下4个装置排除体系中的
会干扰实验,于是设计了如下4个装置排除体系中的 。其中合理的是
。其中合理的是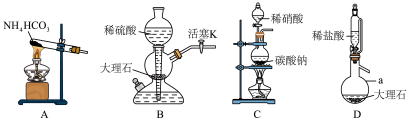
(5)丙同学认为:
 的还原性大
的还原性大 ,也可与盐酸酸化的
,也可与盐酸酸化的 溶液反应生成
溶液反应生成 沉淀,你认为是否合理,如果合理,简述你的实验方案,如果不合理,说明理由:
沉淀,你认为是否合理,如果合理,简述你的实验方案,如果不合理,说明理由:(6)称取沉淀
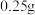 与过量氯化铁溶液反应,待样品完全溶解后,加水
与过量氯化铁溶液反应,待样品完全溶解后,加水 、邻菲啰啉溶液2滴,用
、邻菲啰啉溶液2滴,用 硫酸铈
硫酸铈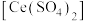 标准溶液滴定,滴定终点时消耗标准溶液
标准溶液滴定,滴定终点时消耗标准溶液 (已知:
(已知:
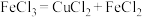 ,
, )。邻菲啰啉溶液的作用是
)。邻菲啰啉溶液的作用是 的质量分数为
的质量分数为相似题推荐
(1)样品中BaS的质量分数的测定:
步骤Ⅰ. 准确称取10.00 g试样,加适量水,待可溶物全部溶解,过滤,并洗涤沉淀,将洗涤液与滤液一并转移至500 mL容量瓶中,定容、摇匀。
步骤Ⅱ .取20.00 mL醋酸溶液(过量)于锥形瓶中,再加入20.00 mL 0.08000 mol·L-1碘标准溶液,然后再向锥形瓶中加入10.00 mL步骤Ⅰ所配的试样溶液,边加边振荡。充分反应后,硫元素完全转化为硫单质。
步骤Ⅲ. 以淀粉为指示剂,用0.05000 mol·L-1 Na2S2O3标准溶液滴定至终点,发生反应:2S2O
 +I2=S4O
+I2=S4O +2I-。消耗Na2S2O3溶液20.00 mL。
+2I-。消耗Na2S2O3溶液20.00 mL。①步骤Ⅲ中滴定终点时的现象为
②计算试样中BaS的质量分数
(2)BaS溶液的制备:向BaS样品中加入热水,充分搅拌后过滤,得BaS溶液。
已知:室温下,Ka1(H2S)=1.3×10-7,Ka2(H2S)=7.1×10-15。测得0.1 mol·L-1BaS溶液pH≈13。溶液中OH-、S2-、HS-三种离子浓度由大到小的顺序依次是
(3)高纯碳酸锰的制备:BaS溶液和MnO2经反应、过滤、酸溶、净化可制得MnSO4溶液。
①MnSO4溶液和NH4HCO3固体混合后,反应生成MnCO3。反应方程式为2HCO
 +Mn2+=MnCO3↓+H2O+CO2↑。
+Mn2+=MnCO3↓+H2O+CO2↑。实际制取MnCO3时,一般选择使用氨水-NH4HCO3混合溶液代替NH4HCO3固体,这样改进的优点是
②已知:6.5<pH<7.5时,碳酸锰产率较高。请设计以MnSO4溶液、氨水-NH4HCO3混合溶液为原料制备高纯碳酸锰的实验方案:

(1)仪器a的名称是
(2)实验中为了使催化剂M的活性达到最大值,采用的措施有抽真空排除水蒸气干扰、用排硅油的方法收集气体以免引入水蒸气、
(3)若要将分解所得气体中的CO2除去并收集氢气,可调节三通阀的位置将气体导出,并依次通过下列装置:装NaOH溶液的洗气瓶→装浓硫酸的洗气瓶→氢气收集装置→装有碱石灰的干燥管→酒精灯点燃尾气。其中收集氢气可选择的装置是
A.
 B.
B. C.
C. D.
D.
(4)实验室可以用碘量法测定工业甲酸的含量(杂质不参与反应),具体操作:称取6.000g工业甲酸配成250mL溶液,量取25.00mL于锥形瓶中,先加入30mL0.5000mol/L的次溴酸钠溶液与甲酸反应生成CO2和NaBr,再用足量KI与过量的次溴酸钠反应生成I2和NaBr,加入几滴淀粉溶液后用0.4000mol/L的Na2S2O3标准溶液滴定I2(2Na2S2O3+I2=2NaI+Na2S4O6),至滴定终点时Na2S2O3溶液12.50mL。
①次溴酸钠溶液与甲酸反应的化学方程式是
②滴定终点的标志是
③该工业甲酸中甲酸的质量分数是(保留三位有效数字)
(1)把待测液中的Fe3+还原成Fe2+,应选用下列试剂
A.氯水 B. H2O2 C. Fe屑 D. Cu
(2)滴定开始和结束时,滴定管中的液面如图所示,则终点读数为

滴定过程中,用左手控制滴定管活塞,边滴边摇动锥形瓶,眼睛应注视
(3)下列操作会使测得样品中铁的质量分数偏高的是
A.滴定管用蒸馏水洗涤后,直接加入高锰酸钾标准溶液进行滴定。
B.锥形瓶用蒸馏水洗涤后,水未倒尽,就加入待测液进行滴定。
C.记录测定结果时,滴定前仰视液凹面最低处,滴定到达终点时又俯视读数。
(4)如果矿石是用盐酸溶解配制成待测液,则测定的结果矿石中含铁量
(5)矿石中含铁的质量分数为
已知:①硝酸银见光或受热会分解,分解产物相同。
②氧化银为棕黑色粉末,难溶于水,可溶于氨水和稀硝酸,见光或200℃左右分解生成氧气。
③AgOH不稳定,极易分解生成
 和
和 。
。某兴趣小组开展以下探究活动。
Ⅰ.探究硝酸银固体受热分解的产物
利用下列装置(夹持仪器略去)进行实验。

(1)仪器e名称为
(2)试管a中反应的化学方程式为
Ⅱ.探究A、B的成分
【提出猜想】甲、乙同学猜想固体中含有Ag、
 中的一种或两种。
中的一种或两种。(3)从化学变化角度,甲、乙同学猜想固体中可能含有
 的依据是
的依据是【进行实验】甲、乙分别对固体A、B按以下步骤进行实验。
i.取少量固体于试管中;
ii.加入过量氨水,振荡;
iii.……
【形成结论】甲得出固体A为Ag和
 的混合物,乙得出固体B为Ag。
的混合物,乙得出固体B为Ag。(4)①甲同学步骤ⅱ观察到的现象为
②乙同学步骤ⅲ加入的试剂为
【反思与应用】
(5)固体A与固体B成分不同的可能原因是
(6)实验室保存硝酸银溶液采取的措施为

相关金属离子[c(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ | Mn2+ | Ni2+ |
| 开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 | 8.1 | 6.9 |
| 沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 | 10.1 | 8.9 |
已知:
①“溶浸”后的溶液pH=1,所含金属离子主要有:Zn2+、Fe2+、Cd2+、Mn2+、Ni2+;
②弱酸性溶液中KMnO4氧化Mn2+时,产物中含Mn元素物质只有MnO2;
③氧化性顺序:Ni2+>Cd2+>Zn2+。
回答下列问题:
(1)①“溶浸”过程中,为了提高浸出率,可采取的措施是
②“调pH”是向“溶浸”后的溶液中加入少量
(2)“滤渣2”的化学成分为
(3)“还原除杂”除去的离子是
(4)“沉锌”时生成碱式碳酸锌[ZnCO3·2Zn(OH)2·2H2O]沉淀,分析测得1kg该沉淀“高温灼烧”后获得ZnO0.670kg。则“高温灼烧”过程中原料的转化率为

已知:①酸浸后As元素以H3AsO4形式存在;
②常温下,Ksp[Cu(OH)2]≈1.0×10-20;
③聚合硫酸铁盐基度[聚合硫酸铁中
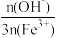 ×100%]越大,絮凝效果越好。
×100%]越大,絮凝效果越好。回答下列问题:
(1)“酸浸渣”中所含金属化合物是
(2)生成Ca3(AsO4)2•Ca(OH)2的化学方程式为
(3)在一定温度下,将NaClO4加入“浓缩液”中可制取聚合硫酸铁[Fe2(OH)x(SO4)y]m。
①x和y的关系应满足:y=
②“滤液3”中H2SO4的加入量对盐基度的影响如图所示,当n(H2SO4):n(FeSO4)>0.35时,产品的盐基度减小,其原因是

(4)①“萃余液”经
②加热ZnSO4•7H2O固体,固体质量保留百分数与温度的关系如图所示。将ZnSO4•7H2O(M=287g•mol-1)加热到145℃时得到ZnSO4•xH2O,其中x的值为

 )、钴(
)、钴( )等单质。湿法炼锌产生的铜镉渣用于生产金属镉的工艺流程如图:
)等单质。湿法炼锌产生的铜镉渣用于生产金属镉的工艺流程如图:
下表列出了相关金属离子生成氢氧化物沉淀的
 (金属离子的起始浓度为
(金属离子的起始浓度为 )
)| 氢氧化物 |  |  |  |
开始沉淀的 | 1.5 | 6.5 | 7.2 |
沉淀完全的 | 3.3 | 9.9 | 9.5 |
(1)酸浸时粉碎铜镉渣的目的是
(2)操作Ⅰ产生的滤渣主要成分为
(3)①操作Ⅲ中先加入适量
 ,发生反应的离子方程式为
,发生反应的离子方程式为②再加入
 控制反应液的
控制反应液的 ,
, 范围为
范围为③若加入的
 不足,加入
不足,加入 后所得的电解液中会含有
后所得的电解液中会含有 元素。
元素。请设计实验方案加以鉴别
 在工业、农业等方面有广泛的应用,工业上可由高铁菱镒矿(主要成分为
在工业、农业等方面有广泛的应用,工业上可由高铁菱镒矿(主要成分为 ,含有
,含有 、
、 、
、 、
、 、
、 等杂质)制备,部分工艺流程如图所示:
等杂质)制备,部分工艺流程如图所示:
已知:①相关金属离子生成氢氧化物沉淀的
 (开始沉淀的
(开始沉淀的 按离子浓度为
按离子浓度为 计算)
计算)| 金属离子 |  |  |  |  |  |  |
开始沉淀的 | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
完全沉淀的 | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
②常温下,
 、
、 的溶度积分别为
的溶度积分别为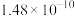 、
、 。
。回答下列问题:
(1)酸浸时需将高铁菱锰矿粉碎,目的是
(2)“氧化”过程的目的为
 ”的范围是
”的范围是(3)“除杂”过程中加入
 的目的是将
的目的是将 、
、 变为
变为 、
、 沉淀除去,两种沉淀共存时溶液中
沉淀除去,两种沉淀共存时溶液中
(4)“沉锰”过程中发生反应的离子方程式为
(5)生成的
 沉淀需经充分洗涤,洗涤沉淀的方法是
沉淀需经充分洗涤,洗涤沉淀的方法是(6)
 在水中的溶解度与温度关系如图。由
在水中的溶解度与温度关系如图。由 获得较纯净的
获得较纯净的 晶体的方法是:将
晶体的方法是:将 溶于适量的稀硫酸,控制温度在80℃~90℃之间蒸发结晶,
溶于适量的稀硫酸,控制温度在80℃~90℃之间蒸发结晶, 晶体,洗涤、烘干。
晶体,洗涤、烘干。
【推荐3】I、硼酸(H3BO3)大量应用于玻璃制造行业,以硼镁矿(2MgO·B2O3·H2O、SiO2及少量Fe3O4、CaCO3、Al2O3)为原料生产硼酸的工艺流程如下:

已知: H3BO3在20°C、40°C、60°C、100°C时溶解度依次为5.0g、8.7g、14.8g、40.2 g。
(1)浸出渣除了CaSO4外,还有
(2)“浸出液”显酸性,含H3BO3和Mg2+、SO , 还含有Fe3+、Fe2+、Ca2+、Al3+等杂质。“除杂”时向浸出液中依次加入适量H2O2和MgO, 除去的杂质离子是
, 还含有Fe3+、Fe2+、Ca2+、Al3+等杂质。“除杂”时向浸出液中依次加入适量H2O2和MgO, 除去的杂质离子是
(3)“浸取”后,采用“热过滤”的目的是
(4)以硼酸为原料可制得硼氢化钠(NaBH4)它是有机合成中的重要还原剂,其电子式为
II、为了分析矿石中铁元素的含量,先将浸出液处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式:5Fe2+ + MnO + 8H+= 5Fe3+ + Mn2+ + 4H2O
+ 8H+= 5Fe3+ + Mn2+ + 4H2O
(5)滴定前是否要滴加指示剂?
(6)达到滴定终点的标志是
(7)某同学称取4.000g样品,经处理后在容量瓶中配制成100mL溶液,移取25.00mL试样溶液,用1.000×10-2mol/L KMnO4标准溶液滴定。达到滴定终点时消耗标准溶液20.00 mL, 则样品中铁元素的质量分数是
Ⅰ.理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag+=2Ag+Cu2+”设计一个化学电池(正极材料用碳棒),回答下列问题:
(1)该电池的负极材料是
(2)正极上出现的现象是
(3)若导线上转移电子1 mol,则生成银
Ⅱ.有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol·L-1的H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。
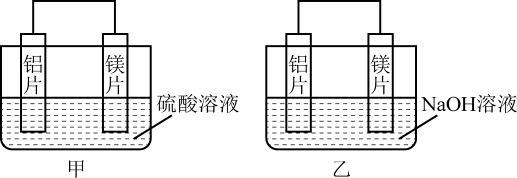
(4)写出甲中正极的电极反应式:
(5)乙中负极为
(6)如果甲与乙同学均认为“构成原电池的电极材料都是金属时,则构成负极材料的金属应比构成正极材料的金属活泼”,由此他们会得出不同的实验结论,依据该实验实验得出的下列结论中,正确的有___________________。
| A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质 |
| B.镁的金属性不一定比铝的金属性强 |
| C.该实验说明金属活动性顺序表已过时,没有实用价值了 |
| D.该实验说明化学研究对象复杂、反应受条件影响较大,因此具体问题应具体分析 |
(l)我国科研团队利用低温等离子体协同催化技术,在常温常压下实现了将CO2和CH4一步转化为化工产品。试写出 CO2与CH4合成乙酸的热化学方程式:
(甲烷和乙酸的燃烧热分别为-890.31 kJ/mol、-876.72 kJ/mol)
(2)在某一钢性密闭容器中CH4、CO2的分压分别为15 kPa、20 kPa,加入Ni/α-Al2 O3催化剂并加热至1123 K使其发生反应:CH4(g)+CO2(g)
 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。①研究表明CO的生成速率v(CO)=1.28
 10-2﹒p(CH4)
10-2﹒p(CH4) p(CO2)(kPa
p(CO2)(kPa s-1),某时刻测得p(H2)=10 kPa,则 p(CH4)=
s-1),某时刻测得p(H2)=10 kPa,则 p(CH4)= s-1。
s-1。②达到平衡后测得体系压强是起始时的
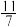 ,则该反应的平衡常数Kp=
,则该反应的平衡常数Kp=(3)氮化镓(GaN)与Cu可组成如图所示的人工光合系统,该装置能以CO2和H2O为原料合成CH4。
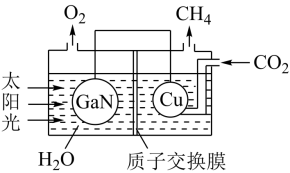
①该装置工作时H+移向
②该装置每产生1 mol CH4,左极室溶液质量减少
③本实验条件下,若CO2转化为烃(如甲烷、乙烯等)的转化率为10%,生成CH4的选择性为12%,现收集到12 mol CH4,则通入的CO2为
(4)上述人工光合系统装置也可以制备乙烯、乙炔等重要化工原料。2010年Sheth等研究得出乙炔在Pd表面选择加氢的反应机理,如下图所示。其中吸附在Pd表面的物质用“*”标注。

上述吸附反应为
 mol-1,该步骤的化学方程式为
mol-1,该步骤的化学方程式为(1)M在周期表的位置
(2)N的最高价氧化物对应水化物的化学式为:
(3)M与Fe与氢氧化钠溶液构成原电池,其负极反应式为:
(4)Z的最高价氧化物的水化物和M的最高价氧化物反应的离子方程为



