1 . 劳动最光荣。下列化学知识正确,且能解释所对应的劳动项目的是
| 选项 | 化学知识 | 劳动项目 |
| A | 乙醇具有强氧化性可以使细菌蛋白质变性 | 医疗服务:用75%的酒精溶液消毒 |
| B | 碳酸钠水解,溶液呈碱性 | 家务劳动:纯碱去油污 |
| C | 铝的化学性质很不活泼,所以耐腐蚀 | 工业生产:将铝制成饮料罐 |
| D | 石膏具有酸性 | 农业劳动:撒石膏改良碱性土壤(含碳酸钠) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
2 . 化学与生产、生活、社会密切相关。下列有关说法中正确的是
| A.草木灰溶液呈碱性,不能与铵态氮肥混合施用 |
| B.漂白粉中Ca(ClO)2具有强氧化性,能用来净化水 |
| C.碳纳米管是新型有机合成纤维,可用作储氢材料 |
| D.为防止食品腐败可在其包装袋里放置硅胶颗粒 |
您最近一年使用:0次
2018-04-10更新
|
368次组卷
|
2卷引用:安徽省马鞍山市2018届高三第二次教学质量监测理科综合化学试题
3 . 根据下列实验操作和现象,所得结论正确的是( )
| 实验操作、现象 | 结论 | |
| A | 火柴梗上滴少量的浓硫酸;火柴梗变黑 | 浓硫酸具有强氧化性 |
| B | 含锈的铁浸泡在NH4Cl溶液里;铁锈逐渐溶解 | NH4Cl溶液显酸性 |
| C | Ba(NO3)2溶液通入SO2气体;产生白色沉淀 | BaSO3难溶 |
| D | 某无色溶液中通入过量的CO2气体;有白色沉淀 | 一定含有AlO2- |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2016-12-09更新
|
154次组卷
|
2卷引用:安徽省阜阳市2019-2020学年高一下学期开学考化学试题
名校
解题方法
4 . 下表中相关物质的信息都正确的一项是 ( )
| 选项 | 化学式 | 电子式或含有的 化学键类型 | 物质的性质 | 与性质相对应的用途 |
| A | NaClO |  | 强氧化性 | 消毒液 |
| B | H2O2 | 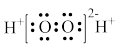 | 不稳定,易分解 | 医用消毒剂 |
| C | NH3 | 共价键 | 水溶液呈弱碱性 | 工业制硝酸 |
| D | KAl(SO4)2 | 离子键 | 易水解 | 自来水消毒剂 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-09-25更新
|
420次组卷
|
7卷引用:安徽省黄山市屯溪第一中学2021届高三上学期10月月考化学试题
安徽省黄山市屯溪第一中学2021届高三上学期10月月考化学试题辽宁省六校协作体2021届高三第一次联考化学试题辽宁省开原市中固镇第二中学2021届高三上学期9月月考化学试题(已下线)【南昌新东方】5 2020年10月江西南昌-南大附中-高三-上学期-月考化学卷黑龙江省农垦建三江管理局第一高级中学2021届高三上学期期中考试化学试题辽宁省调兵山市第二高级中学2021届高三下学期第一次模拟考试化学试题(已下线)第6周 晚练题-备战2022年高考化学周测与晚练(新高考专用)
真题
名校
5 . 化学在生活中有着广泛的应用,下列对应关系错误的是( )
| 化学性质 | 实际应用 | |
| A. | Al2(SO4)3和小苏打反应 | 泡沫灭火器灭火 |
| B. | 铁比铜金属性强 | FeCl3腐蚀Cu刻制印刷电路板 |
| C. | 次氯酸盐具有氧化性 | 漂白粉漂白织物 |
| D. | HF与SiO2反应 | 氢氟酸在玻璃器皿上刻蚀标记 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-01-30更新
|
11328次组卷
|
64卷引用:安徽师范大学附属中学2021-2022学年高三上学期11月考试化学试题
安徽师范大学附属中学2021-2022学年高三上学期11月考试化学试题2016年全国普通高等学校招生统一考试化学(新课标3卷精编版)2017届江西省九江第一中学高三7月暑期阶段性测试化学试题2017届河北沧州市第一中学高三上学期第一次月考化学试题2017届湖北省荆州中学高三上学期8月摸底化学试卷2016-2017学年山西省山西大学附中高二上9月月考化学卷2017届黑龙江省哈尔滨六中高三上9月月考化学试卷2017届广西钦州港经济开发区中学高三上9月月考化学试卷2017届河北省定兴第三中学高三上学期第一次月考化学试卷2017届宁夏育才中学高三上学期第二次月考化学试卷2017届甘肃省兰州一中高三上学期期中化学试卷2017届宁夏银川一中高三上月考四化学试卷河南省洛阳市第一高级中学2016-2017学年高一6月月考化学试题河南省安阳市第三十五中学2016-2017学年高二下学期期末考试化学试题河北省大名县第一中学2018届高三(普通班)上学期第一次月考化学试题贵州省遵义航天高级中学2018届高三第一次模拟考试(9月月考)理科综合化学试题黑龙江省哈尔滨市第十八中学2018届高三第一次月考化学试题河北省鸡泽县第一中学2018届高三上学期第一次月考化学试题内蒙古巴彦淖尔市第一中学2018届高三12月月考理科综合化学试题(已下线)【中等生百日捷进提升系列-基础练测】专题2.10 金属及其化合物【全国市级联考】湖南省五市十校2018年上学期高一期中考试化学试题(已下线)《考前20天终极攻略》-5月16日 化学与STSE(已下线)解密06 非金属及其化合物(教师版)——备战2018年高考化学之高频考点解密(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第2讲 氧及其化合物【教学案】四川省眉山市眉山中学2018-2019学年高二上学期10月月考理科综合化学试题【全国百强校】重庆市巴蜀中学2019届高三上学期期中复习化学试题【市级联考】吉林省东辽市2019届高三上学期期中考试化学试题辽宁省沈阳市东北育才学校2019届高三上学期第三次模拟化学试题(已下线)2019高考热点题型和提分秘籍 第四章 常见的非金属及其化合物 第2讲 氯及其化合物 (题型专练)(已下线)2019高考热点题型和提分秘籍 第四章 常见的非金属及其化合物 第2讲 氯及其化合物 (教学案)山东省微山县第二中学2019届高三上学期第三学段教学质量监测化学试题(已下线)2019高考备考二轮复习精品资料-专题6 非金属及其化合物(教学案)山西省长治市城区第二中学校2018-2019学年高二上学期期末考试化学试题2016年全国普通高等学校招生统一考试化学(全国3卷参考版)云南省师范大学附属中学2018~2019学年高一下学期3月考试化学试题【全国百强校】黑龙江省哈尔滨市第三中学校2020届高三上学期第一次验收考试化学试题黑龙江省齐齐哈尔市第八中学2020届高三10月月考化学试题(已下线)浙江省教育绿色评价联盟2020届高三10月适应性考试化学试题云南省玉溪第一中学2019-2020学年高二上学期第二次月考化学试题河北省承德市第一中学2019-2020学年高二下学期3月疫情期间直播课堂检测化学试题(已下线)专题一 化学与STSE(真题汇编)-2020年高考二轮模块化复习之《化学基本概念》名师讲案与提分特训(已下线)【南昌新东方】2019 八一、洪都 高一下 第一次月考(已下线)【南昌新东方】2019 八一中学、洪都中学、麻丘高中等七校高一下期中湖南省长沙市长郡中学2020届高三4月份教学质量监测理综化学试题黑龙江省鹤岗市第一中学2021届高三上学期第一次月考(开学考试)化学试题河南省郑州市第一中学2021届高三上学期开学测试化学试题辽宁师范大学附属中学2019-2020学年高二下学期期末考试化学试题鲁科版(2019)高一必修第一册第3章 物质的性质与转化 总结检测(已下线)小题必刷17 碳、硅与无机非金属材料——2021年高考化学一轮复习小题必刷(通用版)高一必修第二册(人教2019版)第五章 素养检测(已下线)江西省南昌市八一中学、洪都中学、麻丘高中等七校2018-2019学年高一下学期期中考试化学试题湖南省邵阳市邵东县创新实验学校2021届高三上学期第一次月考化学试题广东省深圳、汕头、潮州、揭阳名校2021届高三12月联考化学试题甘肃省武威第十八中学2021届高三上学期第四次诊断检测(期末)化学试题广西桂林市第十八中学2020-2021学年高一下学期开学考试化学试题(已下线)考向08 金属材料 金属的冶炼-备战2022年高考化学一轮复习考点微专题(已下线)考向11 氯及其化合物-备战2022年高考化学一轮复习考点微专题甘肃省武威市第六中学2020届高三上学期第三次阶段性复习过关考试化学试题福建省厦门市湖滨中学2021-2022学年高三上学期期中考试化学试题(已下线)卷01 化学与STSE-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)广东省大联考2021-2022学年高一下学期期中检测化学试题陕西省黄陵中学2021-2022学年高三上学期期中考试化学试题(已下线)章末综合评价(四)四川省宜宾市第四中学校2023-2024学年高一上学期1月期末化学试题
名校
6 . 在酸性或碱性较强的溶液中,铝均会溶解。但用食盐腌制的食品也不能长期存放在铝制品中,其主要原因是
| A.铝能与NaCl直接发生反应而被腐蚀 |
| B.长期存放的NaCl发生水解,其水溶液不再呈中性,可与铝发生反应 |
| C.铝与铝制品中的杂质(碳)、NaCl溶液形成原电池,发生析氢腐蚀 |
| D.铝与铝制品中的杂质(碳)、NaCl溶液形成原电池,发生吸氧腐蚀 |
您最近一年使用:0次
2017-10-10更新
|
155次组卷
|
5卷引用:安徽省六安市毛坦厂中学2020届高三11月月考化学试题
安徽省六安市毛坦厂中学2020届高三11月月考化学试题辽宁省重点高中协作校2018届高三上学期第一次阶段考试(10月) 化学试题(已下线)【艺体生文化课百题突围系列-基础练测】专题2.9 电化学基础湖南省汨罗市2021届高三9月检测考试化学试题(已下线)第六章 化学反应与能量 第37练 电解池 金属的腐蚀与防护
7 . 人民日报曾提出“废渣不废,废水金贵”,为实现资源的阶梯应用,科研工作者以镍黄渣为原料,采用以下工艺流程可制备纯净的NiCO3,相应的滤渣用于回收其他金属。已知:镍黄渣中含NiSO4,还包括铜、铁、锌、钙、镁、铝、铬、锰、钴等金属杂质离子及不溶物。
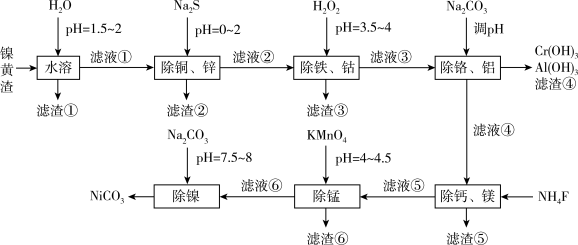
已知该工艺条件下,溶液中金属离子以氢氧化物形式开始沉淀和完全沉淀的pH如下表所示:
(已知:大多数金属离子的配位数等于它电荷数的两倍)
回答下列问题:
(1)已知实验温度下Ksp(ZnS)=2.1×10-25、Ksp (CuS)=6.3×10-35,“除铜、锌”时,当溶液中离子浓度小于1.0×10-5mol·L-1时,认为该离子已经沉淀完全,则滤液②中Cu2+的浓度不大于_______ (假设其他离子不反应)。
(2)“除铁、钴”时,H2O2可以将Co2+氧化为Co3+,由流程分析滤渣③成分是_______ 。
(3)“除铬、铝”时,理论上应调节溶液pH范围为_______ ,其中除去Al3+的离子方程式为_______ 。
(4)“除钙、镁”所得滤渣⑤在酸性条件下的溶解度增大的原因(从平衡移动的角度解释)_______ 。
(5)“除锰”时,Mn2+的氧化产物可用于实验室制备氯气,写出“除锰”反应的离子方程式:_______ 。
(6)“沉镍”时,控制终点pH=7.5~8,其主要目的是_______ 。碳酸镍可用于催化剂、电镀、陶瓷器着色等,它受热易分解,不溶于水,易溶于氨水或稀酸,写出碳酸镍溶于氨水的离子方程式:_______ 。

已知该工艺条件下,溶液中金属离子以氢氧化物形式开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Fe3+ | Fe2+ | Ni2+ | Co2+ | Co3+ | Al3+ | Cr3+ | Mn2+ |
| 开始沉淀pH | 1.9 | 7.0 | 8.1 | 7.6 | 0.56 | 4.0 | 4.3 | 7.8 |
| 完全沉淀pH | 3.2 | 9.0 | 9.5 | 9.2 | 1.1 | 5.2 | 5.4 | 10.4 |
回答下列问题:
(1)已知实验温度下Ksp(ZnS)=2.1×10-25、Ksp (CuS)=6.3×10-35,“除铜、锌”时,当溶液中离子浓度小于1.0×10-5mol·L-1时,认为该离子已经沉淀完全,则滤液②中Cu2+的浓度不大于
(2)“除铁、钴”时,H2O2可以将Co2+氧化为Co3+,由流程分析滤渣③成分是
(3)“除铬、铝”时,理论上应调节溶液pH范围为
(4)“除钙、镁”所得滤渣⑤在酸性条件下的溶解度增大的原因(从平衡移动的角度解释)
(5)“除锰”时,Mn2+的氧化产物可用于实验室制备氯气,写出“除锰”反应的离子方程式:
(6)“沉镍”时,控制终点pH=7.5~8,其主要目的是
您最近一年使用:0次
8 . 工业采用氯化铵焙烧菱锰矿制备碳酸锰的流程如下图所示:
已知:①菱锰矿的主要成分是MnCO3 ,其中含Fe、Ca、Mg、Al等元素。
②焙烧过程中主要反应为:MnCO3 +2NH4Cl MnCl2+2NH3↑ +CO2↑+ H2O。
MnCl2+2NH3↑ +CO2↑+ H2O。
③部分阳离子沉淀时溶液的pH的值:
(1)实验室“焙烧”操作盛放固体的仪器为____________________ 。
(2)结合图1、2、3,分析焙烧过程中对温度、NH4Cl用量[m(NH4Cl):m(锰矿粉)]、时间的最佳选择依次为________________ 、_______________ 、______________ 。

(3)对锰浸出液净化除杂时,先加入MnO2将Fe2+转化为Fe3+,再调节溶液pH的范围为_________________ ,将Fe3+和Al3+变为沉淀除去。然后加入NH4F将Ca2+、Mg2+变为氟化物沉淀除去。
(4)“碳化结晶”步骤中,加入碳酸氢铵是反应的离子方程式为________________ 。
(5)上述流程中可循环使用的物质是_______________ 。
(6)为测定产品中碳酸锰的含量,设计如下实验(杂质不参加反应):实验步骤为:称取16.80g试样,溶于适量的稀硫酸溶液中,向所得溶液中加入稍过量的磷酸和硝酸,加热使反应:2Mn2++NO3-+4PO43-+2H+ 2[Mn(PO4)2]3-+NO2-+H2O充分进行。除去溶液中存在的NO3-和NO2-后,加入l00.00mL2.00 mol·L-1的(NH4)2Fe(SO4)2溶液,发生的反应为:[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO3-;再用1.00mol·L-1酸性K2Cr2O7溶液滴定过量的Fe2+,滴定终点时消耗10.00mL酸性K2Cr2O7溶液。
2[Mn(PO4)2]3-+NO2-+H2O充分进行。除去溶液中存在的NO3-和NO2-后,加入l00.00mL2.00 mol·L-1的(NH4)2Fe(SO4)2溶液,发生的反应为:[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO3-;再用1.00mol·L-1酸性K2Cr2O7溶液滴定过量的Fe2+,滴定终点时消耗10.00mL酸性K2Cr2O7溶液。
①酸性K2Cr2O7溶液与Fe2+反应的离子方程式为_____________________ (还原产物是Cr3+)。
②产品中碳酸锰的质量分数为_____________ (结果保留3位有效数字)。

已知:①菱锰矿的主要成分是MnCO3 ,其中含Fe、Ca、Mg、Al等元素。
②焙烧过程中主要反应为:MnCO3 +2NH4Cl
 MnCl2+2NH3↑ +CO2↑+ H2O。
MnCl2+2NH3↑ +CO2↑+ H2O。③部分阳离子沉淀时溶液的pH的值:
| Al3- | Fe3+ | Ca2+ | Mn2+ | Mg2+ | |
| 开始沉淀的pH值 | 4.1 | 2.2 | 10.6 | 8.8 | 9.6 |
| 沉淀完全的pH值 | 4.7 | 3.2 | 13.1 | 10.1 | 11.1 |
(1)实验室“焙烧”操作盛放固体的仪器为
(2)结合图1、2、3,分析焙烧过程中对温度、NH4Cl用量[m(NH4Cl):m(锰矿粉)]、时间的最佳选择依次为

(3)对锰浸出液净化除杂时,先加入MnO2将Fe2+转化为Fe3+,再调节溶液pH的范围为
(4)“碳化结晶”步骤中,加入碳酸氢铵是反应的离子方程式为
(5)上述流程中可循环使用的物质是
(6)为测定产品中碳酸锰的含量,设计如下实验(杂质不参加反应):实验步骤为:称取16.80g试样,溶于适量的稀硫酸溶液中,向所得溶液中加入稍过量的磷酸和硝酸,加热使反应:2Mn2++NO3-+4PO43-+2H+
 2[Mn(PO4)2]3-+NO2-+H2O充分进行。除去溶液中存在的NO3-和NO2-后,加入l00.00mL2.00 mol·L-1的(NH4)2Fe(SO4)2溶液,发生的反应为:[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO3-;再用1.00mol·L-1酸性K2Cr2O7溶液滴定过量的Fe2+,滴定终点时消耗10.00mL酸性K2Cr2O7溶液。
2[Mn(PO4)2]3-+NO2-+H2O充分进行。除去溶液中存在的NO3-和NO2-后,加入l00.00mL2.00 mol·L-1的(NH4)2Fe(SO4)2溶液,发生的反应为:[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO3-;再用1.00mol·L-1酸性K2Cr2O7溶液滴定过量的Fe2+,滴定终点时消耗10.00mL酸性K2Cr2O7溶液。①酸性K2Cr2O7溶液与Fe2+反应的离子方程式为
②产品中碳酸锰的质量分数为
您最近一年使用:0次



