名校
解题方法
1 . 为探究FeCl3溶液中的离子平衡和离子反应,某小组同学进行了如下实验。
(1)用pH计测得某FeCl3溶液的pH=0.70,加入下列试剂,能使该FeCl3溶液pH升高的是_______ 。
a.水 b. FeCl3固体 c.浓盐酸 d. NaHCO3固体
蒸发FeCl3溶液并灼烧最终得到的固体产物是_______ 。
(2)利用上述FeCl3溶液探究其与镁粉的反应原理。实验操作及现象如下表:
①用离子方程式解释现象b:_______ 。
②取少量反应后的溶液,滴入2滴_______ (写化学式)溶液,出现蓝色沉淀即可证明有Fe2+生成。写出生成Fe2+的离子方程式:_______ 。
(3)镁和FeCl3溶液反应后溶液中 浓度的测定
浓度的测定
i.将反应瓶中的溶液过滤并调节溶液的pH在6.5~10.5;
ii.取20.00mL滤液加水稀释至100ml
iii.另取稀释后滤液20.00ml,加入K2CrO4溶液作指示剂,用c AgNO3标准溶液滴定滤液中的
AgNO3标准溶液滴定滤液中的 至终点,重复操作3次,平均消耗AgNO3溶液VmL。已知Ag+与
至终点,重复操作3次,平均消耗AgNO3溶液VmL。已知Ag+与 生成砖红色沉淀指示滴定终点。
生成砖红色沉淀指示滴定终点。
①滴定时,盛装AgNO3标准溶液的滴定管应选用_______ (填玻璃仪器名称)。
②计算原滤液中 浓度为
浓度为_______ (用代数式表示)。
(4)探究FeCl3溶液与Na2SO3溶液发生氧化还原反应
查阅资料可知,Na2SO3具有还原性,FeCl3具有氧化性,可以设计成原电池。用下图装置(a、b均为石墨电极)进行实验。闭合开关后灵敏电流计指针偏转,电极a附近溶液颜色变浅
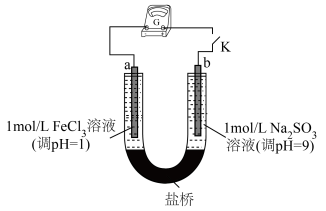
写出正极的电极反应式_______ 。一段时间后负极区pH_______ 9(填“<”、“=”、“>”)。
(1)用pH计测得某FeCl3溶液的pH=0.70,加入下列试剂,能使该FeCl3溶液pH升高的是
a.水 b. FeCl3固体 c.浓盐酸 d. NaHCO3固体
蒸发FeCl3溶液并灼烧最终得到的固体产物是
(2)利用上述FeCl3溶液探究其与镁粉的反应原理。实验操作及现象如下表:
| 操作 | 现象 |
| 先向反应瓶中注入50mL上述FeCl3溶液,再加入镁粉,搅拌。 | a.出现红褐色沉淀 b.有大量气泡 c.镁粉逐渐溶解、溶液变为浅绿色 |
②取少量反应后的溶液,滴入2滴
(3)镁和FeCl3溶液反应后溶液中
 浓度的测定
浓度的测定i.将反应瓶中的溶液过滤并调节溶液的pH在6.5~10.5;
ii.取20.00mL滤液加水稀释至100ml
iii.另取稀释后滤液20.00ml,加入K2CrO4溶液作指示剂,用c
 AgNO3标准溶液滴定滤液中的
AgNO3标准溶液滴定滤液中的 至终点,重复操作3次,平均消耗AgNO3溶液VmL。已知Ag+与
至终点,重复操作3次,平均消耗AgNO3溶液VmL。已知Ag+与 生成砖红色沉淀指示滴定终点。
生成砖红色沉淀指示滴定终点。①滴定时,盛装AgNO3标准溶液的滴定管应选用
②计算原滤液中
 浓度为
浓度为(4)探究FeCl3溶液与Na2SO3溶液发生氧化还原反应
查阅资料可知,Na2SO3具有还原性,FeCl3具有氧化性,可以设计成原电池。用下图装置(a、b均为石墨电极)进行实验。闭合开关后灵敏电流计指针偏转,电极a附近溶液颜色变浅

写出正极的电极反应式
您最近半年使用:0次
解题方法
2 . 氰化钠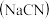 ,白色结晶颗粒或粉末,易潮解,应用于合成、电镀、冶金、药物等多个领域,是一种重要的基本化工原料.
,白色结晶颗粒或粉末,易潮解,应用于合成、电镀、冶金、药物等多个领域,是一种重要的基本化工原料.
 氰化钠中含有化学键的类型为
氰化钠中含有化学键的类型为______  碳的化合价为
碳的化合价为______ 价,据此推测,氰化钠中碳可能表现的性质是______  填序号
填序号 ;
;
 只具有氧化性
只具有氧化性  只具有还原性
只具有还原性  既有氧化性又有还原性
既有氧化性又有还原性
工业上生产氰化钠的方程式为: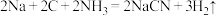 该反应的还原剂为:
该反应的还原剂为:______  填化学式
填化学式 ,当反应得到
,当反应得到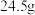 氰化钠时,转移电子数为
氰化钠时,转移电子数为______ ,同时产生标况下氢气______ L;
 氰化钠遇水时极易与水反应,产生一种具有挥发性的可燃物,最终所得溶液呈强碱性
氰化钠遇水时极易与水反应,产生一种具有挥发性的可燃物,最终所得溶液呈强碱性 强于同条件等浓度的碳酸氢钠溶液
强于同条件等浓度的碳酸氢钠溶液 ,写出相关的离子方程式
,写出相关的离子方程式______ ,溶液中各离子浓度由大到小的顺序为______  配制氰化钠溶液的方法是
配制氰化钠溶液的方法是______  填序号
填序号 ;
;
 在通风橱中,直接将其溶解于水
在通风橱中,直接将其溶解于水
 在通风橱中,先将其溶解于氢氧化钠溶液,再稀释到相应浓度
在通风橱中,先将其溶解于氢氧化钠溶液,再稀释到相应浓度
 在通风橱中,边通
在通风橱中,边通 边将其溶解于水
边将其溶解于水
 时向等体积
时向等体积 的氢氧化钠溶液和
的氢氧化钠溶液和 的氰化钠溶液中不断滴加同浓度的稀盐酸至
的氰化钠溶液中不断滴加同浓度的稀盐酸至 ,消耗盐酸的体积前者
,消耗盐酸的体积前者______ 后者 填“大于”、“等于”或“小于”
填“大于”、“等于”或“小于” ;
;
 氰化钠可以与很多金属形成络合物,因此工业上采用氰化法提炼金:用稀的氰化钠溶液处理粉碎了的金矿石,通入空气,使金矿石中的金粒溶解,生成能溶于水的络合物
氰化钠可以与很多金属形成络合物,因此工业上采用氰化法提炼金:用稀的氰化钠溶液处理粉碎了的金矿石,通入空气,使金矿石中的金粒溶解,生成能溶于水的络合物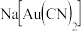 ,其反应方程式为:
,其反应方程式为: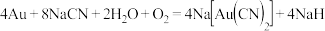 ,
,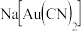 在水溶液中的电离方程式为:
在水溶液中的电离方程式为: 然后再用锌从溶液中把金置换出来,锌转化为
然后再用锌从溶液中把金置换出来,锌转化为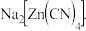 据此,请写出在空气中用氰化钠溶液提取金的电极反应式:正极:
据此,请写出在空气中用氰化钠溶液提取金的电极反应式:正极:______ ;负极:______ ;
 含氰化钠的废水可以在碱性条件下,加入
含氰化钠的废水可以在碱性条件下,加入 或通入
或通入
______  填常用试剂名称
填常用试剂名称 处理,使
处理,使 转变为无危害的气体.若人不慎氰化钠中毒,可用
转变为无危害的气体.若人不慎氰化钠中毒,可用 缓解,二者反应得到两种含硫元素的离子,其中一种遇到
缓解,二者反应得到两种含硫元素的离子,其中一种遇到 可变为血红色.写出解毒原理相关离子方程式
可变为血红色.写出解毒原理相关离子方程式______ .
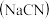 ,白色结晶颗粒或粉末,易潮解,应用于合成、电镀、冶金、药物等多个领域,是一种重要的基本化工原料.
,白色结晶颗粒或粉末,易潮解,应用于合成、电镀、冶金、药物等多个领域,是一种重要的基本化工原料. 氰化钠中含有化学键的类型为
氰化钠中含有化学键的类型为 碳的化合价为
碳的化合价为 填序号
填序号 ;
; 只具有氧化性
只具有氧化性  只具有还原性
只具有还原性  既有氧化性又有还原性
既有氧化性又有还原性工业上生产氰化钠的方程式为:
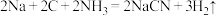 该反应的还原剂为:
该反应的还原剂为: 填化学式
填化学式 ,当反应得到
,当反应得到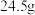 氰化钠时,转移电子数为
氰化钠时,转移电子数为 氰化钠遇水时极易与水反应,产生一种具有挥发性的可燃物,最终所得溶液呈强碱性
氰化钠遇水时极易与水反应,产生一种具有挥发性的可燃物,最终所得溶液呈强碱性 强于同条件等浓度的碳酸氢钠溶液
强于同条件等浓度的碳酸氢钠溶液 ,写出相关的离子方程式
,写出相关的离子方程式 配制氰化钠溶液的方法是
配制氰化钠溶液的方法是 填序号
填序号 ;
; 在通风橱中,直接将其溶解于水
在通风橱中,直接将其溶解于水 在通风橱中,先将其溶解于氢氧化钠溶液,再稀释到相应浓度
在通风橱中,先将其溶解于氢氧化钠溶液,再稀释到相应浓度 在通风橱中,边通
在通风橱中,边通 边将其溶解于水
边将其溶解于水 时向等体积
时向等体积 的氢氧化钠溶液和
的氢氧化钠溶液和 的氰化钠溶液中不断滴加同浓度的稀盐酸至
的氰化钠溶液中不断滴加同浓度的稀盐酸至 ,消耗盐酸的体积前者
,消耗盐酸的体积前者 填“大于”、“等于”或“小于”
填“大于”、“等于”或“小于” ;
; 氰化钠可以与很多金属形成络合物,因此工业上采用氰化法提炼金:用稀的氰化钠溶液处理粉碎了的金矿石,通入空气,使金矿石中的金粒溶解,生成能溶于水的络合物
氰化钠可以与很多金属形成络合物,因此工业上采用氰化法提炼金:用稀的氰化钠溶液处理粉碎了的金矿石,通入空气,使金矿石中的金粒溶解,生成能溶于水的络合物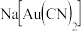 ,其反应方程式为:
,其反应方程式为: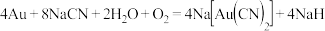 ,
,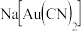 在水溶液中的电离方程式为:
在水溶液中的电离方程式为: 然后再用锌从溶液中把金置换出来,锌转化为
然后再用锌从溶液中把金置换出来,锌转化为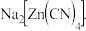 据此,请写出在空气中用氰化钠溶液提取金的电极反应式:正极:
据此,请写出在空气中用氰化钠溶液提取金的电极反应式:正极: 含氰化钠的废水可以在碱性条件下,加入
含氰化钠的废水可以在碱性条件下,加入 或通入
或通入
 填常用试剂名称
填常用试剂名称 处理,使
处理,使 转变为无危害的气体.若人不慎氰化钠中毒,可用
转变为无危害的气体.若人不慎氰化钠中毒,可用 缓解,二者反应得到两种含硫元素的离子,其中一种遇到
缓解,二者反应得到两种含硫元素的离子,其中一种遇到 可变为血红色.写出解毒原理相关离子方程式
可变为血红色.写出解毒原理相关离子方程式
您最近半年使用:0次
3 . 劳动最光荣。下列化学知识正确,且能解释所对应的劳动项目的是
| 选项 | 化学知识 | 劳动项目 |
| A | 乙醇具有强氧化性可以使细菌蛋白质变性 | 医疗服务:用75%的酒精溶液消毒 |
| B | 碳酸钠水解,溶液呈碱性 | 家务劳动:纯碱去油污 |
| C | 铝的化学性质很不活泼,所以耐腐蚀 | 工业生产:将铝制成饮料罐 |
| D | 石膏具有酸性 | 农业劳动:撒石膏改良碱性土壤(含碳酸钠) |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
解题方法
4 . 劳动创造美好生活。下列劳动项目与所述的化学知识有关联的是
| 选项 | 劳动项目 | 化学原理 |
| A | 洗涤餐具时可用热的纯碱溶液去油污 | 油脂在碱性条件下能发生水解反应 |
| B | 医生使用含微量硝酸银的滴眼液 | 硝酸根离子有强氧化性 |
| C | 面包师用小苏打作发泡剂烘焙面包 | Na2CO3可与酸反应 |
| D | 雕刻师用FeCl3溶液在铜板上刻出精美图案 | FeCl3溶液显酸性 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
5 . 某工厂以废旧电池正极材料为主要原料制取Li2CO3及Co(OH)2,其工艺流程如图所示(LiCoO2难溶于水及碱溶液,酸性条件下+3价的钴具有强氧化性)。
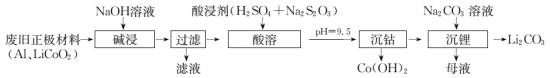
回答下列问题:
(1)要提高“碱浸”速率,可以采取的措施有______ 、______ (写两条)。“碱浸”时发生反应的方程式为_______ 。
(2)以2.00 mol∙L−1的H2SO4标准液滴定20.00mL“碱浸”所用的NaOH溶液,试剂a为指示剂,达到滴定终点时消耗15.00mLH2SO4标准液。
①2.00 mol∙L−1的H2SO4标准液中,c水(H+)=______ mol∙L−1。
②试剂a为_____ ,c(NaOH)=______ mol∙L−1。
(3)温度升高“滤液”碱性增强,其原因是______ 。
(4)某温度下,Co(OH)2、CoCO3达到溶解平衡的某悬浊液中,c(Co2+)=10−5 mol∙L−1,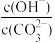 =
=______ {Ksp[Co(OH)2]=4×10−15,Ksp(CoCO3)=1×10−13}。

回答下列问题:
(1)要提高“碱浸”速率,可以采取的措施有
(2)以2.00 mol∙L−1的H2SO4标准液滴定20.00mL“碱浸”所用的NaOH溶液,试剂a为指示剂,达到滴定终点时消耗15.00mLH2SO4标准液。
①2.00 mol∙L−1的H2SO4标准液中,c水(H+)=
②试剂a为
(3)温度升高“滤液”碱性增强,其原因是
(4)某温度下,Co(OH)2、CoCO3达到溶解平衡的某悬浊液中,c(Co2+)=10−5 mol∙L−1,
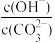 =
=
您最近半年使用:0次
解题方法
6 . 劳动创造幸福未来。下列劳动项目与所述的化学知识关联不合理的是
| 选项 | 劳动项目 | 化学知识 |
| A | 社会实践:向公共场所喷洒过氧乙酸消毒剂 | 过氧乙酸有强氧化性,能使蛋白质变性 |
| B | 社区服务:演示用泡沫灭火器灭火 | 盐酸与小苏打反应产生大量二氧化碳 |
| C | 自主探究:锌、铜和柠檬为原料制作水果电池 | 锌能与柠檬中酸性物质发生氧化还原反应 |
| D | 家务劳动:饭后用热的纯碱溶液洗涤餐具 | 油脂在碱性条件下发生水解 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2023-02-05更新
|
433次组卷
|
3卷引用:陕西省渭南市2023届高三第一次教学质量检测(一模)化学试题
解题方法
7 . 某实验小组通过以下实验,探究镀件表面镀铜的最佳条件。回答下列问题:
【查阅资料】①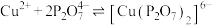
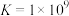 ;
;
② 在溶液中不稳定,容易发生歧化。
在溶液中不稳定,容易发生歧化。
【实验设计】用 、
、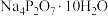 (焦磷酸钠)、添加剂配制一定浓度的电镀液,分别用纯铜和镀件作为两极材料,探究电镀液的pH、电流密度、电极板间距对镀层的影响。
(焦磷酸钠)、添加剂配制一定浓度的电镀液,分别用纯铜和镀件作为两极材料,探究电镀液的pH、电流密度、电极板间距对镀层的影响。
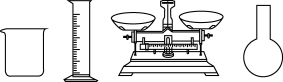
(1)要配制一定体积40 g/L的CuSO4溶液,以下仪器不需要用到的是___________ (填仪器名称)。
(2)镀件表面的油污可用热的纯碱溶液清洗,原因是___________ (填离子方程式)。
(3)电镀时阴极上发生的主要反应的电极反应式为___________ 。
【实验结果与数据分析】
i.其他条件不变时,电镀10 min,pH对电镀的影响如下表:
(4)实验3中,铜镀层的沉积速率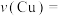
___________ mol/min(保留两位有效数字)。
(5)实验1和实验4中,酸性或碱性较强时,镀层出现斑驳的可能原因是___________ 。
ii.电流密度、电极板间距与镀膜质量的关系如图所示:
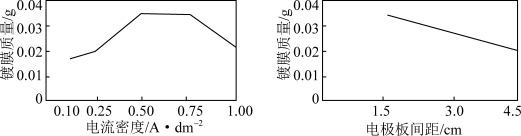
(6)电流密度小于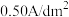 时,镀膜质量随电流密度增大而增大的原因是
时,镀膜质量随电流密度增大而增大的原因是___________ 。
(7)本实验电镀的最佳条件是pH为8.5、电流密度为___________ 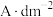 、电极板间距为
、电极板间距为___________ cm。
(8)使用最佳条件电镀时,在阳极附近的电镀液中出现红色固体沉积物,其可能原因是___________ (填离子方程式),通空气搅拌可防止红色固体沉积物形成。
【查阅资料】①
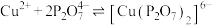
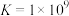 ;
;②
 在溶液中不稳定,容易发生歧化。
在溶液中不稳定,容易发生歧化。【实验设计】用
 、
、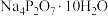 (焦磷酸钠)、添加剂配制一定浓度的电镀液,分别用纯铜和镀件作为两极材料,探究电镀液的pH、电流密度、电极板间距对镀层的影响。
(焦磷酸钠)、添加剂配制一定浓度的电镀液,分别用纯铜和镀件作为两极材料,探究电镀液的pH、电流密度、电极板间距对镀层的影响。(1)要配制一定体积40 g/L的CuSO4溶液,以下仪器不需要用到的是

(2)镀件表面的油污可用热的纯碱溶液清洗,原因是
(3)电镀时阴极上发生的主要反应的电极反应式为
【实验结果与数据分析】
i.其他条件不变时,电镀10 min,pH对电镀的影响如下表:
| 实验序号 | pH值 | 镀膜质量/g | 镀层外观 |
| 1 | 3 | 0.0136 | 表面斑驳 |
| 2 | 7 | 0.0258 | 光亮,不光滑 |
| 3 | 8.5 | 0.0356 | 光亮,光滑 |
| 4 | 10 | 0.0216 | 表面部分斑驳 |
(4)实验3中,铜镀层的沉积速率
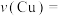
(5)实验1和实验4中,酸性或碱性较强时,镀层出现斑驳的可能原因是
ii.电流密度、电极板间距与镀膜质量的关系如图所示:

(6)电流密度小于
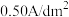 时,镀膜质量随电流密度增大而增大的原因是
时,镀膜质量随电流密度增大而增大的原因是(7)本实验电镀的最佳条件是pH为8.5、电流密度为
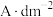 、电极板间距为
、电极板间距为(8)使用最佳条件电镀时,在阳极附近的电镀液中出现红色固体沉积物,其可能原因是
您最近半年使用:0次
解题方法
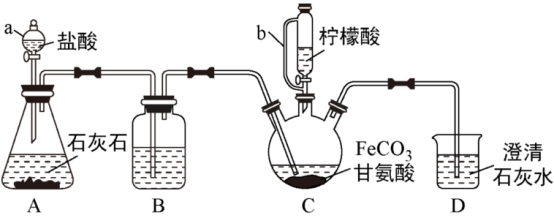
8 . 甘氨酸亚铁[ ]是新一代畜禽饲料补铁添加剂。某实验小组以碳酸亚铁和甘氨酸反应制备甘氨酸亚铁的装置如下(夹持和加热仪器略去):
]是新一代畜禽饲料补铁添加剂。某实验小组以碳酸亚铁和甘氨酸反应制备甘氨酸亚铁的装置如下(夹持和加热仪器略去):
查阅资料:
①反应原理为:
②甘氨酸易溶于水,微溶于乙醇:甘氨酸亚铁易溶于水,难溶于乙醇。
③柠檬酸易溶于水和乙醇,具有较强的还原性和酸性。
回答下列问题:
(1)仪器b的名称为___________ ,与a相比,其优点是___________ 。
(2)装置B中盛有的试剂为___________ 。
(3)实验中先打开a的活塞,当观察到___________ 时,再加热装置C,同时打开b的旋塞,向C中滴加柠檬酸。
(4)柠檬酸的作用是①___________ ,②___________ 。
(5)反应结束后过滤,取滤液,___________ ,过滤、洗涤、干燥得产品。
(6)装置C中盛有 和
和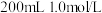 的甘氨酸溶液,最终干燥后得15.3g固体,其产率是
的甘氨酸溶液,最终干燥后得15.3g固体,其产率是___________ 。
 ]是新一代畜禽饲料补铁添加剂。某实验小组以碳酸亚铁和甘氨酸反应制备甘氨酸亚铁的装置如下(夹持和加热仪器略去):
]是新一代畜禽饲料补铁添加剂。某实验小组以碳酸亚铁和甘氨酸反应制备甘氨酸亚铁的装置如下(夹持和加热仪器略去):
查阅资料:
①反应原理为:

②甘氨酸易溶于水,微溶于乙醇:甘氨酸亚铁易溶于水,难溶于乙醇。
③柠檬酸易溶于水和乙醇,具有较强的还原性和酸性。
回答下列问题:
(1)仪器b的名称为
(2)装置B中盛有的试剂为
(3)实验中先打开a的活塞,当观察到
(4)柠檬酸的作用是①
(5)反应结束后过滤,取滤液,
(6)装置C中盛有
 和
和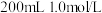 的甘氨酸溶液,最终干燥后得15.3g固体,其产率是
的甘氨酸溶液,最终干燥后得15.3g固体,其产率是
您最近半年使用:0次
9 . 某实验小组通过以下实验,探究镀件表面镀铜的最佳条件。
【查阅资料】①Cu2++2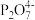
 [Cu(P2O7)2]6-K=1×109
[Cu(P2O7)2]6-K=1×109
②Cu+在溶液中不稳定,容易发生歧化。
【实验设计】用CuSO4·5H2O、Na4P2O7·10H2O(焦磷酸钠)、添加剂配制一定浓度的电镀液,分别用纯铜和镀件作为两极材料,探究电镀液的pH、电流密度、电极板间距对层的影响。
(1)要配制一定体积40g/L的CuSO4溶液,以下仪器不需要用到的是_______ (填仪器名称)。
(2)镀件表面的油污可用_______ 清洗。
(3)电镀时阴极上发生的主要反应的电极反应式为_______ 。
【实验结果与数据分析】
ⅰ.其他条件不变时,电位10min,pH对电镀的影响如下表:
(4)实验3中,铜镀层的沉积速率v(Cu)=_______ mol/min(保留两位有效数字)。
(5)实验1和实验4中,酸性或碱性较强时,镀层出现斑驳的可能原因是_______ 。
ⅱ.电流密度、电极板间距与镀膜质量的关系

(6)电流密度小于0.50A/dm2时镀膜质量随电流密度增大而增大的原因是_______ 。
(7)本实验电镀的最佳条件是pH为8.5、_______ 、_______ 。
(8)使用最佳条件电镀时,在阳极附近的电镀液中出现红色固体沉积物,其可能原因用离子方程式表示为_______ ,通空气搅拌可防止红色固体沉积物形成。
【查阅资料】①Cu2++2
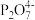
 [Cu(P2O7)2]6-K=1×109
[Cu(P2O7)2]6-K=1×109②Cu+在溶液中不稳定,容易发生歧化。
【实验设计】用CuSO4·5H2O、Na4P2O7·10H2O(焦磷酸钠)、添加剂配制一定浓度的电镀液,分别用纯铜和镀件作为两极材料,探究电镀液的pH、电流密度、电极板间距对层的影响。
(1)要配制一定体积40g/L的CuSO4溶液,以下仪器不需要用到的是

(2)镀件表面的油污可用
(3)电镀时阴极上发生的主要反应的电极反应式为
【实验结果与数据分析】
ⅰ.其他条件不变时,电位10min,pH对电镀的影响如下表:
| 实验信号 | pH值 | 镀膜质量/g | 镀层外观 |
| 1 | 3 | 0.0136 | 表面斑驳 |
| 2 | 7 | 0.0258 | 光亮,不光滑 |
| 3 | 8.5 | 0.0356 | 光亮,光滑 |
| 4 | 10 | 0.0216 | 表面部分斑驳 |
(5)实验1和实验4中,酸性或碱性较强时,镀层出现斑驳的可能原因是
ⅱ.电流密度、电极板间距与镀膜质量的关系

(6)电流密度小于0.50A/dm2时镀膜质量随电流密度增大而增大的原因是
(7)本实验电镀的最佳条件是pH为8.5、
(8)使用最佳条件电镀时,在阳极附近的电镀液中出现红色固体沉积物,其可能原因用离子方程式表示为
您最近半年使用:0次
解题方法
10 . 某工业废玻璃粉末含SiO2、Fe2O3、CeO2、FeO等。某课题小组设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵矾。
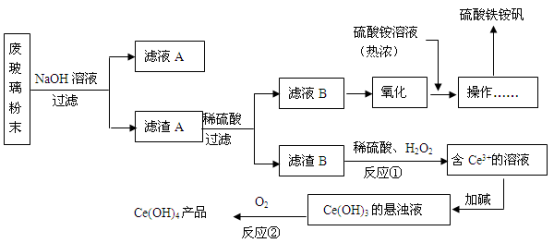
已知:CeO2不溶于稀硫酸;酸性条件下,Ce3+易水解,Ce4+有较强氧化性。
(1)硫酸铁铵矾可净水,其原理是(写离子方程式)________________________________ 。
(2)滤液A的主要成分_______________ (填写化学式)。
(3)反应①的离子方程式是_____________________________ 。
(4)反应②的化学反应方程式是__________________________ 。
(5)已知制硫酸铁铵矾晶体[Fe2(SO4) 3·(NH4) 2SO4·24H2O,式量964]的产率为80%,若加入13.2g (NH4) 2SO4(式量132),可制得晶体的质量是_________ 。
(6)化合物HT可作为萃取剂能将铈离子从水溶液中萃取出来,过程表示为:
Ce2(SO4)3(水层)+ 6HT(有机层) 2CeT3 (有机层)+3H2SO4(水层)
2CeT3 (有机层)+3H2SO4(水层)
分液得到CeT3(有机层),再加入H2SO4 获得较纯的含Ce3+的水溶液。可选择硫酸作反萃取剂的原因是___ (从平衡移动角度回答)。

已知:CeO2不溶于稀硫酸;酸性条件下,Ce3+易水解,Ce4+有较强氧化性。
(1)硫酸铁铵矾可净水,其原理是(写离子方程式)
(2)滤液A的主要成分
(3)反应①的离子方程式是
(4)反应②的化学反应方程式是
(5)已知制硫酸铁铵矾晶体[Fe2(SO4) 3·(NH4) 2SO4·24H2O,式量964]的产率为80%,若加入13.2g (NH4) 2SO4(式量132),可制得晶体的质量是
(6)化合物HT可作为萃取剂能将铈离子从水溶液中萃取出来,过程表示为:
Ce2(SO4)3(水层)+ 6HT(有机层)
 2CeT3 (有机层)+3H2SO4(水层)
2CeT3 (有机层)+3H2SO4(水层)分液得到CeT3(有机层),再加入H2SO4 获得较纯的含Ce3+的水溶液。可选择硫酸作反萃取剂的原因是
您最近半年使用:0次
2016-12-08更新
|
581次组卷
|
4卷引用:2015届广东湛江高三第二次模拟考试理综化学试卷
2015届广东湛江高三第二次模拟考试理综化学试卷2015届广东省湛江市高三普通高考测试(二)理综化学试卷2020届高三化学大二轮增分强化练—— 化学工艺流程题(已下线)专题七 工艺流程题(提分特训)-2020年高考二轮模块化复习之《元素化合物》名师讲案与提分特训



