名校
1 . 某温度下,Ksp(MnS)=2×10-13,Ksp(PbS)=2×10-28,生产中用MnS作为沉淀剂除去工业废水中Pb2+,其反应原理为Pb2+(aq)+MnS(s) PbS(s)+Mn2+(aq)。下列说法正确的是
PbS(s)+Mn2+(aq)。下列说法正确的是
 PbS(s)+Mn2+(aq)。下列说法正确的是
PbS(s)+Mn2+(aq)。下列说法正确的是| A.该反应的平衡常数K=1015 |
| B.PbS悬浊液中:c(Pb2+)=1×10-14mol•L-1 |
| C.该反应达平衡时c(Mn2+)=c(Pb2+) |
| D.其他条件不变,使平衡体系中c(Mn2+)增大,则c(Pb2+)减小 |
您最近一年使用:0次
2023-05-11更新
|
328次组卷
|
5卷引用:山西省朔州市怀仁一中2023-2024学年高二上学期12月期中考试化学试题
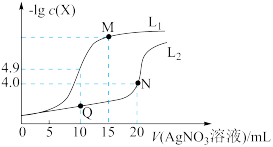
2 . t℃时,将0.1 mol·L-1AgNO3溶液分别滴加到10. 00 mL0.1 mol·L-1KCl、10.00 ml0.1 mol· L-1K2CrO4溶液中,AgNO3溶液体积(V)与-lg c(X)(X为Cl-或 )的变化关系如图所示(忽略溶液体积变化)。下列说法正确的是
)的变化关系如图所示(忽略溶液体积变化)。下列说法正确的是
 )的变化关系如图所示(忽略溶液体积变化)。下列说法正确的是
)的变化关系如图所示(忽略溶液体积变化)。下列说法正确的是
| A.曲线L2表示-lg c(Cl-)与V(AgNO3溶液)的变化关系 |
| B.t℃时,铬酸银的溶度积常数为4.0 ×10-12 |
| C.若仅将c(K2CrO4)改为0.05 mol·L-1,则曲线L2中N点移到Q点 |
D.M点溶液中:c( )>c(K+ )>c(Ag+ )>c(OH- )>c(H+ ) )>c(K+ )>c(Ag+ )>c(OH- )>c(H+ ) |
您最近一年使用:0次
2022-08-10更新
|
147次组卷
|
2卷引用:山西省怀仁市第一中学2021-2022学年高二上学期期中理科综合化学试题
名校
解题方法
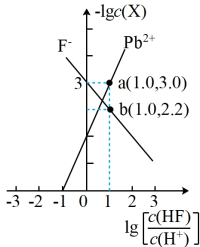
3 . 已知PbF2属于难溶于水、可溶于酸的盐。常温下,用HCl调节PbF2浊液的pH,测得在不同pH条件下,体系中-lgc(X)(X为Pb2+或F-)与lg[ ]的关系如图所示。下列说法正确的是
]的关系如图所示。下列说法正确的是
 ]的关系如图所示。下列说法正确的是
]的关系如图所示。下列说法正确的是
| A.Ksp(PbF2)的数量级为10-7 |
| B.Ka(HF)的数量级为10-3 |
| C.向PbF2浊液中加入NaF固体,lgc(Pb2+)增大 |
| D.a点溶液中:c(H+)+2c(Pb2+)<c(F-)+c(HF)+c(Cl-)(不考虑水的电离因素) |
您最近一年使用:0次
2022-07-12更新
|
343次组卷
|
2卷引用:山西省阳泉市第一中学校2022-2023学年高三上学期11月期中考试化学试题
名校
4 . 用0.100mol/LAgNO3溶液滴定50.0mL0.0500mol/LNaCl溶液的滴定曲线如图所示。下列有关描述错误的是
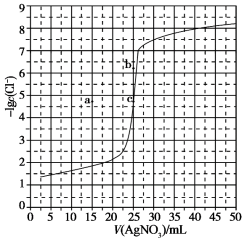

| A.曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=Ksp(AgCl) |
| B.根据曲线数据计算可知Ksp(AgCl)的数量级为10-10 |
| C.相同实验条件下,若改为0.0500mol/LNaBr溶液,反应终点c向b方向移动 |
| D.相同实验条件下,若改为0.0400mol/LNaCl溶液,反应终点c移到a |
您最近一年使用:0次
名校
5 . 某温度下,难溶物FeR的水溶液中存在平衡FeR(s)⇌Fe2+(aq)+R2-(aq),其沉淀溶解平衡曲线如图所示。下列说法不正确的是
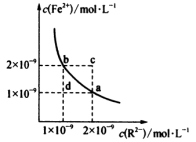

| A.该温度下,Ksp(FeR)=2×10-18 | B.c点可能有沉淀生成 |
| C.b点对应的K sp大于a点对应的K sp | D.加入FeSO4可实现由a点变到b点 |
您最近一年使用:0次
2021-01-24更新
|
500次组卷
|
5卷引用:山西省运城市康杰中学2021-2022学年高二上学期期中化学试题
山西省运城市康杰中学2021-2022学年高二上学期期中化学试题河南省顶尖名校联盟2020-2021学年高二12月联考化学试题(已下线)专题11 水溶液中的离子平衡-备战2021届高考化学二轮复习题型专练(已下线)专题27 难溶电解质的溶解平衡(限时精炼)-2022年高三毕业班化学常考点归纳与变式演练天津市滨海新区田家炳中学2023-2024学年高二上学期第二次月考化学试题
名校
解题方法
6 . 已知25℃时,AgCl的溶度积Ksp=1.8×10-10 mol2·L-2,则下列说法正确的是
| A.向饱和AgCl水溶液中加入盐酸, Ksp变大 |
| B.AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-) |
| C.温度一定时,当溶液中c(Ag+)·c(Cl-)=Ksp时,此溶液中必有AgCl沉淀析出 |
| D.在AgCl的悬浊液中加入Na2S溶液,AgCl转化为Ag2S,因为AgCl溶度积大于Ag2S |
您最近一年使用:0次
7 . 向少量Mg(OH)2悬浊液中加入适量的饱和NH4Cl溶液,结果固体完全溶解。对此甲、乙两同学各自作了自己的解释:
甲:Mg(OH)2(s) Mg2++2OH-①,NH4++H2O
Mg2++2OH-①,NH4++H2O NH3·H2O+H+②,H++OH-=H2O③,由于③反应的发生,使平衡①右移,Mg(OH)2溶解。
NH3·H2O+H+②,H++OH-=H2O③,由于③反应的发生,使平衡①右移,Mg(OH)2溶解。
乙:Mg(OH)2(s) Mg2++2OH-①,NH4++ OH-
Mg2++2OH-①,NH4++ OH- NH3·H2O②,由于②反应的发生,使平衡①右移,沉淀溶解。
NH3·H2O②,由于②反应的发生,使平衡①右移,沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是用下面的一种试剂重做了该实验,证明甲、乙的解释只有一种正确。他用的试剂是________ 。
A.NH4NO3B.CH3COONH4C.(NH4)2SO4D.氨水
(2)丙同学将所选试剂滴入Mg(OH)2的浊液中,Mg(OH)2溶解;由此推知,甲和乙哪位同学的解释更合理____ (填“甲”或“乙”);完成NH4Cl饱和溶液使Mg(OH)2悬浊溶解的离子方程式______ 。
甲:Mg(OH)2(s)
 Mg2++2OH-①,NH4++H2O
Mg2++2OH-①,NH4++H2O NH3·H2O+H+②,H++OH-=H2O③,由于③反应的发生,使平衡①右移,Mg(OH)2溶解。
NH3·H2O+H+②,H++OH-=H2O③,由于③反应的发生,使平衡①右移,Mg(OH)2溶解。乙:Mg(OH)2(s)
 Mg2++2OH-①,NH4++ OH-
Mg2++2OH-①,NH4++ OH- NH3·H2O②,由于②反应的发生,使平衡①右移,沉淀溶解。
NH3·H2O②,由于②反应的发生,使平衡①右移,沉淀溶解。(1)丙同学不能肯定哪位同学的解释合理,于是用下面的一种试剂重做了该实验,证明甲、乙的解释只有一种正确。他用的试剂是
A.NH4NO3B.CH3COONH4C.(NH4)2SO4D.氨水
(2)丙同学将所选试剂滴入Mg(OH)2的浊液中,Mg(OH)2溶解;由此推知,甲和乙哪位同学的解释更合理
您最近一年使用:0次
8 . 如图是碳酸钙(CaCO3)在25 ℃和100 ℃两种情况下,在水中的沉淀溶解平衡曲线。下列有关说法正确的是( )
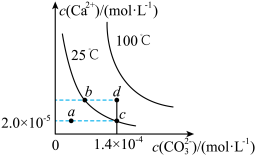

A.CaCO3(s) Ca2+(aq)+CO32—(aq) ΔH<0 Ca2+(aq)+CO32—(aq) ΔH<0 |
| B.a、b、c、d四点对应的溶度积Ksp相等 |
| C.25 ℃时CaCO3的Ksp=2.8×10-9 |
| D.温度不变,挥发水分,可使溶液由a点变到c点 |
您最近一年使用:0次
2019-12-07更新
|
219次组卷
|
11卷引用:山西省康杰中学2017-2018学年高二上学期期中考试化学试题
山西省康杰中学2017-2018学年高二上学期期中考试化学试题【全国百强校】黑龙江省哈尔滨市第六中学2018-2019学年高二上学期期中考试化学试题黑龙江省鹤岗市第一中学2019-2020学年高二上学期期中考试化学试题重庆市凤鸣山中学2018-2019学年高二上学期期中考试化学试题山西省吕梁市2020-2021学年高二上学期期末考试化学试题(已下线)2017-2018学年上学期期末复习备考之精准复习模拟题高二化学选修4(B卷)(已下线)解密13 沉淀溶解平衡——备战2018年高考化学之高频考点解密(已下线)2019年4月12日 《每日一题》三轮复习——难溶电解质溶解平衡苏教版选修四化学反应原理专题3第四单元 难溶电解质的沉淀溶解平衡 同步检测试卷江西省萍乡市莲花中学2019-2020高一下学期3月特色班月考化学试题新疆伊犁新源县2021-2022学年高二上学期期末考试化学试题
名校
9 . 下列关于难溶电解质溶解平衡的说法正确的是
| A.可直接根据Ksp的数值大小比较难溶电解质在水中的溶解度大小 |
| B.在AgCl的饱和溶液中,加入蒸馏水,Ksp(AgCl)不变 |
| C.难溶电解质的溶解平衡过程是可逆的,且在平衡状态时,v溶解=v沉淀=0 |
| D.25℃时,Ksp(AgCl)>Ksp(AgI),向 AgCl 的饱和溶液中加入少量KI固体,一定有黄色沉淀 |
您最近一年使用:0次
2019-03-20更新
|
574次组卷
|
6卷引用:山西省吕梁市岚县中学2019—2020学年高二上学期期末考试化学试题(实验班、重点班)
名校
10 . 已知:pAg=-lgc(Ag+),Ksp(AgCl)=1×10-12,Ksp (AgI)=1×10-16。如图是向10mLAgNO3溶液中逐滴滴入0.1mol·L-1的NaCl溶液时,pAg随着加入NaCl溶液的体积变化的图象(实线)。下列叙述正确的是
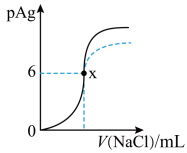

| A.原AgNO3溶液的物质的量浓度为0.1mol·L-1 |
| B.图中x点表示溶液中Ag+已经完全沉淀 |
| C.图中x点的坐标为(10,6) |
| D.若把NaCl溶液换成0.1mol·L-1NaI溶液,则图象在终点后变为虚线部分 |
您最近一年使用:0次
2019-02-14更新
|
943次组卷
|
9卷引用:山西省长治市第二中学2019-2020学年高二上学期期中考试化学试题
山西省长治市第二中学2019-2020学年高二上学期期中考试化学试题福建省福州市第八中学2016-2017学年高二下学期期末考试(理)化学试题【市级联考】福建省泉州市2019届高三上学期单科质量检查化学试题【全国百强校】黑龙江省鹤岗市第一中学2018-2019学年高二下学期第一次月考(开学)化学试题河北省武邑中学2019-2020学年高二12月月考化学试题西藏自治区昌都市第一高级中学2020届高三下学期第一次模拟考试理综化学试题(已下线)福建省霞浦第一中学2018-2019学年高二下学期第一次月考化学试题(B卷)(已下线)小题必刷34 沉淀溶解平衡、溶度积常数及其应用——2021年高考化学一轮复习小题必刷(通用版本)甘肃省兰州市2019届高三二诊理综化学试题



