名校
解题方法
1 . 三氯氧磷(POCl3)可用作半导体掺杂剂及光导纤维原料,是能推进中国半导体产业链发展壮大的一种重要的化工原料。工业上可以直接氧化 PCl3 制备 POCl3,反应原理为:P4(白磷)+6Cl2 4PCl3,2PCl3+O2
4PCl3,2PCl3+O2 2POCl3。
2POCl3。
已知:PCl3、POCl3的部分性质如下:
某化学兴趣小组模拟该工艺设计实验装置如图(某些夹持装置和加热装置已略去):
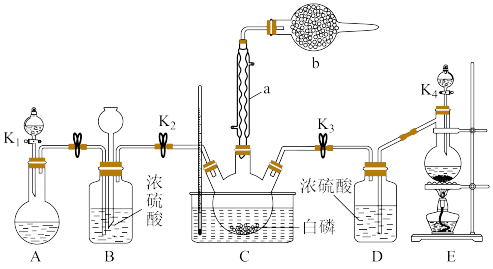
(1)检查装置气密性并加入纯净的白磷,先制取一种气体,缓慢地通入C中,直至C中的白磷完全消失后,再通入另一种气体。仪器b的名称为___________ ,B装置的作用是___________ 。
(2)装置 E 反应的离子方程式为___________ 。
(3)C反应温度控制 60~65 ℃,不能过高或过低的原因是___________ 。分离提纯获得 POCl3 的实验方法是___________ 。
(4)通过测定三氯氧磷产品中(含PCl3 杂质)氯元素含量,可进一步计算产品的纯度,实验步骤如下:
①取a g产品置于盛50.00 mL 蒸馏水的水解瓶中,摇动至完全水解,将水解液配成 100.00 mL 溶液,预处理排除含磷粒子的影响。
②取10.00 mL溶液于锥形瓶中,向其中加入c0 mol/L-1的AgNO3溶液V0 mL,使Cl-完全沉淀,再加入20 mL硝基苯,振荡,使沉淀表面被有机物覆盖;然后选择Fe(NO3)3 指示剂,用c1 mol/L-1 NH4SCN 溶液滴定过量Ag+ 至终点,记下所用体积为V1 mL。
滴定终点的现象:___________ 。实验过程中加入硝基苯覆盖沉淀的目的是___________ ,若无此操作,则所测POCl3的含量将___________ (填“偏高”“偏低”或“不变”)。[已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2.0×10-12]
(5)产品中POCl3的质量分数为___________ 。
 4PCl3,2PCl3+O2
4PCl3,2PCl3+O2 2POCl3。
2POCl3。已知:PCl3、POCl3的部分性质如下:
| 物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其它 |
| PCl3 | -112 | 75.5 | 137.5 | 遇水生成H3PO3和HCl |
| POCl3 | 2 | 105.3 | 153.5 | 遇水生成H3PO4和HCl |

(1)检查装置气密性并加入纯净的白磷,先制取一种气体,缓慢地通入C中,直至C中的白磷完全消失后,再通入另一种气体。仪器b的名称为
(2)装置 E 反应的离子方程式为
(3)C反应温度控制 60~65 ℃,不能过高或过低的原因是
(4)通过测定三氯氧磷产品中(含PCl3 杂质)氯元素含量,可进一步计算产品的纯度,实验步骤如下:
①取a g产品置于盛50.00 mL 蒸馏水的水解瓶中,摇动至完全水解,将水解液配成 100.00 mL 溶液,预处理排除含磷粒子的影响。
②取10.00 mL溶液于锥形瓶中,向其中加入c0 mol/L-1的AgNO3溶液V0 mL,使Cl-完全沉淀,再加入20 mL硝基苯,振荡,使沉淀表面被有机物覆盖;然后选择Fe(NO3)3 指示剂,用c1 mol/L-1 NH4SCN 溶液滴定过量Ag+ 至终点,记下所用体积为V1 mL。
滴定终点的现象:
(5)产品中POCl3的质量分数为
您最近一年使用:0次
2 . 钼及其化合物正越来越多的受到人们的关注 ,其中钼酸钠(Na2MoO4)可溶于水,是一种重要的金属缓蚀剂;钼酸钙(CaMoO4)微溶于水,常用作钼合金添加剂;钼酸属于弱酸,微溶于水,常用于制取高纯同多酸盐。工业上利用辉钼矿(主要成分为MoS2)制备金属钼和钼酸钠晶体的流程如图所示。
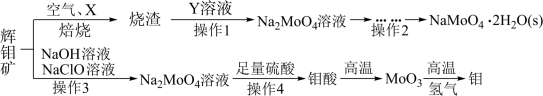
回答下列问题:
(1)辉钼矿在空气中焙烧时,加入X是为了减少空气污染,焙烧后Mo元素以CaMoO4存在,则X是________ ;焙烧时发生反应的化学方程式为__________ 。
(2)已知25℃时,钼酸钙的Ksp=1.6×10-5,则钼酸钙在该温度下的溶解度为_______ g/100g水,但钼酸钙实际溶解度比计算值大许多,其原因是_______ ,操作2中得到的钼酸钠晶体中常混有Y,进一步提纯钼酸钠晶体的方法为__________ 。
(3)辉钼矿中MoS2含量测定:取辉钼矿0.2500g,经在空气中焙烧、操作1、操作2得到钼酸钠晶体0.1210g(Mr=242g/mol),辉钼矿中MoS2的质量分数不低于______ %。
(4)操作3发生反应的离子方程式为_________________ 。
(5)用镍、钼作电极电解浓NaOH溶液制备钼酸钠(Na2MoO4)的装置如下图所示。b电极的材料为______ (填“镍”或“钼”),电极反应为___________ 。


回答下列问题:
(1)辉钼矿在空气中焙烧时,加入X是为了减少空气污染,焙烧后Mo元素以CaMoO4存在,则X是
(2)已知25℃时,钼酸钙的Ksp=1.6×10-5,则钼酸钙在该温度下的溶解度为
(3)辉钼矿中MoS2含量测定:取辉钼矿0.2500g,经在空气中焙烧、操作1、操作2得到钼酸钠晶体0.1210g(Mr=242g/mol),辉钼矿中MoS2的质量分数不低于
(4)操作3发生反应的离子方程式为
(5)用镍、钼作电极电解浓NaOH溶液制备钼酸钠(Na2MoO4)的装置如下图所示。b电极的材料为

您最近一年使用:0次
名校
3 . 无水氯化锰 在电子技术和精细化工领域有重要应用。一种由粗锰粉(主要杂质为Fe、Ni、Pb等金属单质)制备无水氯化锰的工艺如下(部分操作和条件略)。
在电子技术和精细化工领域有重要应用。一种由粗锰粉(主要杂质为Fe、Ni、Pb等金属单质)制备无水氯化锰的工艺如下(部分操作和条件略)。
I.向粗锰粉中加入盐酸,控制溶液的pH约为5,测定离子的初始浓度。静置一段时间后锰粉仍略有剩余,过滤;
II.向I的滤液中加入一定量盐酸,再加入 溶液,充分反应后加入
溶液,充分反应后加入 固体调节溶液的pH约为5,过滤;
固体调节溶液的pH约为5,过滤;
III.向II的滤液中通入 气体,待充分反应后加热一段时间,冷却后过滤;
气体,待充分反应后加热一段时间,冷却后过滤;
IV.浓缩、结晶、过滤、洗涤、脱水得到无水MnCl2。
各步骤中对杂质离子的去除情况
已知:金属活动性Mn>Fe>Ni>Pb
(1)锰和盐酸反应的化学方程式是_______ 。
(2)步骤I中:
①Fe2+浓度降低,滤渣中存在 。结合离子方程式解释原因:
。结合离子方程式解释原因:_______ 。
②Pb2+浓度降低,分析步骤I中发生的反应为:Pb + 2H+ = Pb2+ + H2↑、______ 。
(3)步骤II中:
① 酸性溶液的作用:
酸性溶液的作用:_______ 。
②结合离子方程式说明MnCO3的作用:_______ 。
(4)步骤III通入H2S后, Ni2+不达标而 达标。推测溶解度:PbS
达标。推测溶解度:PbS_____ NiS(填“>”或“<”)。
(5)测定无水 的含量:将a g 样品溶于一定量硫酸和磷酸的混合溶液中,加入稍过量
的含量:将a g 样品溶于一定量硫酸和磷酸的混合溶液中,加入稍过量 ,使
,使 氧化为
氧化为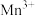 。待充分反应后持续加热一段时间,冷却后用b mol/L硫酸亚铁铵
。待充分反应后持续加热一段时间,冷却后用b mol/L硫酸亚铁铵 滴定
滴定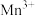 ,消耗c mL 硫酸亚铁铵。(已知:滴定过程中发生的反应为:Fe2+ + Mn3+ = Fe3+ + Mn2+)
,消耗c mL 硫酸亚铁铵。(已知:滴定过程中发生的反应为:Fe2+ + Mn3+ = Fe3+ + Mn2+)
①样品中MnCl2的质量分数是_____ (已知:MnCl2的摩尔质量是126 g·mol-1)。
②“持续加热”的目的是使过量的 分解。若不加热,测定结果会
分解。若不加热,测定结果会______ (填“偏高”、“偏低”或“无影响”)。
 在电子技术和精细化工领域有重要应用。一种由粗锰粉(主要杂质为Fe、Ni、Pb等金属单质)制备无水氯化锰的工艺如下(部分操作和条件略)。
在电子技术和精细化工领域有重要应用。一种由粗锰粉(主要杂质为Fe、Ni、Pb等金属单质)制备无水氯化锰的工艺如下(部分操作和条件略)。I.向粗锰粉中加入盐酸,控制溶液的pH约为5,测定离子的初始浓度。静置一段时间后锰粉仍略有剩余,过滤;
II.向I的滤液中加入一定量盐酸,再加入
 溶液,充分反应后加入
溶液,充分反应后加入 固体调节溶液的pH约为5,过滤;
固体调节溶液的pH约为5,过滤;III.向II的滤液中通入
 气体,待充分反应后加热一段时间,冷却后过滤;
气体,待充分反应后加热一段时间,冷却后过滤;IV.浓缩、结晶、过滤、洗涤、脱水得到无水MnCl2。
各步骤中对杂质离子的去除情况
 |  |  | |
| 初始浓度/mg·L–1 | 21.02 | 4.95 | 5.86 |
| 步骤I后/ mg·L–1 | 12.85 | 3.80 | 3.39 |
| 步骤II后/ mg·L–1 | 0.25 | 3.76 | 3.38 |
| 步骤III后/ mg·L–1 | 0.10(达标) | 3.19(未达标) | 0.12(达标) |
已知:金属活动性Mn>Fe>Ni>Pb
(1)锰和盐酸反应的化学方程式是
(2)步骤I中:
①Fe2+浓度降低,滤渣中存在
 。结合离子方程式解释原因:
。结合离子方程式解释原因:②Pb2+浓度降低,分析步骤I中发生的反应为:Pb + 2H+ = Pb2+ + H2↑、
(3)步骤II中:
①
 酸性溶液的作用:
酸性溶液的作用:②结合离子方程式说明MnCO3的作用:
(4)步骤III通入H2S后, Ni2+不达标而
 达标。推测溶解度:PbS
达标。推测溶解度:PbS(5)测定无水
 的含量:将a g 样品溶于一定量硫酸和磷酸的混合溶液中,加入稍过量
的含量:将a g 样品溶于一定量硫酸和磷酸的混合溶液中,加入稍过量 ,使
,使 氧化为
氧化为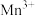 。待充分反应后持续加热一段时间,冷却后用b mol/L硫酸亚铁铵
。待充分反应后持续加热一段时间,冷却后用b mol/L硫酸亚铁铵 滴定
滴定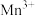 ,消耗c mL 硫酸亚铁铵。(已知:滴定过程中发生的反应为:Fe2+ + Mn3+ = Fe3+ + Mn2+)
,消耗c mL 硫酸亚铁铵。(已知:滴定过程中发生的反应为:Fe2+ + Mn3+ = Fe3+ + Mn2+)①样品中MnCl2的质量分数是
②“持续加热”的目的是使过量的
 分解。若不加热,测定结果会
分解。若不加热,测定结果会
您最近一年使用:0次
2020-05-10更新
|
198次组卷
|
4卷引用:北京市朝阳区2020届高三学业水平等级性考试练习化学试题
北京市朝阳区2020届高三学业水平等级性考试练习化学试题(已下线)北京市2019-2020学年高三各区一模化学考试分类汇编:科学探究北京市第一〇一中学2021届高三上学期9月月考化学试题黑龙江省嫩江市高级中学2021届高三上学期模拟考试化学试题
2022高三·全国·专题练习
4 . 高氯酸铵(NH4ClO4)是复合火箭推进剂的重要成分,也可以做氧化剂、分析试剂等。实验室可由NaClO3等原料制取高氯酸铵(部分物质溶解度如图),其实验流程如图:
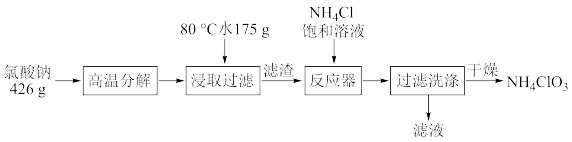
已知:氯酸钠受热分解生成高氯酸钠和氯化钠。
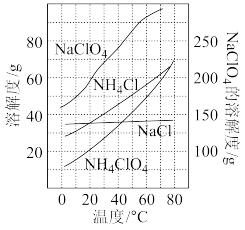
反应得到的混合液中NH4ClO4和NaCl的质量分数分别为0.40和0.20.根据溶解度与温度的关系图象,从混合溶液中获得较多NH4ClO4晶体的实验操作依次为___________ 、___________ (均填实验操作名称)、过滤、冷水洗涤、干燥,冷水洗涤的作用是___________ 。

已知:氯酸钠受热分解生成高氯酸钠和氯化钠。

反应得到的混合液中NH4ClO4和NaCl的质量分数分别为0.40和0.20.根据溶解度与温度的关系图象,从混合溶液中获得较多NH4ClO4晶体的实验操作依次为
您最近一年使用:0次
20-21高三·全国·阶段练习
5 . 下列实验操作能达到预期实验目的的是
| 编号 | 实验操作 | 实验目的 |
| A | 将10g胆矾溶于90g水中 | 配制质量分数为10%的硫酸铜溶液 |
| B | 向盛有1mL0.1mol/LAgNO3溶液的试管中滴加0.1mol/LNaCl溶液,至沉淀不再发生,再滴入0.1mol/LKI溶液 | 说明一种沉淀能转化为溶度积更小的另一种沉淀 |
| C | 室温,分别向2支试管中加入同体积同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的浓硫酸 | 研究温度对化学平衡的影响 |
| D | 甲苯中滴入少量浓溴水振荡,静置 | 研究甲苯能和溴发生取代反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
6 . 亚硝酰氯(ClNO)是有机物合成中的重要试剂,可由NO与Cl2在常温常压下反应得到。ClNO部分性质如下:黄色气体,熔点:-59.6℃,沸点:-6.4℃,遇水易水解。某研究性学习小组根据亚硝酰氯(ClNO)性质拟在通风橱中制取亚硝酰氯,设计了如下实验装置。、
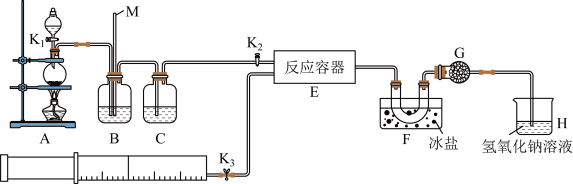
试回答下列问题:
(1)写出实验室利用装置A制备Cl2的离子反应方程式___ 。
(2)装置B的作用是①__ ,②___ 。
(3)若用A装置制取NO气体,B中应该盛放__ 。
(4)为使NO和Cl2恰好完全反应生成ClNO,理论上向E中通入NO和Cl2两种气体的流速比为__ 。
(5)装置H吸收尾气,有同学认为尾气中的某种气体不能完全被吸收。为了充分吸收尾气,可将尾气与__ 同时通入NaOH溶液中。
(6)已知:ClNO与H2O反应生成HNO2和HCl。
①设计实验证明HNO2是弱酸:__ 。(仅提供的试剂:1mol•L-1HCl、1mol•L-1HNO2溶液、NaNO2溶液、红色石蕊试纸、蓝色石蕊试纸)。
②通过以下实验测定ClNO样品的纯度。取F中所得液体3.0g溶于水,配制成250mL溶液;取出25.00mL样品溶液置于锥形瓶中,用0.20mol•L-1AgNO3标准溶液滴定至终点,根据表中所给信息,应选用___ 做指示剂。
消耗标准AgNO3溶液的体积为20.00ml,亚硝酰氯(ClNO)的质量分数为__ 。

试回答下列问题:
(1)写出实验室利用装置A制备Cl2的离子反应方程式
(2)装置B的作用是①
(3)若用A装置制取NO气体,B中应该盛放
(4)为使NO和Cl2恰好完全反应生成ClNO,理论上向E中通入NO和Cl2两种气体的流速比为
(5)装置H吸收尾气,有同学认为尾气中的某种气体不能完全被吸收。为了充分吸收尾气,可将尾气与
(6)已知:ClNO与H2O反应生成HNO2和HCl。
①设计实验证明HNO2是弱酸:
②通过以下实验测定ClNO样品的纯度。取F中所得液体3.0g溶于水,配制成250mL溶液;取出25.00mL样品溶液置于锥形瓶中,用0.20mol•L-1AgNO3标准溶液滴定至终点,根据表中所给信息,应选用
| 物质 | Ag2CrO4 | AgCl | AgI | Ag2S |
| 颜色 | 砖红色 | 白色 | 黄色 | 黑色 |
| Ksp | 1×10-12 | 1.56×10-10 | 8.3×10-17 | 6.3×10-50 |
消耗标准AgNO3溶液的体积为20.00ml,亚硝酰氯(ClNO)的质量分数为
您最近一年使用:0次
名校
解题方法
7 . 碱式氧化镍(NiOOH)可用作镍氢电池的正极材料。以含镍(Ni2+)废液为原料生产NiOOH的一种工艺流程如下:

(1)加入Na2CO3溶液时,确认Ni2+已经完全沉淀的实验方法是___________ 。
(2)已知Ksp[Ni(OH)2]=2×10-15,欲使NiSO4溶液中残留c(Ni2+)≤2×10-5 mol·L-1,调节pH的范围是___________ 。
(3)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式:___________ 。
(4)为测定制得的NiOOH的纯度(假设杂质不与Fe2+、KMnO4反应),进行如下实验:
a.称取9.20 g样品溶于稀硫酸,加入100 mL 1.0000 mol·L-1 Fe2+标准溶液,搅拌至溶液清亮,定容至200 mL。
b.取出20.00 mL,用0.00100 mol·L-1 KMnO4标准溶液滴定,用去KMnO4标准溶液20.00 mL。涉及反应如下:NiOOH+Fe2++3H+=Ni2++Fe3++2H2O 5Fe2++MnO +8H+=5Fe3++4H2O+Mn2+
+8H+=5Fe3++4H2O+Mn2+
试通过计算确定制得NiOOH的百分含量_____ (写出计算过程)。

(1)加入Na2CO3溶液时,确认Ni2+已经完全沉淀的实验方法是
(2)已知Ksp[Ni(OH)2]=2×10-15,欲使NiSO4溶液中残留c(Ni2+)≤2×10-5 mol·L-1,调节pH的范围是
(3)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式:
(4)为测定制得的NiOOH的纯度(假设杂质不与Fe2+、KMnO4反应),进行如下实验:
a.称取9.20 g样品溶于稀硫酸,加入100 mL 1.0000 mol·L-1 Fe2+标准溶液,搅拌至溶液清亮,定容至200 mL。
b.取出20.00 mL,用0.00100 mol·L-1 KMnO4标准溶液滴定,用去KMnO4标准溶液20.00 mL。涉及反应如下:NiOOH+Fe2++3H+=Ni2++Fe3++2H2O 5Fe2++MnO
 +8H+=5Fe3++4H2O+Mn2+
+8H+=5Fe3++4H2O+Mn2+试通过计算确定制得NiOOH的百分含量
您最近一年使用:0次
名校
8 . 25 ℃时,向等浓度的NaCl和Na2CrO4溶液中分别滴加AgNO3溶液(已知:Ag2CrO4为砖红色),平衡时溶液中相关离子浓度的关系如图所示。下列说法正确的是( )


| A.L1为向Na2CrO4溶液中滴加AgNO3溶液时的离子浓度关系曲线 |
| B.Ksp(AgCl)的数量级为10-12 |
| C.L1和L2交点处对应的两种溶液中c(Ag+)=c(Cl-)=c(CrO42-) |
| D.用AgNO3标准溶液测定溶液中Cl-含量时可用Na2CrO4做指示剂 |
您最近一年使用:0次
2020-02-06更新
|
305次组卷
|
2卷引用:福建省福州一中2019—2020年高三上学期期末考试化学试题
解题方法
9 . 滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等。沉淀滴定所用的指示剂本身就是一种沉淀剂,已知一些银盐的颜色和Ksp(20℃)如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定。
滴定时,你认为该滴定适宜选用的指示剂是下列中的
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
| Ksp | 1.8×10-10 | 5.0×10-13 | 8.3×10-17 | 2.0×10-48 | 1.8×10-10 |
| A.KI | B.K2CrO4 | C.KBr | D.K2S |
您最近一年使用:0次
名校
解题方法
10 . 已知下列物质在 20 ℃下的 Ksp 如下,试回答下列问题:
(1)20 ℃时,上述五种银盐饱和溶液中,Ag+物质的量浓度由大到小的顺序是_______ (用化学式表示)。
(2)向等浓度的 KCl 和 KBr 的混合溶液中逐渐加入 AgNO3 溶液,当两种沉淀共存时, =
=__________ 。
(3)测定水中 Cl-含量时,常用 Ag+进行滴定,滴定时,应加入的指示剂是_____ 。
A.KBr B.KI C.K2S D.K2CrO4
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
Ksp | 2.0×10-10 | 5.4×10-13 | 8.3×10-17 | 2.0×10-48 | 2.0×10-12 |
(1)20 ℃时,上述五种银盐饱和溶液中,Ag+物质的量浓度由大到小的顺序是
(2)向等浓度的 KCl 和 KBr 的混合溶液中逐渐加入 AgNO3 溶液,当两种沉淀共存时,
 =
=(3)测定水中 Cl-含量时,常用 Ag+进行滴定,滴定时,应加入的指示剂是
A.KBr B.KI C.K2S D.K2CrO4
您最近一年使用:0次



