名校
解题方法
1 . 关于下列各装置图的叙述正确的是
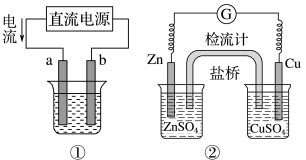
A.用图①装置实现铁上镀铜,b极为铁,电解质溶液可以是 溶液 溶液 |
B.图②装置盐桥中 的 的 移向左烧杯 移向左烧杯 |
| C.图③装置中钢闸门应与外接电源的负极相连获得保护,该方法为牺牲阳极的阴极保护法 |
| D.图④两个装置中通过导线的电子数相同时,正极析出产品的物质的量不同 |
您最近一年使用:0次
2023-03-02更新
|
352次组卷
|
5卷引用:内蒙古包头市2022-2023学年高二上学期期末考试化学试题
解题方法
2 . 下列用来表示物质变化的化学用语中,正确的是
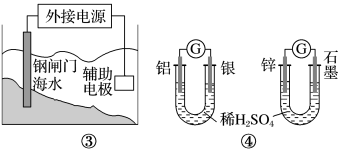
A.析氢腐蚀和吸氧腐蚀,负极反应均是: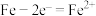 |
B. 燃料电池,负极的电极反应式为 燃料电池,负极的电极反应式为 |
C.铅酸蓄电池放电时正极的反应式: |
D.用惰性电极电解饱和食盐水时,阴极的电极反应式为: |
您最近一年使用:0次
解题方法
3 . 下列有关说法正确的是
| A.若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀 |
B.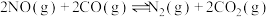 在常温下能自发进行,则该反应的 在常温下能自发进行,则该反应的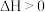 |
C.加热 溶液, 溶液, 的水解程度和溶液的 的水解程度和溶液的 均增大(忽略 均增大(忽略 的变化) 的变化) |
D.对于乙酸与乙醇的酯化反应( ),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大 ),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大 |
您最近一年使用:0次
名校
解题方法
4 . 请仔细观察下列两种装置的构造示意图,完成下列问题:
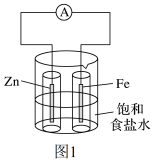
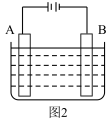
实验I:
向图1烧杯中加入一定量的饱和食盐水,插入两个无底玻璃筒。将一根锌棒和一根铁棒用导线与电流表连接后,再分别插入两个玻璃筒中,电流表指针发生偏转。
(1)铁棒上发生的电极反应为_____ 。
实验Ⅱ:该小组的同学将锌棒换为铜棒,并用导线将其与电流表连接。一段时间后,向插入铁棒的玻璃筒内滴入几滴K3[Fe(CN)6]溶液,向插入铜棒的玻璃筒内滴入几滴酚酞溶液。
(2)实验Ⅱ中电流表指针的偏转方向与实验I______ (填“相同”或“相反”)。
(3)在铁棒附近可观察到的现象是______ 。
(4)上述两个实验表明,活泼性不同的两种金属作电极构成原电池时,一般是相对不活泼的金属被保护,根据此原理采取的金属防护方法称为______ 。
实验Ⅲ:
(5)已知粗锌中含有的杂质有铝、铁和铜,图2若为电解精炼锌,则A极应接____ (填“粗锌”或“纯锌”),电解一段时间后,电解质溶液中含有的金属阳离子有______ 。
(6)图2若为铜上镀银装置,已知电镀前A、B电极质量相等,电镀完成后两电极质量差为6.48g时,则电路中通过的电子数为_____ 。
(7)若图2使用的电源为一种高效耐用的新型可充电电池,其放电反应为:3Zn+2K2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4KOH。写出该电池放电时正极电极方程式_____ 。


实验I:
向图1烧杯中加入一定量的饱和食盐水,插入两个无底玻璃筒。将一根锌棒和一根铁棒用导线与电流表连接后,再分别插入两个玻璃筒中,电流表指针发生偏转。
(1)铁棒上发生的电极反应为
实验Ⅱ:该小组的同学将锌棒换为铜棒,并用导线将其与电流表连接。一段时间后,向插入铁棒的玻璃筒内滴入几滴K3[Fe(CN)6]溶液,向插入铜棒的玻璃筒内滴入几滴酚酞溶液。
(2)实验Ⅱ中电流表指针的偏转方向与实验I
(3)在铁棒附近可观察到的现象是
(4)上述两个实验表明,活泼性不同的两种金属作电极构成原电池时,一般是相对不活泼的金属被保护,根据此原理采取的金属防护方法称为
实验Ⅲ:
(5)已知粗锌中含有的杂质有铝、铁和铜,图2若为电解精炼锌,则A极应接
(6)图2若为铜上镀银装置,已知电镀前A、B电极质量相等,电镀完成后两电极质量差为6.48g时,则电路中通过的电子数为
(7)若图2使用的电源为一种高效耐用的新型可充电电池,其放电反应为:3Zn+2K2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4KOH。写出该电池放电时正极电极方程式
您最近一年使用:0次
名校
5 . 研究金属腐蚀和防护的原理很有现实意义。
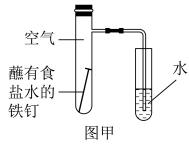
(1)下图为探究钢铁的吸氧腐蚀的装置。某兴趣小组按该装置进行实验发现导管中水柱上升缓慢,下列措施可以更快更清晰地观察到水柱上升现象的有___________(填序号)。
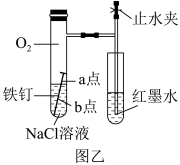
(2)该小组将图甲装置改进成图乙装置并进行实验,导管中红墨水液柱高度随时间的变化如表所示,根据数据可判断腐蚀的速率随时间变化逐渐____ (填“加快”“减慢”或“不变”),你认为影响腐蚀速率改变的主要因素为____ 。
(3)为探究图乙中a、b两点所发生的反应,进行以下实验,请完成表中空白:
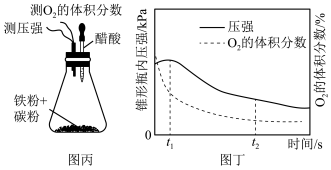
(4)设计图丙装置研究弱酸性环境中腐蚀的主要形式。测定锥形瓶内气压和空气中氧气的体积分数随时间变化如图丁所示,通过图丁中数据变化分析, s之间主要发生
s之间主要发生______ (填“吸氧”或“析氢”)腐蚀。
(5)金属阳极钝化是一种电化学防护方法。将Fe作阳极置于一定浓度的 溶液中,一定条件下,Fe钝化形成致密
溶液中,一定条件下,Fe钝化形成致密 氧化膜,试写出该阳极的电极反应
氧化膜,试写出该阳极的电极反应___________ 。
(1)下图为探究钢铁的吸氧腐蚀的装置。某兴趣小组按该装置进行实验发现导管中水柱上升缓慢,下列措施可以更快更清晰地观察到水柱上升现象的有___________(填序号)。

| A.用纯氧气代替具支试管内空气 |
| B.用酒精灯加热具支试管提高温度 |
| C.将铁钉换成铁粉和碳粉混合粉末 |
| D.将玻璃导管换成更细的导管,水中滴加红墨水 |
| 时间/min | 1 | 3 | 5 | 7 | 9 |
| 液柱高度/cm | 0.8 | 2.1 | 3.0 | 3.7 | 4.2 |

| 实验操作 | 实验现象 | 实验结论 |
| 向NaCl溶液中滴加2~3滴酚酞溶液 | a点附近溶液出现红色 | a点电极反应为 |
| 一段时间后再滴加2~3滴铁氰化钾溶液 | b点周围出现蓝色沉淀 | b点电极反应为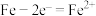 |
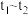 s之间主要发生
s之间主要发生
(5)金属阳极钝化是一种电化学防护方法。将Fe作阳极置于一定浓度的
 溶液中,一定条件下,Fe钝化形成致密
溶液中,一定条件下,Fe钝化形成致密 氧化膜,试写出该阳极的电极反应
氧化膜,试写出该阳极的电极反应
您最近一年使用:0次
2022-01-15更新
|
179次组卷
|
2卷引用:内蒙古包头市2021-2022学年高二上学期期末考试化学试题
名校
解题方法
6 . 关于下列各装置图的叙述错误的是
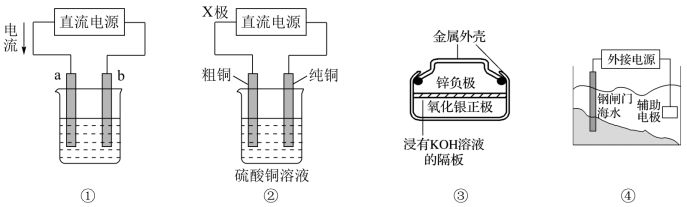
| A.图①装置用于实现铁上镀铜,a极为铜,b极为铁 |
| B.图②装置中的X极若为负极,则该装置可实现粗铜的精炼 |
C.图③装置中正极的电极反应式为: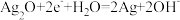 |
| D.图④装置中钢闸门应与外接电源的负极相连以实现外加电流的阴极保护 |
您最近一年使用:0次
2021-07-09更新
|
1073次组卷
|
10卷引用:内蒙古自治区包头市第九中学2022-2023学年高二上学期期末考试化学试题
内蒙古自治区包头市第九中学2022-2023学年高二上学期期末考试化学试题宁夏永宁县永宁中学2021-2022学年高二上学期期末考试化学试题内蒙古包头市第四中学2021-2022学年高二上学期期中考试化学试题福建省连城县第一中学2022-2023学年高二上学期月考(一)化学试题河北省石家庄市第四十二中学2022-2023高二上学期10月月考化学试题四川省南充市2020-2021学年高二下学期期末考试化学试题(已下线)1.3.2 金属的电化学防护-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)(已下线)第4章 化学反应与电能(章末检测)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)甘肃省永昌县第一高级中学2021-2022学年高二上学期期中考试化学(理)试题陕西省西安市蓝田县乡镇学校联考2023-2024学年高二上学期1月期末化学试题
真题
名校
7 . 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致现象的主要原因是液滴之下氧气含量比边缘处少。下列说法正确的是()


| A.液滴中的Cl–由a区向b区迁移 |
| B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-=4OH- |
| C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH−形成Fe(OH)2,进一步氧化、脱水形成铁锈 |
| D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e-=Cu2+ |
您最近一年使用:0次
2019-01-30更新
|
1727次组卷
|
34卷引用:内蒙古包头市2022-2023学年高二上学期期末考试化学试题
内蒙古包头市2022-2023学年高二上学期期末考试化学试题河南省信阳高级中学2021-2022学年高二下学期4月月考化学试题四川省遂宁市第二中学校2021-2022学年高二下学期半期考试化学试题山西大学附属中学校2022-2023学年高二上学期12月月考化学试题2011年普通高等学校招生全国统一考试化学卷(浙江)(已下线)2011-2012学年浙江东阳中学、兰溪一中高二下学期期中考试化学卷(已下线)2011-2012学年吉林省扶余一中高一下学期期中考试化学试卷(已下线)2011-2012学年河南省信阳高中高一下学期期中考试化学试卷(已下线)2013届山西省山大附中高三1月月考化学试卷(已下线)2012-2013学年湖北省黄冈中学高二上学期期中考试化学试卷(已下线)2012届北京市清华附中高三考前适应性训练理综化学试卷2015-2016学年浙江省温州市瑞安市龙翔中学高二上第三次月考化学卷2015-2016学年北大附中河南分校高一下3月月考化学试卷浙江省温州中学2016-2017学年高一下学期期中考试化学试题河南省南阳市第一中学校2016-2017学年高二下学期第三次月考化学试题河南省南阳市第一中学2016-2017学年高二下学期第三次月考化学试题宁夏育才中学学益校区2017-2018学年高二12月月考化学试题山东省新汶中学2017-2018学年高二上学期第一次月考化学试题河南省郑州市第二中学2018-2019学年高二上学期第一次月考化学试题高二人教版选修4 第四章 第四节 金属的电化学腐蚀与防护(已下线)2018年12月15日 《每日一题》人教选修4-周末培优河南省鹤壁市高级中学2018-2019学年高一下学期第二次段考化学试题湖北省武汉市武昌区武汉中学2019-2020学年高二上学期化学(人教版选修4)期末复习试题:专题16 金属的腐蚀与防护(已下线)上海市卢湾区2012届高三上学期期末考试化学试题甘肃省兰州市第一中学2019-2020学年高二上学期期末考试化学试题鲁科版(2019)选择性必修1 第1章 化学反应与能量转化 第4节 金属的腐蚀与防护人教版(2019)高二选择性必修第一册 第四章 化学反应与电能 第三节 金属的腐蚀与防护 教材帮福建省永安市第三中学2020-2021学年高二10月月考化学(选考班)试题上海市上海中学2021届高三上学期期中考试化学试题河南省郑州励德双语学校2020-2021学年高二上学期期中考试化学试题(已下线)课时34 金属的腐蚀与防护-2022年高考化学一轮复习小题多维练(全国通用)新疆柯坪县柯坪湖州国庆中学2021-2022学年高三上学期第一次月考化学试题(已下线)专题08 电化学之电解池-【微专题·大素养】备战2022年高考化学讲透提分要点重庆市南开中学2023-2024学年高二上学期期末考试化学试题



