解题方法
1 . 根据原电池原理,结合装置图,按要求解答问题: 为
为 ,
, 为硫酸铜溶液,则
为硫酸铜溶液,则 为
为___________ (填电极名称),判断依据是___________ ;铜电极的名称是___________ ,溶液中的 移向
移向___________ (填“ ”或“
”或“ ”)电极。
”)电极。
(2)若 为银,
为银, 为硝酸银溶液,则
为硝酸银溶液,则 为
为___________ (填电极名称),判断依据是___________ ;铜电极的名称是___________ ,溶液中的 移向
移向___________ (填“ ”或“
”或“ ”)电极。
”)电极。 电极上的电极反应式为
电极上的电极反应式为___________ 。

 为
为 ,
, 为硫酸铜溶液,则
为硫酸铜溶液,则 为
为 移向
移向 ”或“
”或“ ”)电极。
”)电极。(2)若
 为银,
为银, 为硝酸银溶液,则
为硝酸银溶液,则 为
为 移向
移向 ”或“
”或“ ”)电极。
”)电极。 电极上的电极反应式为
电极上的电极反应式为
您最近一年使用:0次
2 . 磷酸铁锂电池是在动力领域最早使用、在储能领域最大规模使用的锂离子电池,放电时总反应为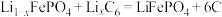 。一种以废旧磷酸铁锂电池正极片(含
。一种以废旧磷酸铁锂电池正极片(含 导电石墨、铝箔)为原料制备微溶于水的Li3PO4,的工艺流程如图,下列说法错误的是
导电石墨、铝箔)为原料制备微溶于水的Li3PO4,的工艺流程如图,下列说法错误的是
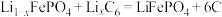 。一种以废旧磷酸铁锂电池正极片(含
。一种以废旧磷酸铁锂电池正极片(含 导电石墨、铝箔)为原料制备微溶于水的Li3PO4,的工艺流程如图,下列说法错误的是
导电石墨、铝箔)为原料制备微溶于水的Li3PO4,的工艺流程如图,下列说法错误的是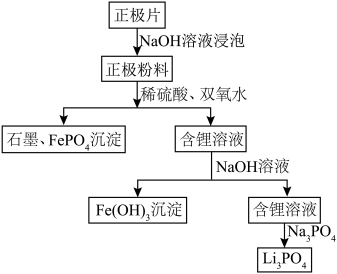
| A.NaOH溶液浸泡正极片的目的是除去正极片中的铝箔 |
| B.磷酸铁锂电池放电时,每转移1mol电子,正极增重7xg |
C.正极粉料中加入稀硫酸和双氧水时, 固体发生反应的离子方程式为 固体发生反应的离子方程式为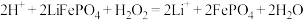 |
D.加入 后,可以通过过滤、冷水洗涤、干燥等操作获得较纯净的 后,可以通过过滤、冷水洗涤、干燥等操作获得较纯净的 |
您最近一年使用:0次
2024-05-09更新
|
76次组卷
|
2卷引用:陕西省西安市长安区第三中学2023-2024学年高一下学期质量检测化学试卷
名校
解题方法
3 . 形形色色的电池在生产生活中有着重要的作用,请回答下列问题:
(1)碱性锌锰电池适合需要大电流供电的设备使用如照相机、野外摄像机、无线电控制的航模与海模、电动工具、电动玩具、收录机等,其结构如图所示,总反应为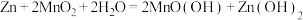 。该电池的正极为
。该电池的正极为__________ (填“Zn”或“ ”),其电极反应式为
”),其电极反应式为__________ 。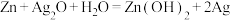 ,放电时,
,放电时, 发生
发生__________ (填“氧化”或“还原”)反应。一种废旧纽扣电池回收工艺流程如图所示,稀硫酸溶解时需要在无氧环境下进行,原因是__________ ;加入稀硝酸溶解银时,产物为 、NO和
、NO和 ,该反应的化学方程式为
,该反应的化学方程式为__________ ,调浆后,加入葡萄糖制备银粉,葡萄糖的作用为__________ 。__________ ,电路中每转移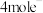 ,两极共消耗
,两极共消耗__________ L(换算成标准状况下)气体。
(1)碱性锌锰电池适合需要大电流供电的设备使用如照相机、野外摄像机、无线电控制的航模与海模、电动工具、电动玩具、收录机等,其结构如图所示,总反应为
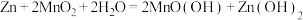 。该电池的正极为
。该电池的正极为 ”),其电极反应式为
”),其电极反应式为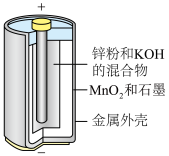
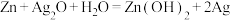 ,放电时,
,放电时, 发生
发生 、NO和
、NO和 ,该反应的化学方程式为
,该反应的化学方程式为
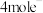 ,两极共消耗
,两极共消耗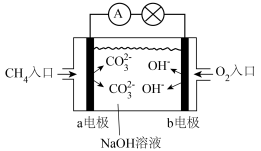
您最近一年使用:0次
2024-03-27更新
|
445次组卷
|
3卷引用:陕西省西安市长安区第三中学2023-2024学年高一下学期质量检测化学试卷
名校
解题方法
4 . 一种硝酸盐还原制 的装置如图,初始时离子交换膜两侧溶液质量相同,查阅资料得知阴离子交换膜只允许阴离子通过,不允许阳离子和其他分子通过。下列说法正确的是
的装置如图,初始时离子交换膜两侧溶液质量相同,查阅资料得知阴离子交换膜只允许阴离子通过,不允许阳离子和其他分子通过。下列说法正确的是
 的装置如图,初始时离子交换膜两侧溶液质量相同,查阅资料得知阴离子交换膜只允许阴离子通过,不允许阳离子和其他分子通过。下列说法正确的是
的装置如图,初始时离子交换膜两侧溶液质量相同,查阅资料得知阴离子交换膜只允许阴离子通过,不允许阳离子和其他分子通过。下列说法正确的是
A.石墨电极发生的反应为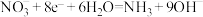 |
B.锌电极表面的电极反应式为 |
C.电路中每转移 的同时有1mol阴离子通过离子交换膜 的同时有1mol阴离子通过离子交换膜 |
| D.电路中转移0.8mol电子时,负极增加26g |
您最近一年使用:0次
2024-03-27更新
|
174次组卷
|
3卷引用:陕西省西安市长安区第三中学2023-2024学年高一下学期质量检测化学试卷
名校
5 . 化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在 稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
①哪一时间段反应速率最大___________ min(填“0~1”、“1~2”、“2~3”、“3~4”或“4~5”),原因是___________ 。
②2~3min内,以盐酸的浓度变化表示的平均反应速率为___________ mol/(L·min) (设溶液体积不变)。
③另一位同学认为在盐酸中滴入少量的CuSO4溶液可以加快反应的速率,请从原电池的角度给予分析:构成的原电池中负极反应式为___________ ,溶液中H+移向___________ (填“正”或“负”)极。
(2)某温度下在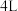 恒容密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图所示:
恒容密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图所示:

①达到平衡状态时Z的浓度为___________ mol/L,该反应的化学方程式是___________ 。
②5min时,Z的生成速率___________ (填“大于”、“小于”或“等于”)6min时Z的生成速率。
③若升高温度,则逆反应速率___________ (填“增大”、“减小”或“不变”)。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在
 稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):| 时间/min | 1 | 2 | 3 | 4 | 5 |
| 氢气体积/mL(标准状况) | 109 | 220 | 332 | 412 | 480 |
②2~3min内,以盐酸的浓度变化表示的平均反应速率为
③另一位同学认为在盐酸中滴入少量的CuSO4溶液可以加快反应的速率,请从原电池的角度给予分析:构成的原电池中负极反应式为
(2)某温度下在
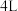 恒容密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图所示:
恒容密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图所示:
①达到平衡状态时Z的浓度为
②5min时,Z的生成速率
③若升高温度,则逆反应速率
您最近一年使用:0次
名校
6 . 能量以多种不同的形式存在,并能相互转化。
Ⅰ.合成氨反应在化工生产中具有重要意义。
(1)合成氨反应为放热反应,下列图示表示的过程也为放热反应的是___________ (填字母)。 和
和 在催化剂表面合成氨的微观历程如图所示,用
在催化剂表面合成氨的微观历程如图所示,用 、
、 、
、 分别表示
分别表示 、
、 、
、 。下列说法中正确的是___________(填字母)。
。下列说法中正确的是___________(填字母)。
(3)一定条件下,向某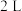 恒温恒容密闭容器中通入
恒温恒容密闭容器中通入 和
和 ,经
,经 反应达到平衡状态,此时
反应达到平衡状态,此时 的浓度为
的浓度为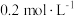 。
。
①在 内,以
内,以 的浓度变化表示的平均反应速率为
的浓度变化表示的平均反应速率为___________  。
。
②若在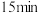 时采取下列措施,不能增大反应速率的是
时采取下列措施,不能增大反应速率的是___________ (填字母)。
A.恒温恒容下,再充入 B.其他条件不变,降低温度
B.其他条件不变,降低温度
C.恒温恒容下,向其中充入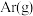 D.其他条件不变,将该反应容器的容积压缩至
D.其他条件不变,将该反应容器的容积压缩至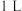
Ⅱ.电池的发明是储能和供能技术的巨大进步,如图所示的原电池装置,插入电解质溶液前 和
和 电极质量相等。
电极质量相等。
(4)电解质为稀盐酸时,图中箭头的方向表示___________ (填“电子”或“电流”)的流向,铁棒上的电极反应式为___________ 。___________ (填字母)。
A.稀硫酸 B. 溶液 C.浓硝酸 D.
溶液 C.浓硝酸 D. 溶液
溶液
② 时
时 电极的质量a为
电极的质量a为___________ g。
Ⅰ.合成氨反应在化工生产中具有重要意义。
(1)合成氨反应为放热反应,下列图示表示的过程也为放热反应的是
a. b.
b. c.
c.
 和
和 在催化剂表面合成氨的微观历程如图所示,用
在催化剂表面合成氨的微观历程如图所示,用 、
、 、
、 分别表示
分别表示 、
、 、
、 。下列说法中正确的是___________(填字母)。
。下列说法中正确的是___________(填字母)。
| A.反应过程存在非极性共价键的断裂和形成 |
B.催化剂仅起到吸附 和 和 的作用,对化学反应速率没有影响 的作用,对化学反应速率没有影响 |
| C.②→③过程吸热 |
| D.使用催化剂,合成氨反应放出的热量减少 |
(3)一定条件下,向某
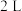 恒温恒容密闭容器中通入
恒温恒容密闭容器中通入 和
和 ,经
,经 反应达到平衡状态,此时
反应达到平衡状态,此时 的浓度为
的浓度为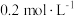 。
。①在
 内,以
内,以 的浓度变化表示的平均反应速率为
的浓度变化表示的平均反应速率为 。
。②若在
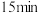 时采取下列措施,不能增大反应速率的是
时采取下列措施,不能增大反应速率的是A.恒温恒容下,再充入
 B.其他条件不变,降低温度
B.其他条件不变,降低温度C.恒温恒容下,向其中充入
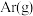 D.其他条件不变,将该反应容器的容积压缩至
D.其他条件不变,将该反应容器的容积压缩至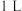
Ⅱ.电池的发明是储能和供能技术的巨大进步,如图所示的原电池装置,插入电解质溶液前
 和
和 电极质量相等。
电极质量相等。(4)电解质为稀盐酸时,图中箭头的方向表示


A.稀硫酸 B.
 溶液 C.浓硝酸 D.
溶液 C.浓硝酸 D. 溶液
溶液②
 时
时 电极的质量a为
电极的质量a为
您最近一年使用:0次
名校
解题方法
7 . 某电池的工作原理如图所示,阴离子交换膜只允许阴离子通过,总反应为: ,下列说法正确的是
,下列说法正确的是
 ,下列说法正确的是
,下列说法正确的是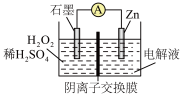
| A.石墨为电池的负极 | B.电子由Zn电极经外电路流向石墨电极 |
| C.Zn极发生还原反应 | D.电池工作时,H2O2被氧化 |
您最近一年使用:0次
2024-02-21更新
|
1480次组卷
|
4卷引用:陕西省咸阳市实验中学2022-2023学年高一下学期第三次月考化学试题
名校
解题方法
8 . 某兴趣小组依据反应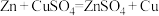 探究原电池的工作原理,将质量相等的锌片和铜片用导线相连浸入硫酸铜溶液中构成如图1装置。
探究原电池的工作原理,将质量相等的锌片和铜片用导线相连浸入硫酸铜溶液中构成如图1装置。___________ (填“甲”或“乙”)表示。___________ (填“有”或“无”,下同)氧化还原反应发生,导线上___________ 电流产生。
(3)连接K,锌片上的电极反应式为___________ 。 后测得锌片和铜片之间的质量差为
后测得锌片和铜片之间的质量差为 ,则导线中通过电子的物质的量为
,则导线中通过电子的物质的量为___________ mol。
(4)连接K一段时间后,测得铜片质量增加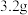 ,同时锌片质量减少
,同时锌片质量减少 ,则这段时间内该装置消耗的化学能转化为电能的百分比为
,则这段时间内该装置消耗的化学能转化为电能的百分比为___________ (结果精确到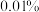 )。
)。
(5)常温下,将除去表面氧化膜的铝片、铜片插入浓 中组成原电池装置(如图甲),测得原电池的电流强度 (I)随时间(t)的变化如图乙所示,反应过程中有红棕色气体产生。
中组成原电池装置(如图甲),测得原电池的电流强度 (I)随时间(t)的变化如图乙所示,反应过程中有红棕色气体产生。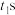 前,原电池的负极是
前,原电池的负极是___________ ,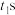 后,外电路中电子流动方向发生改变,原因是
后,外电路中电子流动方向发生改变,原因是___________ 。
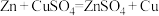 探究原电池的工作原理,将质量相等的锌片和铜片用导线相连浸入硫酸铜溶液中构成如图1装置。
探究原电池的工作原理,将质量相等的锌片和铜片用导线相连浸入硫酸铜溶液中构成如图1装置。

(3)连接K,锌片上的电极反应式为
 后测得锌片和铜片之间的质量差为
后测得锌片和铜片之间的质量差为 ,则导线中通过电子的物质的量为
,则导线中通过电子的物质的量为(4)连接K一段时间后,测得铜片质量增加
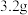 ,同时锌片质量减少
,同时锌片质量减少 ,则这段时间内该装置消耗的化学能转化为电能的百分比为
,则这段时间内该装置消耗的化学能转化为电能的百分比为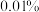 )。
)。(5)常温下,将除去表面氧化膜的铝片、铜片插入浓
 中组成原电池装置(如图甲),测得原电池的电流强度 (I)随时间(t)的变化如图乙所示,反应过程中有红棕色气体产生。
中组成原电池装置(如图甲),测得原电池的电流强度 (I)随时间(t)的变化如图乙所示,反应过程中有红棕色气体产生。
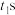 前,原电池的负极是
前,原电池的负极是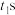 后,外电路中电子流动方向发生改变,原因是
后,外电路中电子流动方向发生改变,原因是
您最近一年使用:0次
名校
解题方法
9 . 新型电池的开发与使用在现代社会中已很普遍,一种水煤气(主要成分为 和
和 )燃料电池的能量转化率可达
)燃料电池的能量转化率可达 以上,其工作原理如图。下列说法正确的是
以上,其工作原理如图。下列说法正确的是
 和
和 )燃料电池的能量转化率可达
)燃料电池的能量转化率可达 以上,其工作原理如图。下列说法正确的是
以上,其工作原理如图。下列说法正确的是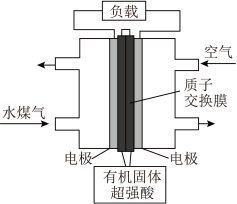
A.若电池的能量利用率为 ,则通入 ,则通入 水煤气( 水煤气(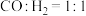 ),电路中转移 ),电路中转移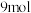 电子 电子 |
B.有机固体中的 在放电时向正极移动,使正极的 在放电时向正极移动,使正极的 减小 减小 |
C.电路中通过 电子,正极消耗 电子,正极消耗 (标准状况下)空气 (标准状况下)空气 |
D.负极反应式为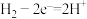 、 、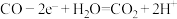 |
您最近一年使用:0次
2024-02-21更新
|
858次组卷
|
3卷引用:陕西省咸阳市实验中学2021-2022学年高一下学期阶段性检测(二)化学试题
名校
解题方法
10 . 某化学兴趣小组利用4份等质量的铝片(已打磨)、其他材料及电解质溶液设计了4组原电池,反应一段时间,观察并记录的部分实验结果如表所示。下列说法错误的是
| 实验编号 | ① | ② | ③ | ④ |
| 电极材料 | 铝、铜 | 铝、石墨 | 镁、铝 | 铝、铜 |
| 电解质溶液 | 稀硫酸 | 稀硫酸 | 氢氧化钠溶液 | 浓硝酸 |
| 电流表指针偏转方向 | 偏向铜 | 偏向镁 |
| A.④中电流表指针始终偏向铜 |
| B.②和③中,当生成等物质的量的气体时,外电路中转移电子的数目相等 |
| C.③中镁作正极,铝作负极 |
| D.由上述实验可知,在原电池中活泼性强的金属单质不一定作负极 |
您最近一年使用:0次
2024-02-19更新
|
165次组卷
|
3卷引用:陕西省咸阳市实验中学2022-2023学年高一下学期第二次月考化学试题



