1 . 海洋是巨大的资源宝库,从海洋中获取的部分资源如图所示:
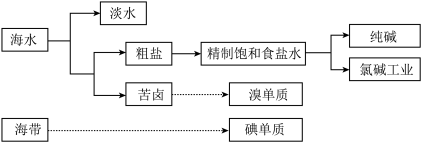
回答下列问题:
Ⅰ.微生物脱盐电池既可以实现海水的淡化,同时又能除去废水中的 和
和 ,原理如图所示,中阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过。
,原理如图所示,中阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过。
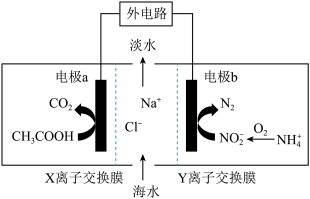
(1)电极b为电池的___________ 极(填正或负)。
(2)X离子交换膜为___________ 离子交换膜(填阴或阳)。
Ⅱ.溴被称为“海洋元素”,空气吹出法从海水中提取溴单质的流程如下图所示:
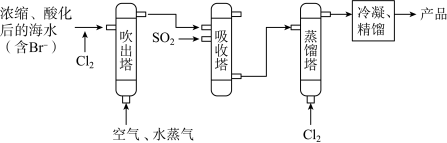
(3)吹出塔中采用气——液逆流的方式(液体从塔顶喷淋,气体从塔底进入),其目的是___________ 。
(4)写出蒸馏塔中反应的离子方程式___________ 。
Ⅲ.从海带中提取碘单质的流程如下:
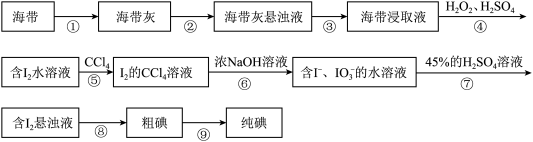
(5)上述流程中能循环使用的物质是___________ (填化学式)。
(6)步骤⑤的具体实验操作为:
A.将分液漏斗放在铁架台的铁圈中,静置、分层;
B.将含 水溶液和适量四氯化碳加入分液漏斗中,盖好玻璃塞;
水溶液和适量四氯化碳加入分液漏斗中,盖好玻璃塞;
C.检验分液漏斗活塞和上口玻璃塞是否漏液;
D.倒转分液漏斗振荡,并不时旋开活塞放气,最后关闭活塞;
E.从分液漏斗上口倒出上层液体;
F.将分液漏斗上口的玻璃塞打开或使塞上的凹槽对准分液漏斗口上的小孔;
G.旋开活塞,用烧杯接收下层液体;
上述实验操作的正确顺序为___________ (填序号),“操作A”静置、分层后的现象为___________ 。
(7)根据下表中有机物的性质分析,能代替步骤⑤中 的试剂是
的试剂是___________ (填试剂名称)。
(8)从海洋中获取资源涉及多种实验操作,为完成下列各组实验,所选仪器准确、完整的是___________ (填选项)。

回答下列问题:
Ⅰ.微生物脱盐电池既可以实现海水的淡化,同时又能除去废水中的
 和
和 ,原理如图所示,中阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过。
,原理如图所示,中阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过。
(1)电极b为电池的
(2)X离子交换膜为
Ⅱ.溴被称为“海洋元素”,空气吹出法从海水中提取溴单质的流程如下图所示:

(3)吹出塔中采用气——液逆流的方式(液体从塔顶喷淋,气体从塔底进入),其目的是
(4)写出蒸馏塔中反应的离子方程式
Ⅲ.从海带中提取碘单质的流程如下:

(5)上述流程中能循环使用的物质是
(6)步骤⑤的具体实验操作为:
A.将分液漏斗放在铁架台的铁圈中,静置、分层;
B.将含
 水溶液和适量四氯化碳加入分液漏斗中,盖好玻璃塞;
水溶液和适量四氯化碳加入分液漏斗中,盖好玻璃塞;C.检验分液漏斗活塞和上口玻璃塞是否漏液;
D.倒转分液漏斗振荡,并不时旋开活塞放气,最后关闭活塞;
E.从分液漏斗上口倒出上层液体;
F.将分液漏斗上口的玻璃塞打开或使塞上的凹槽对准分液漏斗口上的小孔;
G.旋开活塞,用烧杯接收下层液体;
上述实验操作的正确顺序为
(7)根据下表中有机物的性质分析,能代替步骤⑤中
 的试剂是
的试剂是| 试剂 | 性质 |
| 丙酮 | 无色液体,可以与水任意比例互溶, 易溶于丙酮 易溶于丙酮 |
| 氯仿 | 无色液体,不溶于水,密度比水大, 易溶于氯仿 易溶于氯仿 |
| 己烯 | 无色液体,不溶于水,密度比水小, 能与己烯发生化学反应 能与己烯发生化学反应 |
| 选项 | 实验 | 仪器 |
| A | 模拟海水晒盐制取粗盐 | 铁架台(带铁圈)、酒精灯、蒸发皿 |
| B | 将海带灼烧成海带灰 | 三脚架、酒精灯、坩埚、坩埚钳、玻璃棒 |
| C | 从含 的悬浊液中获取粗碘 的悬浊液中获取粗碘 | 铁架台(带铁圈)、普通漏斗、烧杯、玻璃棒 |
| D | 提纯粗碘制取纯碘 | 铁架台(带铁圈)、酒精灯、石棉网、烧杯、圆底烧瓶(盛有冷水) |
您最近一年使用:0次
2023-04-26更新
|
826次组卷
|
3卷引用: 山东省枣庄市台儿庄区2022-2023学年高一下学期期中考试化学试题
2 . 某小组进行如下实验:向0.1mol·L-1 FeCl3溶液中通入SO2或加入Na2SO3溶液,均得到红色溶液。
已知:溶液中+4价含硫微粒物质的量分数随pH变化的曲线如下图所示。
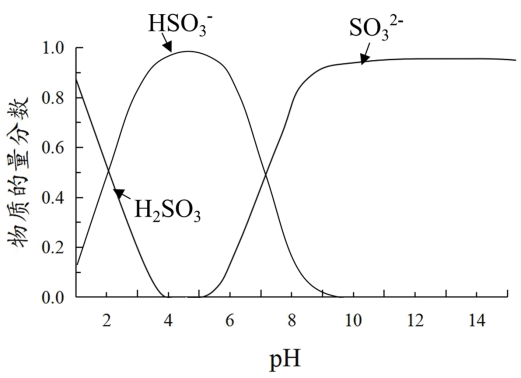
I.推测Fe3+与溶液中的某种+4价含硫微粒形成了红色的配离子。设计如下实验(均在常温下进行):
(1)将上述实验补充完整________ 。
(2)配离子的配体为 的实验证据是
的实验证据是_______ 。
II.探究pH对FeCl3和Na2SO3反应的影响。设计如下实验:
(3)探究实验b中溶液褪色更快的原因:
i.甲认为pH降低,有利于Fe3+氧化 ,导致实验b中溶液褪色更快。
,导致实验b中溶液褪色更快。
①从电极反应的角度,进行理论分析:
还原反应为:Fe3++e-=Fe2+氧化反应为:_______ 。
②已知上述实验条件下pH对Fe3+的氧化性几乎没有影响。从平衡移动的角度判断pH对 还原性的影响是
还原性的影响是_______ (填“增强”或“减弱”)。
③通过理论分析,甲认为其猜测_______ (填“成立”或“不成立”),并进一步实验,获得了证据。实验方案为:反应相同时间,分别取实验a和b中的溶液,检测_______ 浓度(填离子符号),比较其大小关系。
ii.乙猜测pH降低,有利于_______氧化 ,导致实验b中溶液褪色更快。
,导致实验b中溶液褪色更快。
④将乙的假设补充完整_______ (填化学式)。
⑤乙设计实验进行验证:
取10mL 0.1mol·L-1 Na2SO3溶液加硫酸调pH=1.7,用KMnO4溶液滴定,消耗体积为V1。另取一份相同的溶液放置10分钟后,再用KMnO4溶液滴定,消耗体积为V2.前后差值(V1-V2)为ΔVa。用同样的方法对10mL 0.1mol·L-1 Na2SO3(含H2SO4)pH=1.3进行滴定,消耗KMnO4溶液前后体积差值为ΔVb。
经对比可知,ΔVa>△Vb,由此得出的实验结论是_______ 。
(4)综合上述分析,pH降低,有利于_______ 反应的发生,导致实验b中溶液褪色更快。
已知:溶液中+4价含硫微粒物质的量分数随pH变化的曲线如下图所示。

I.推测Fe3+与溶液中的某种+4价含硫微粒形成了红色的配离子。设计如下实验(均在常温下进行):
| 实验 | 溶液1(1mL) | 溶液2(10mL) | 现象 |
| A | 0.1mol·L-1 FeCl3溶液 | SO2的饱和溶液 | 溶液1与溶液2混合后,实验A、B、C所得溶液红色依次加深 |
| B | 0.1mol·L-1 FeCl3溶液 | SO2的饱和溶液,用NaOH固体调 pH=5.0 | |
| C | 0.1mol·L-1 FeCl3溶液 | _______ |
(2)配离子的配体为
 的实验证据是
的实验证据是II.探究pH对FeCl3和Na2SO3反应的影响。设计如下实验:
| 序号 | 实验a | 实验b |
| 方案 | 5mL酸化的0.1mol·L-1 FeCl3与2mL 0.1mol·L-1 Na2SO3混合得红色溶液,测得pH=1.7 | 5mL酸化的0.1mol·L-1 FeCl3与2mL 0.1mol·L-1 Na2SO3混合得红色溶液,加几滴浓盐酸,调pH=1.3 |
| 现象 | 放置10分钟后,溶液红色均褪去,实验b中溶液褪色更快。经检验,褪色后的溶液中均存在Fe2+。 | |
i.甲认为pH降低,有利于Fe3+氧化
 ,导致实验b中溶液褪色更快。
,导致实验b中溶液褪色更快。①从电极反应的角度,进行理论分析:
还原反应为:Fe3++e-=Fe2+氧化反应为:
②已知上述实验条件下pH对Fe3+的氧化性几乎没有影响。从平衡移动的角度判断pH对
 还原性的影响是
还原性的影响是③通过理论分析,甲认为其猜测
ii.乙猜测pH降低,有利于_______氧化
 ,导致实验b中溶液褪色更快。
,导致实验b中溶液褪色更快。④将乙的假设补充完整
⑤乙设计实验进行验证:
取10mL 0.1mol·L-1 Na2SO3溶液加硫酸调pH=1.7,用KMnO4溶液滴定,消耗体积为V1。另取一份相同的溶液放置10分钟后,再用KMnO4溶液滴定,消耗体积为V2.前后差值(V1-V2)为ΔVa。用同样的方法对10mL 0.1mol·L-1 Na2SO3(含H2SO4)pH=1.3进行滴定,消耗KMnO4溶液前后体积差值为ΔVb。
经对比可知,ΔVa>△Vb,由此得出的实验结论是
(4)综合上述分析,pH降低,有利于
您最近一年使用:0次
2022-04-29更新
|
1797次组卷
|
6卷引用:湖北省华中师范大学第一附属中学2022-2023学年高一上学期竞赛生10月测试化学试题
湖北省华中师范大学第一附属中学2022-2023学年高一上学期竞赛生10月测试化学试题北京市丰台区2022届高三二模化学试题(已下线)化学-2022年高考押题预测卷03(北京卷)(已下线)专项14 化学实验综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)北京市顺义区第一中学2022届高三下学期三模化学试题天天练6-10
解题方法
3 . 有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol·L-1的H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。
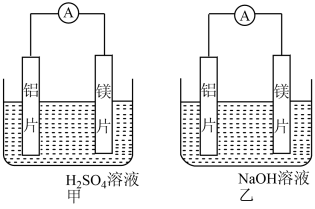
(1)写出甲中正极的电极反应式_____________________________ 。
(2)写出乙电池中总反应的离子方程式:___________________ 。
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出________ (填写元素符号,下同)的金属活动性更强,而乙会判断出________ 的金属活动性更强。
(4)由此实验,可得到如下哪些正确结论______
(5)上述实验也反过来证明了“直接利用金属活动性顺序判断原电池中的正、负极”这种做法_________ (填“可靠”或“不可靠”)。如不可靠,请你提出另一个判断原电池正、负极的可行实验___________ (如可靠,可不填写)。
(6)将5.1g镁铝合金溶于60mL 5.0 mol·L-1H2SO4溶液中,完全溶解后再加入65mL 10.0mol·L-1的NaOH溶液,得到沉淀的质量为9.7g,继续滴加NaOH溶液时沉淀会减少。
①当加入________ mL NaOH溶液时,可使溶解在硫酸的Mg2+和Al3+恰好完全沉淀。
②合金溶于硫酸时所产生的氢气在标准状况下的体积为________ L。

(1)写出甲中正极的电极反应式
(2)写出乙电池中总反应的离子方程式:
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出
(4)由此实验,可得到如下哪些正确结论
| A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质 |
| B.镁的金属活动性不一定比铝的金属活动性强 |
| C.该实验说明金属活动性顺序表已过时,已没有使用价值 |
| D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析 |
(5)上述实验也反过来证明了“直接利用金属活动性顺序判断原电池中的正、负极”这种做法
(6)将5.1g镁铝合金溶于60mL 5.0 mol·L-1H2SO4溶液中,完全溶解后再加入65mL 10.0mol·L-1的NaOH溶液,得到沉淀的质量为9.7g,继续滴加NaOH溶液时沉淀会减少。
①当加入
②合金溶于硫酸时所产生的氢气在标准状况下的体积为
您最近一年使用:0次
2019-01-30更新
|
694次组卷
|
2卷引用:2015-2016学年山西省怀仁一中高一下第三次月考化学试卷
4 . 利用化学原理对废气、废水进行脱硝、脱碳处理,可实现绿色环保、废物利用,对构建生态文明有重要意义。
(1)燃煤废气中的CO2能转化为基础化工原料、清洁能源甲醇(CH3OH,甲醇的结构式如图):
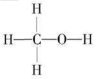
3H2(g)+CO2(g) CH3OH (g) + H2O(g) △H
CH3OH (g) + H2O(g) △H
①已知:
则△H =_________________
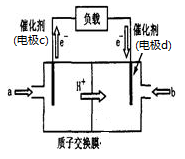
②废气中的CO2转化为甲醇可用于制作甲醇燃料电池(结构如图),质子交换膜左右两侧的溶液均为1L2mol·L-1H2SO4溶液。该燃料电池中通入甲醇的一极为____ (填a或b),当电池中有1mol e-发生转移时左右两侧溶液的质量之差为______ g (假设反应物耗尽,忽略气体的溶解)。
(2)H2还原法可消除氮氧化物
已知: N2(g)+2O2(g)=2NO2(g) △H=+133kJ·mol-1
H2O(g)= H2O(l) △H=-44kJ·mol-1
H2的燃烧热为285.8kJ·mol-1
①在催化剂存在下,H2还原NO2生成水蒸气和氮气的热化学方程式为_____________ 。
② 以H2(g)为燃料可以设计氢气燃料电池,该电池以稀NaOH作电解质溶液,其负极电极反应式为___________________________________________________________ ,已知该电池的能量转换效率为86.4%,则该电池的比能量为________ kW·h·kg-1(结果保留1位小数,比能量=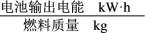 ,1 kW·h=3.6×106 J) 。
,1 kW·h=3.6×106 J) 。
(3)微生物燃料电池(MFC)是一种现代化的氨氮去除技术。下图为MFC碳氮联合同时去除的示意图。
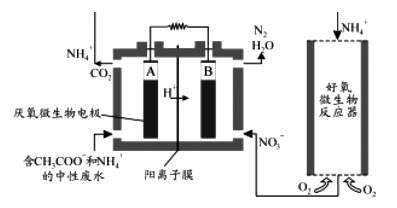
①已知A、B两极生成CO2和N2的物质的量之比为5 : 2,写出A极的电极反应式____________________________________________ 。
②解释该装置去除NH4+的原理_______________________________________________ 。
(4)利用“ Na—CO2”电池可将CO2变废为宝。

我国科研人员研制出的可充电“ Na—CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料(反应前两电极质量相等),总反应为4Na+3CO2 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
①放电时,正极的电极反应式为______________________ 。
②若生成的Na2CO3和C全部沉积在电极表面,当转移0.2 mol e-时,两极的质量差为_________ g。
(1)燃煤废气中的CO2能转化为基础化工原料、清洁能源甲醇(CH3OH,甲醇的结构式如图):

3H2(g)+CO2(g)
 CH3OH (g) + H2O(g) △H
CH3OH (g) + H2O(g) △H①已知:
| 化学键 | C-H | C-O | C=O | H-H | O-H |
| 键能/KJ/mol | 412 | 351 | 745 | 436 | 462 |
则△H =
②废气中的CO2转化为甲醇可用于制作甲醇燃料电池(结构如图),质子交换膜左右两侧的溶液均为1L2mol·L-1H2SO4溶液。该燃料电池中通入甲醇的一极为

(2)H2还原法可消除氮氧化物
已知: N2(g)+2O2(g)=2NO2(g) △H=+133kJ·mol-1
H2O(g)= H2O(l) △H=-44kJ·mol-1
H2的燃烧热为285.8kJ·mol-1
①在催化剂存在下,H2还原NO2生成水蒸气和氮气的热化学方程式为
② 以H2(g)为燃料可以设计氢气燃料电池,该电池以稀NaOH作电解质溶液,其负极电极反应式为
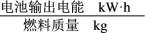 ,1 kW·h=3.6×106 J) 。
,1 kW·h=3.6×106 J) 。(3)微生物燃料电池(MFC)是一种现代化的氨氮去除技术。下图为MFC碳氮联合同时去除的示意图。

①已知A、B两极生成CO2和N2的物质的量之比为5 : 2,写出A极的电极反应式
②解释该装置去除NH4+的原理
(4)利用“ Na—CO2”电池可将CO2变废为宝。

我国科研人员研制出的可充电“ Na—CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料(反应前两电极质量相等),总反应为4Na+3CO2
 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:①放电时,正极的电极反应式为
②若生成的Na2CO3和C全部沉积在电极表面,当转移0.2 mol e-时,两极的质量差为
您最近一年使用:0次
13-14高三·湖南长沙·阶段练习
解题方法
5 . X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍。A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示。
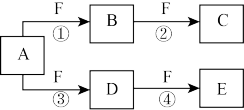
回答下列问题:
(1)A的电子式为______ 。
(2)A和E反应生成G,C与G中都含有______ (填化学键的类型)。
(3)反应③中如果转移的电子为3 mol,则被氧化的A为______ mol。
(4)科学家发明了使ZX3直接用于燃料电池的方法,其装置用铂作电极,加入碱性电解质溶液,往一极通入空气,另一电极通入ZX3并使之转化为无污染的气体,试写出负极的电极反应式:______ 。
(5)由Z、X两元素形成的含10个电子的阳离子可和XSO 形成一种盐A,若往A的溶液中缓缓滴入稀NaOH溶液至溶液恰好呈中性,则溶液中所含离子浓度由大到小的顺序为:
形成一种盐A,若往A的溶液中缓缓滴入稀NaOH溶液至溶液恰好呈中性,则溶液中所含离子浓度由大到小的顺序为:______ 。

回答下列问题:
(1)A的电子式为
(2)A和E反应生成G,C与G中都含有
(3)反应③中如果转移的电子为3 mol,则被氧化的A为
(4)科学家发明了使ZX3直接用于燃料电池的方法,其装置用铂作电极,加入碱性电解质溶液,往一极通入空气,另一电极通入ZX3并使之转化为无污染的气体,试写出负极的电极反应式:
(5)由Z、X两元素形成的含10个电子的阳离子可和XSO
 形成一种盐A,若往A的溶液中缓缓滴入稀NaOH溶液至溶液恰好呈中性,则溶液中所含离子浓度由大到小的顺序为:
形成一种盐A,若往A的溶液中缓缓滴入稀NaOH溶液至溶液恰好呈中性,则溶液中所含离子浓度由大到小的顺序为:
您最近一年使用:0次



