1 . 完成下列问题。
(1)下列反应中,属于放热反应的是_______ (填字母,下同),属于吸热反应的是_______ 。
a.盐酸与烧碱溶液反应
b.
c.氢气在氧气中燃烧生成水
d.高温煅烧石灰石使其分解
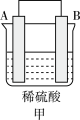
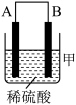
(2)为了研究化学反应A+B=C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面上升乙处液面下降。
①该反应为_______ 反应(填“放热”或“吸热”)。
②该反应的反应物化学键断裂吸收的能量________ (填“高”或“低”)于生成物化学键形成放出的能量。
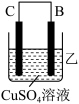
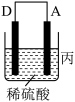
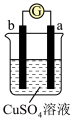
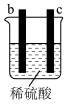
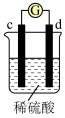
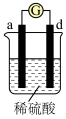
(3)A、B、C、D四种金属按下表中装置进行实验。
根据实验现象回答下列问题:
①装置甲中负极是_______ (填“A”或“B”)极。
②装置乙中正极有铜生成则正级电极反应式为_______ 。
③四种金属活动性由强到弱的顺序是_______ 。
(4)甲烷可直接应用于燃料电池,该电池采用KOH溶液为见解质,其工作原理如下图所示:_______ (填“a极到b极”或“b极到a极”)。
②a电极的电极方程式为_______ 。
(1)下列反应中,属于放热反应的是
a.盐酸与烧碱溶液反应
b.

c.氢气在氧气中燃烧生成水
d.高温煅烧石灰石使其分解
(2)为了研究化学反应A+B=C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面上升乙处液面下降。
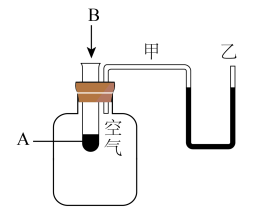
①该反应为
②该反应的反应物化学键断裂吸收的能量
(3)A、B、C、D四种金属按下表中装置进行实验。
| 装置 |
|
|
|
| 现象 | 金属A不断溶解 | C的质量增加 | A上有气体产生 |
①装置甲中负极是
②装置乙中正极有铜生成则正级电极反应式为
③四种金属活动性由强到弱的顺序是
(4)甲烷可直接应用于燃料电池,该电池采用KOH溶液为见解质,其工作原理如下图所示:
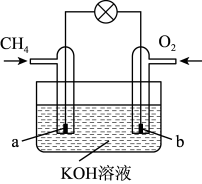
②a电极的电极方程式为
您最近一年使用:0次
名校
解题方法
2 . 某同学利用铁与硫酸的反应,探究影响反应速率的因素(实验所用铁的质量相等且铁块的形状相同,硫酸均过量),实验设计如表,回答下列问题:
(1)若四组实验均以收集到448mL(折算为标准状况下)氢气为标准,则上述实验中还需要测定的数据是_______ 。
(2)实验1和2是探究_______ 对该反应速率的影响;实验_______ 和_______ 是探究温度对该反应速率的影响。
(3)根据实验测得的在不同时间t产生氢气体积V的数据,绘制得到图甲,则曲线c对应的实验组别是_______ 。根据实验数据,该同学发现对于每一组实验,产生氢气的速率v随时间t变化情况如图乙所示,其中t1~t2速率变化的主要原因是_______ 。
(5)进行实验3时,若将稀硫酸改为40 mL 4.0 mol/L盐酸(其他条件不变),发现盐酸中放出气泡的速率明显比硫酸快。你认为可能的原因是_______ (忽略温度对反应速率的影响)。
(6)铁与硫酸的反应制取氢气的实验中,发现加入少量CuSO4溶液时,生成氢气的速率会大大提高,请分析主要原因:_______ 。
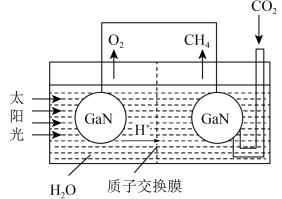
(7)下图表示铜与氮化镓组装成的人工光合系统的工作原理,铜电极上发生反应的电极反应式为____ 。向该系统中通入标况下6.72LCO2,理论上可产生氧气的物质的量为____ mol。
| 实验编号 | 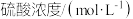 |  | 铁的状态 | 温度/.K |
| 1 | 1.00 | 40 | 块状 | 293 |
| 2 | 2.00 | 40 | 块状 | 293 |
| 3 | 2.00 | 40 | 粉末 | 293 |
| 4 | 2.00 | 40 | 块状 | 313 |
(1)若四组实验均以收集到448mL(折算为标准状况下)氢气为标准,则上述实验中还需要测定的数据是
(2)实验1和2是探究
(3)根据实验测得的在不同时间t产生氢气体积V的数据,绘制得到图甲,则曲线c对应的实验组别是

| A.加蒸馏水 | B.减小压强 | C.加入CH3COONa | D.加CuSO4固体 |
(5)进行实验3时,若将稀硫酸改为40 mL 4.0 mol/L盐酸(其他条件不变),发现盐酸中放出气泡的速率明显比硫酸快。你认为可能的原因是
(6)铁与硫酸的反应制取氢气的实验中,发现加入少量CuSO4溶液时,生成氢气的速率会大大提高,请分析主要原因:
(7)下图表示铜与氮化镓组装成的人工光合系统的工作原理,铜电极上发生反应的电极反应式为
您最近一年使用:0次
3 . 化学电源在生产生活中有着广泛的应用,同学们常常通过设计实验和查阅资料的方式学习化学电源的相关知识。_____ Ⅱ(>、<或=),温度计的示数Ⅰ_____ II(>、<或=);
(2)乙同学用如图乙装置推算铜锌原电池工作时产生的电流量。供选择的电极材料有纯铜片和纯锌片。则a电极的电极反应式为_____ ,当量筒中收集到336mL(标准状况下)气体时,通过导线的电子的物质的量为_____ 。
(3)丙同学了解到科学家正在研究利用原电池原理常温常压下合成氨,在该装置简图丙中,电极a为_____ 极(填“正”或“负”),若原料气H2中混有CO,单位体积原料气合成氨气的物质的量不变,只是在电极b附近需增设排气口,排出气体主要含有_____ 。
(4)FeCl3常用于腐蚀印刷电路铜板(2FeCl3+Cu=2FeCl2+CuCl2)请将此反应设计成原电池,该原电池负极的电极材料为_____ ,正极的电极材料为_____ ,电解质溶液为_____ ,负极的电极反应式为_____ 。

(2)乙同学用如图乙装置推算铜锌原电池工作时产生的电流量。供选择的电极材料有纯铜片和纯锌片。则a电极的电极反应式为
(3)丙同学了解到科学家正在研究利用原电池原理常温常压下合成氨,在该装置简图丙中,电极a为
(4)FeCl3常用于腐蚀印刷电路铜板(2FeCl3+Cu=2FeCl2+CuCl2)请将此反应设计成原电池,该原电池负极的电极材料为
您最近一年使用:0次
名校
4 . 化学反应与能量变化是化学研究的重要问题,根据相关材料分析回答:
(1)汽车发动机工作时会引发 和
和 反应,生成
反应,生成 等污染大气,其中生成
等污染大气,其中生成 的能量变化如图所示,则图中三种分子最稳定的是
的能量变化如图所示,则图中三种分子最稳定的是_________________ 。
(3)把 四种金属按表中装置进行实验。
四种金属按表中装置进行实验。
根据表中信息判断四种金属活动性由大到小的顺序是_____________ ;写出装置乙中正极的电极反应式:_____________________ ,当转移电子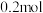 时,则理论上增重为
时,则理论上增重为_________________________  。
。
(4)一种熔融碳酸盐燃料电池原理示意如图所示。电池工作时,外电路上电流的方向应从电极_____________ (填A或B)流向用电器。内电路中, 向电极
向电极_________________________ (填A或B)移动,电极A上 参与的电极反应为
参与的电极反应为_________________________________ 。
(1)汽车发动机工作时会引发
 和
和 反应,生成
反应,生成 等污染大气,其中生成
等污染大气,其中生成 的能量变化如图所示,则图中三种分子最稳定的是
的能量变化如图所示,则图中三种分子最稳定的是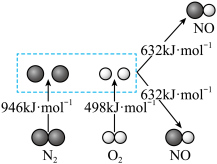
A.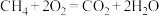 | B. |
C. | D. |
(3)把
 四种金属按表中装置进行实验。
四种金属按表中装置进行实验。装置 |
|
|
|
| 电子从A到B | C电极的质量增加 | 二价金属D不断熔解 |
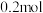 时,则理论上增重为
时,则理论上增重为 。
。(4)一种熔融碳酸盐燃料电池原理示意如图所示。电池工作时,外电路上电流的方向应从电极
 向电极
向电极 参与的电极反应为
参与的电极反应为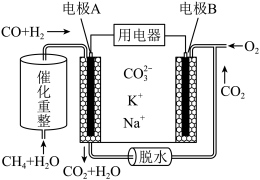
您最近一年使用:0次
5 . 一种 -空气燃料电池的工作原理如图所示,该电池工作时,下列说法正确的是
-空气燃料电池的工作原理如图所示,该电池工作时,下列说法正确的是
 -空气燃料电池的工作原理如图所示,该电池工作时,下列说法正确的是
-空气燃料电池的工作原理如图所示,该电池工作时,下列说法正确的是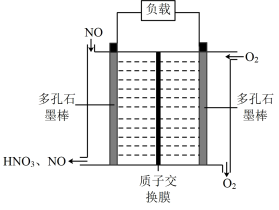
A. 通过质子交换膜向左侧多孔石墨棒移动 通过质子交换膜向左侧多孔石墨棒移动 |
| B.电流的流动方向:左侧多孔石墨棒→电解质溶液→右侧多孔石墨棒 |
C.若产生 ,则通入 ,则通入 的体积应大于 的体积应大于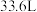 |
D.放电过程中正极的电极反应式为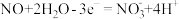 |
您最近一年使用:0次
名校
解题方法
6 . 按要求回答下列问题:
(1)为了验证 与
与 氧化性的强弱,下列装置能达到实验目的的是
氧化性的强弱,下列装置能达到实验目的的是____ ,若开始时原电池中两个电极的质量相等,当导线中通过0.05 mol电子时,两个电极的质量差为____ 。 与
与 的反应设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。
的反应设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。 向B电极移动,则
向B电极移动,则_______ (填“A”或“B”)处电极入口通甲烷。
②当消耗甲烷的体积为33.6 L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为_______ 。
(3)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为 ,原电池负极的电极反应为
,原电池负极的电极反应为_____ ;正极附近溶液的碱性_____ (填“增强”“不变”或“减弱”)。
(1)为了验证
 与
与 氧化性的强弱,下列装置能达到实验目的的是
氧化性的强弱,下列装置能达到实验目的的是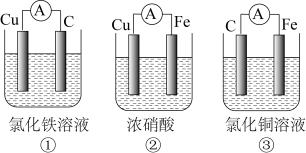
 与
与 的反应设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。
的反应设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。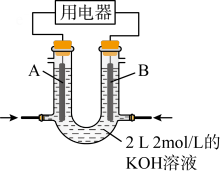
 向B电极移动,则
向B电极移动,则②当消耗甲烷的体积为33.6 L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为
(3)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为
 ,原电池负极的电极反应为
,原电池负极的电极反应为
您最近一年使用:0次
名校
7 . 有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
由此可判断这四种金属的活动性顺序是
| 实验装置 |
|
|
| 部分实验现象 | a极质量减小,b极质量增加 | b极有气体产生,c极无变化 |
| 实验装置 |
|
|
| 部分实验现象 | d极溶解,c极有气体产生 | 电流计指示在导线中电流从a极流向d极 |
A. | B. |
C. | D. |
您最近一年使用:0次
名校
解题方法
8 . 硝酸生产的尾气中NO和 等氮氧化物以及酸性废水中
等氮氧化物以及酸性废水中 均须处理达标后再排放。
均须处理达标后再排放。
Ⅰ.硝酸生产的尾气中NO和 的处理。
的处理。
(1)硝酸尾气可用NaOH溶液吸收,主要反应为 ;
; ;
;
①吸收后的溶液经浓缩、结晶、过滤,得到 晶体,该晶体中的主要杂质是
晶体,该晶体中的主要杂质是___________ (填化学式);
②吸收后排放的尾气中含量较高的氮氧化物是___________ (填化学式)。
(2)用NaClO溶液也能除去尾气中NO。其他条件相同,NO去除为 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。 的离子方程式为
的离子方程式为___________ ;NaClO溶液的初始pH越大,NO转化率越低。其原因是___________ 。
(3)利用 也能够还原氮氧化物(
也能够还原氮氧化物( )实现氮污染的治理。将硝酸尾气与
)实现氮污染的治理。将硝酸尾气与 的混合气体通入
的混合气体通入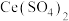 与
与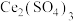 的混合溶液中实现无害化处理,其转化过程如图所示。
的混合溶液中实现无害化处理,其转化过程如图所示。 参与的离子方程式为
参与的离子方程式为___________ 。
②若该过程中,每转移3.6mol电子消耗1mol氮氧化物( ),则x为
),则x为___________ 。
Ⅱ.酸性废水中 的处理
的处理
(4)在45℃、惰性气体氛围中金属或合金可以将溶液废水中的 还原为
还原为 ,从而实现脱氨。量取三份50mL含
,从而实现脱氨。量取三份50mL含 的废水,分别用金属铝、金属铁和铝铁合金进行处理,溶液中
的废水,分别用金属铝、金属铁和铝铁合金进行处理,溶液中 的残留率(残留率=
的残留率(残留率=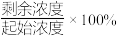 )与反应时间的关系如图所示。0~2h内,铝铁合金的脱氮效率比金属铝、金属铁要高得多,其可能原因是
)与反应时间的关系如图所示。0~2h内,铝铁合金的脱氮效率比金属铝、金属铁要高得多,其可能原因是___________ 。 ,废水中的
,废水中的 在水处理剂表面的变化如图所示,该电池正极上的电极反应式为
在水处理剂表面的变化如图所示,该电池正极上的电极反应式为___________ 。
 等氮氧化物以及酸性废水中
等氮氧化物以及酸性废水中 均须处理达标后再排放。
均须处理达标后再排放。Ⅰ.硝酸生产的尾气中NO和
 的处理。
的处理。(1)硝酸尾气可用NaOH溶液吸收,主要反应为
 ;
; ;
;①吸收后的溶液经浓缩、结晶、过滤,得到
 晶体,该晶体中的主要杂质是
晶体,该晶体中的主要杂质是②吸收后排放的尾气中含量较高的氮氧化物是
(2)用NaClO溶液也能除去尾气中NO。其他条件相同,NO去除为
 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。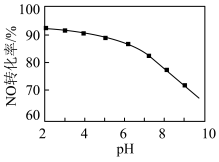
 的离子方程式为
的离子方程式为(3)利用
 也能够还原氮氧化物(
也能够还原氮氧化物( )实现氮污染的治理。将硝酸尾气与
)实现氮污染的治理。将硝酸尾气与 的混合气体通入
的混合气体通入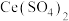 与
与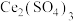 的混合溶液中实现无害化处理,其转化过程如图所示。
的混合溶液中实现无害化处理,其转化过程如图所示。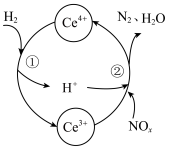
 参与的离子方程式为
参与的离子方程式为②若该过程中,每转移3.6mol电子消耗1mol氮氧化物(
 ),则x为
),则x为Ⅱ.酸性废水中
 的处理
的处理(4)在45℃、惰性气体氛围中金属或合金可以将溶液废水中的
 还原为
还原为 ,从而实现脱氨。量取三份50mL含
,从而实现脱氨。量取三份50mL含 的废水,分别用金属铝、金属铁和铝铁合金进行处理,溶液中
的废水,分别用金属铝、金属铁和铝铁合金进行处理,溶液中 的残留率(残留率=
的残留率(残留率=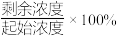 )与反应时间的关系如图所示。0~2h内,铝铁合金的脱氮效率比金属铝、金属铁要高得多,其可能原因是
)与反应时间的关系如图所示。0~2h内,铝铁合金的脱氮效率比金属铝、金属铁要高得多,其可能原因是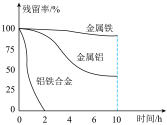
 ,废水中的
,废水中的 在水处理剂表面的变化如图所示,该电池正极上的电极反应式为
在水处理剂表面的变化如图所示,该电池正极上的电极反应式为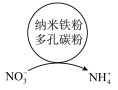
您最近一年使用:0次
2024-05-06更新
|
163次组卷
|
2卷引用:江苏省扬州市邗江中学2023-2024学年高一下学期三月检测化学试题
9 . 按要求回答问题。
(1)制作印刷电路板的过程中常用FeCl3溶液与铜反应2Fe3++Cu=2Fe2++Cu2+,把该反应设计成原电池,可用___________ 作正极材料,正极反应的电极方程式为___________ 。
(2)氢氧燃料电池的构造如图所示,由此判断OH-向___________ (填“正”或“负”)极定向移动,Y极的电极反应式为___________ 。 Pb+PbO2+2H2SO4。铅蓄电池放电时正极电极质量
Pb+PbO2+2H2SO4。铅蓄电池放电时正极电极质量___________ (填“增大”或“减小”)。放电过程中,外电路中转移2.5 mol e-,消耗硫酸___________ mol。
(4)某电解池装置如图所示,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则___________ 。
②Y电极上的电极反应式为___________ ,检验该电极反应产物的方法及现象是___________ 。
(1)制作印刷电路板的过程中常用FeCl3溶液与铜反应2Fe3++Cu=2Fe2++Cu2+,把该反应设计成原电池,可用
(2)氢氧燃料电池的构造如图所示,由此判断OH-向

 Pb+PbO2+2H2SO4。铅蓄电池放电时正极电极质量
Pb+PbO2+2H2SO4。铅蓄电池放电时正极电极质量(4)某电解池装置如图所示,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
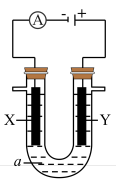
②Y电极上的电极反应式为
您最近一年使用:0次
2024-05-06更新
|
168次组卷
|
2卷引用:江苏省扬州市邗江中学2023-2024学年高一下学期三月检测化学试题
名校
解题方法
10 . 一种新型微生物燃料电池可用于污水净化、海水淡化,其工作原理如图所示,下列说法正确的是。
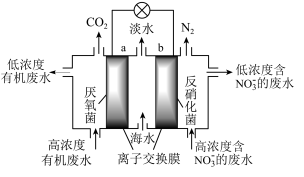
| A.该电池能在高温下工作 |
| B.a极为电池的正极 |
| C.有机废水处理后pH降低 |
D.处理 的电极反应为 的电极反应为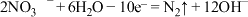 |
您最近一年使用:0次